介绍
下背部射痛,放射到臀部和下肢。 一年前的手术。 症状恶化。
患者数据
年龄:35岁
性别:女
MRI
丛状神经纤维瘤的恶性转化
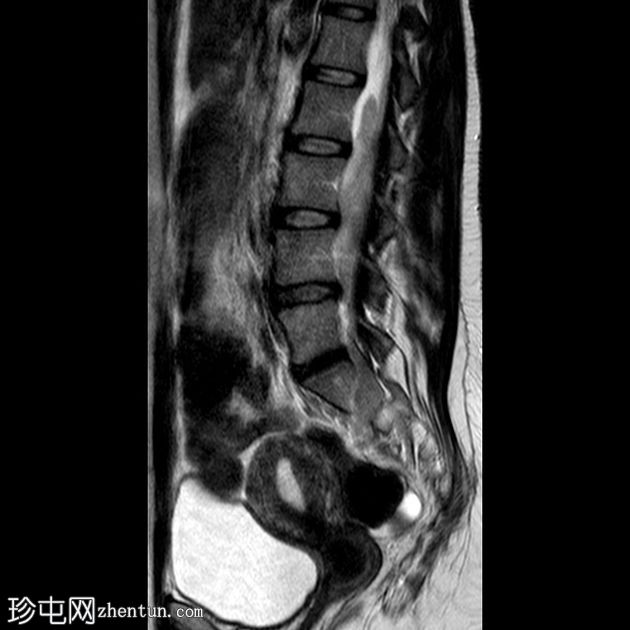
Sagittal T2
丛状神经纤维瘤的恶性转化
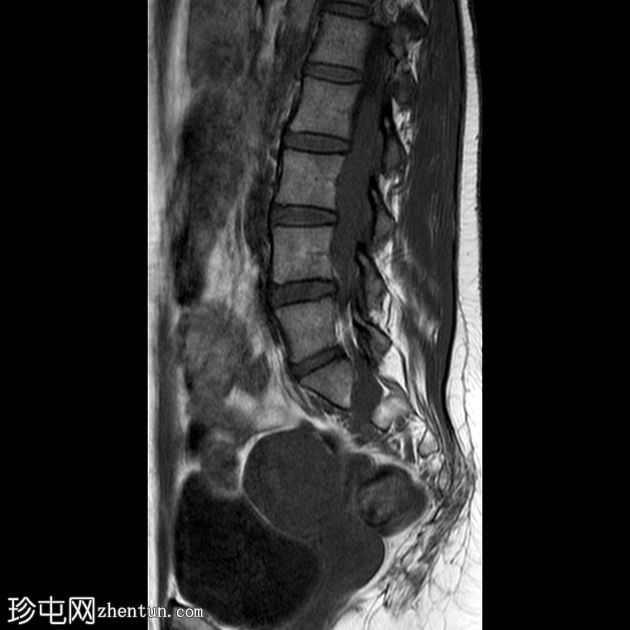
Sagittal T1
丛状神经纤维瘤的恶性转化
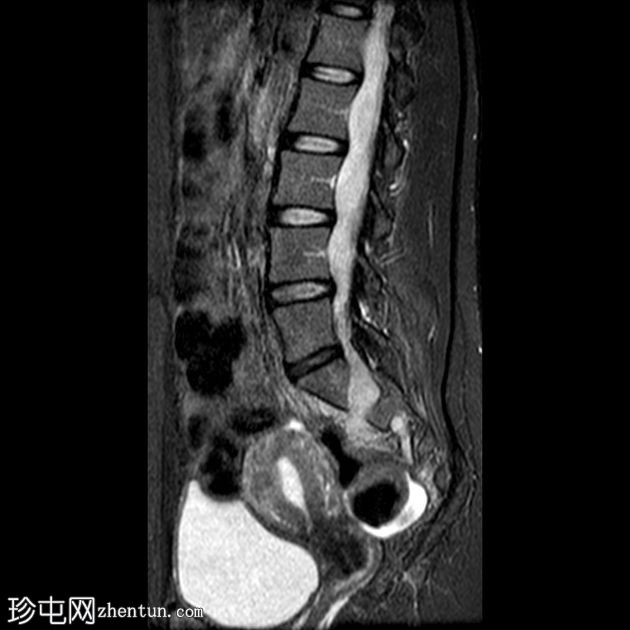
Sagittal STIR
丛状神经纤维瘤的恶性转化
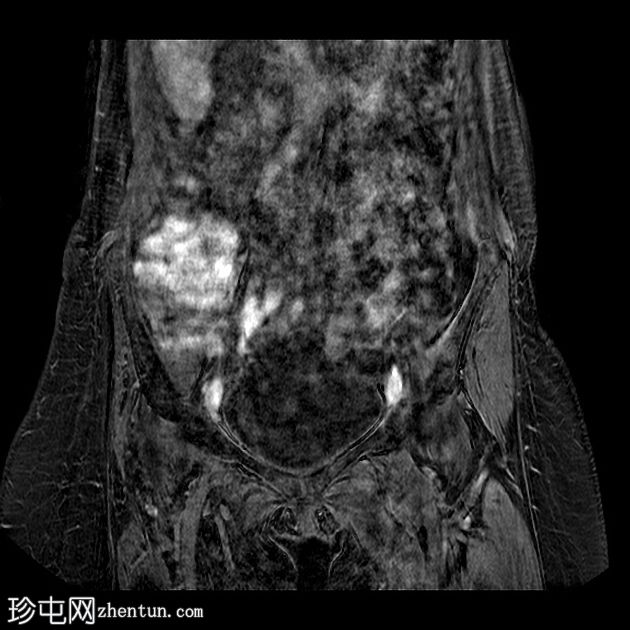
Coronal T1
丛状神经纤维瘤的恶性转化
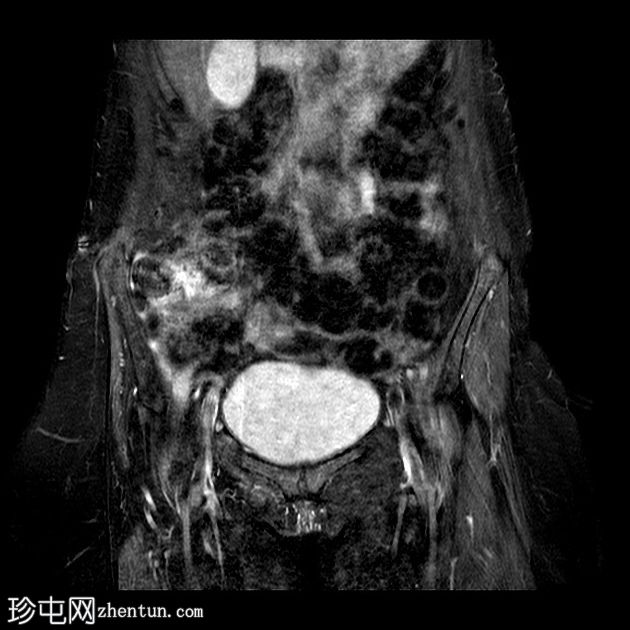
Coronal T2
丛状神经纤维瘤的恶性转化
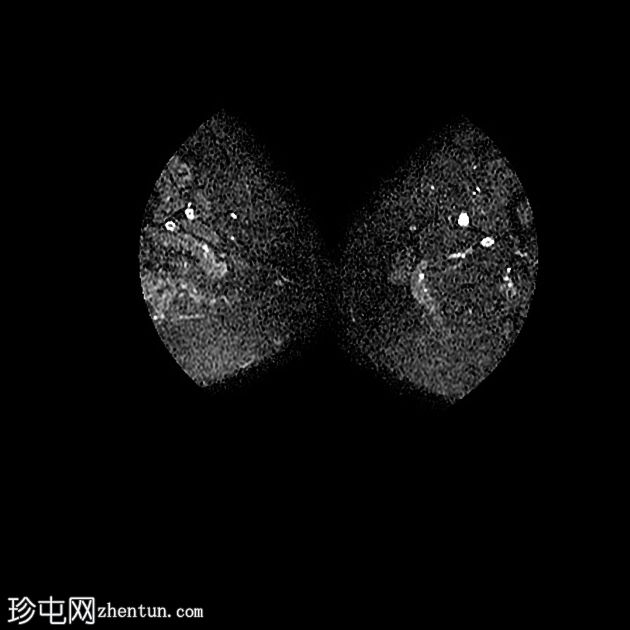
Axial T2
丛状神经纤维瘤的恶性转化
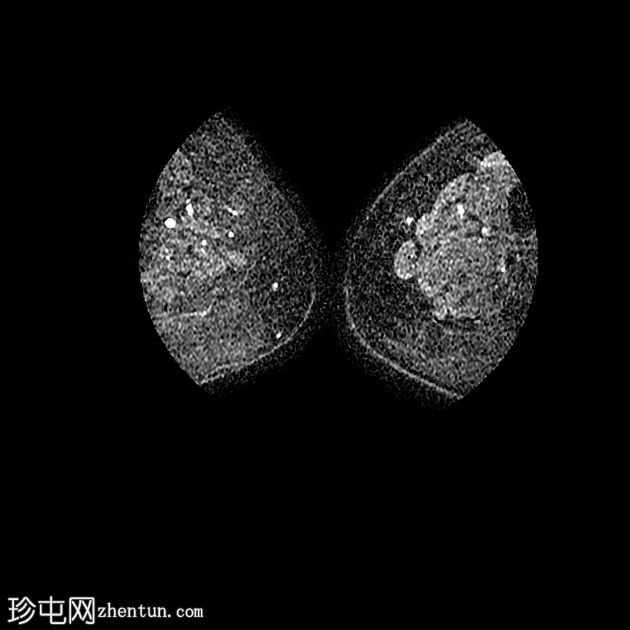
Axial T1
丛状神经纤维瘤的恶性转化
Axial T1
丛状神经纤维瘤的恶性转化
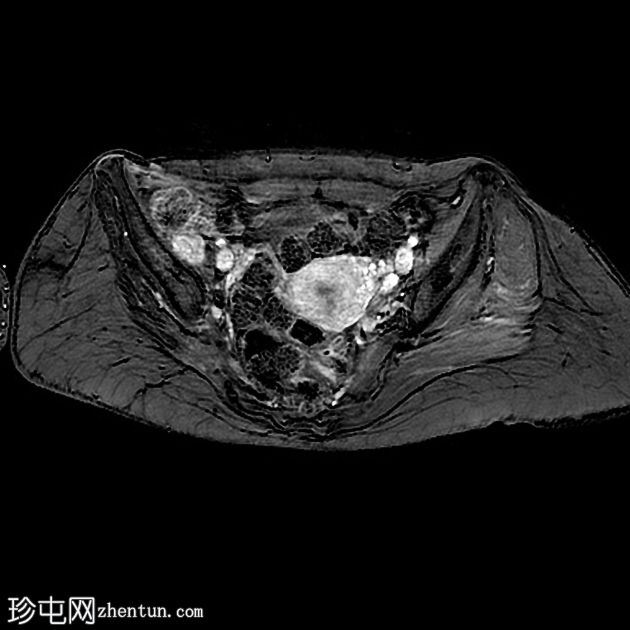
Axial T1 C+
丛状神经纤维瘤的恶性转化
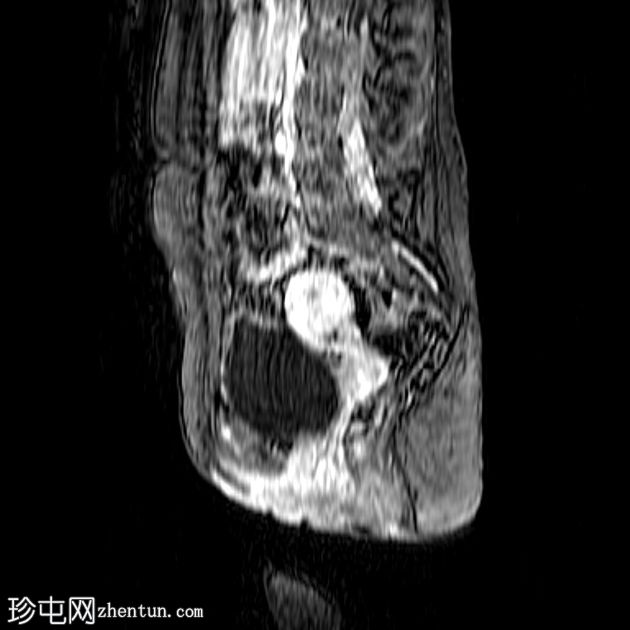
Sagittal T1 C+
丛状神经纤维瘤的恶性转化
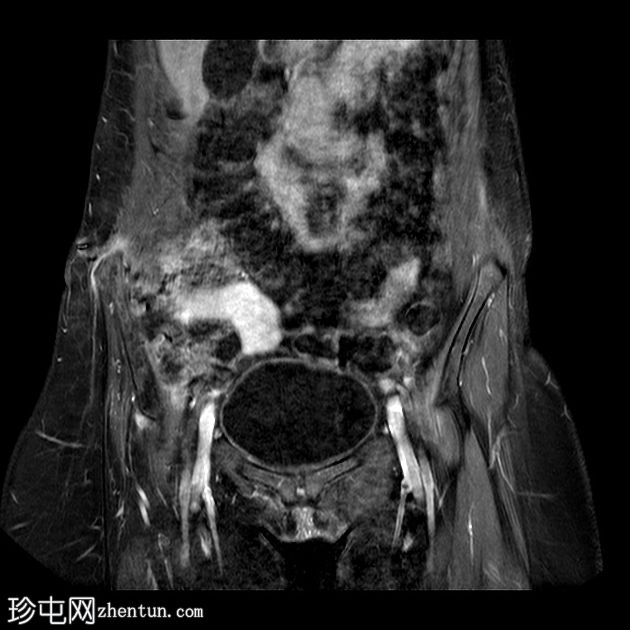
Coronal T1 C+
腰椎:
有继发于右侧腰骶丛状神经纤维瘤部分切除术的术后表现。注意到切除的右侧 L4、L5、S1、S2 和 S3 神经的根残端,以及肿胀的右侧 L5 神经根残端。
与之前的 MRI(未显示并在另一个中心进行)相比,占据椎管的肿瘤组织从 L2 到 S1 的大小有所增加,尤其是 L5 神经根。
腰骶丛残根和分支增粗和增大,特别是右侧 L2 和 L3 神经根和左侧 L4、L5、S1、S2 和 S3 根(以前未受累)。
右股神经骨盆束增厚和肿胀。
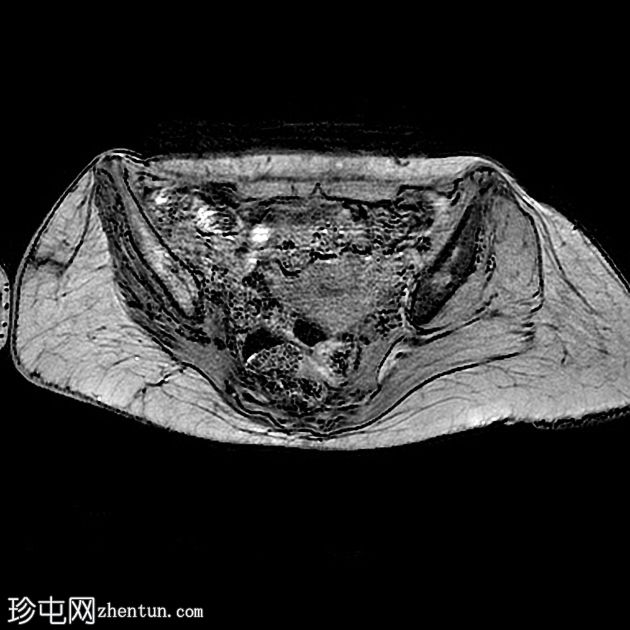
骨盆:
手术切除右侧坐骨神经、臀大肌、腘绳肌和右侧髋关节外旋肌后,右侧骨盆和右侧股骨近端发生手术后变化。右臀部周围有积液。
由于慢性去神经支配,右侧残余臀肌、内收肌、闭孔肌、梨状肌和右大腿前隔室肌肉的营养显着减少和信号改变。继发于亚急性去神经支配的 T2 序列上,右侧椎旁肌也呈高信号
在左侧卵巢有一个厚壁囊性病变,周围有强烈的强化,可能是黄体。
核医学
丛状神经纤维瘤的恶性转化
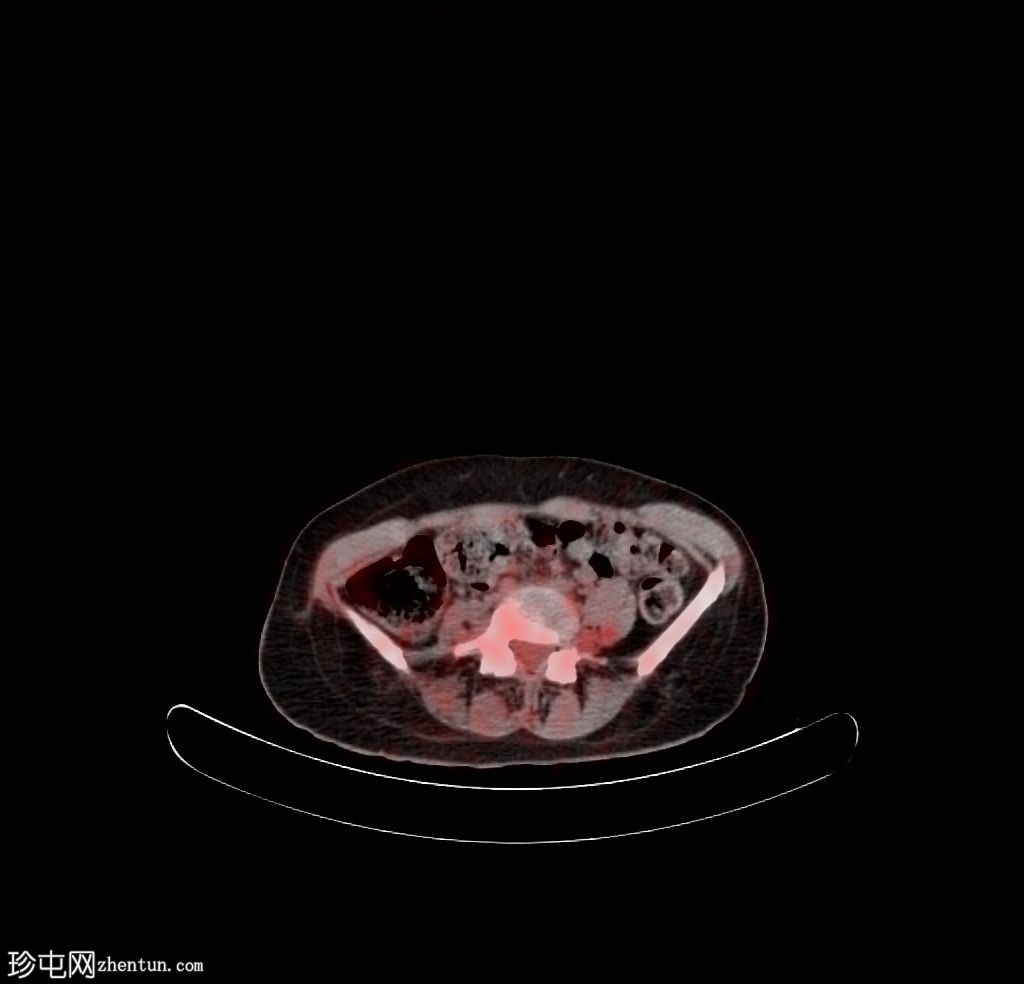
Axial fused PET/CT
丛状神经纤维瘤的恶性转化
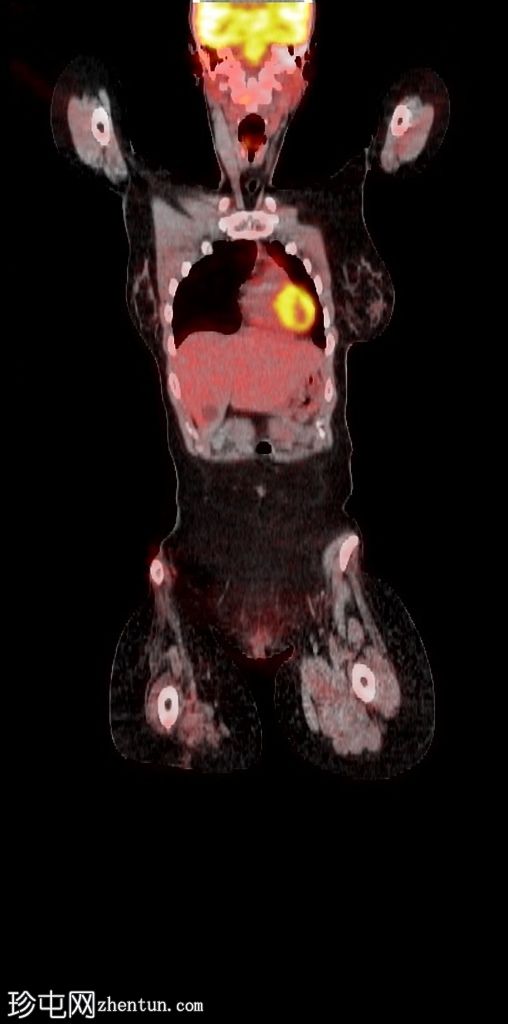
Coronal fused PET/CT
丛状神经纤维瘤的恶性转化
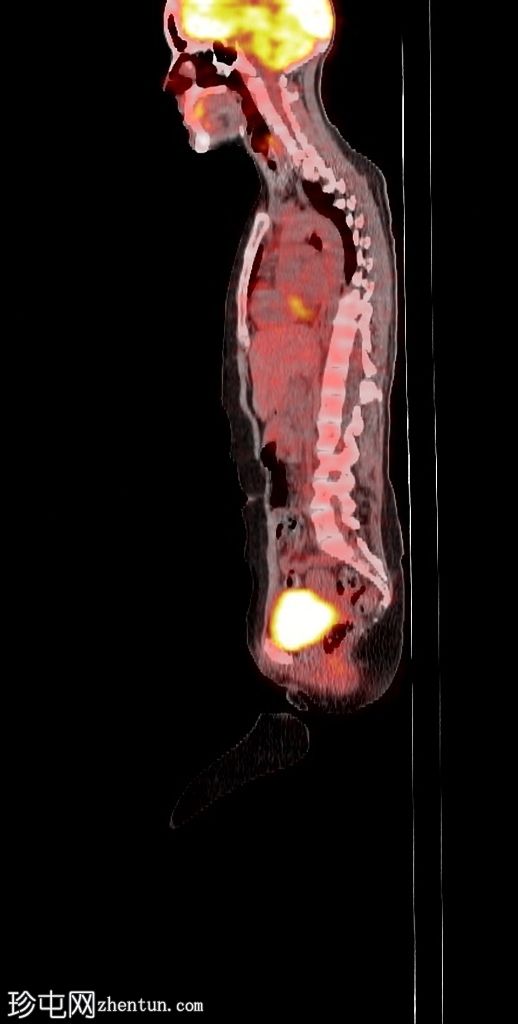
Sagittal fused PET/CT
丛状神经纤维瘤的恶性转化
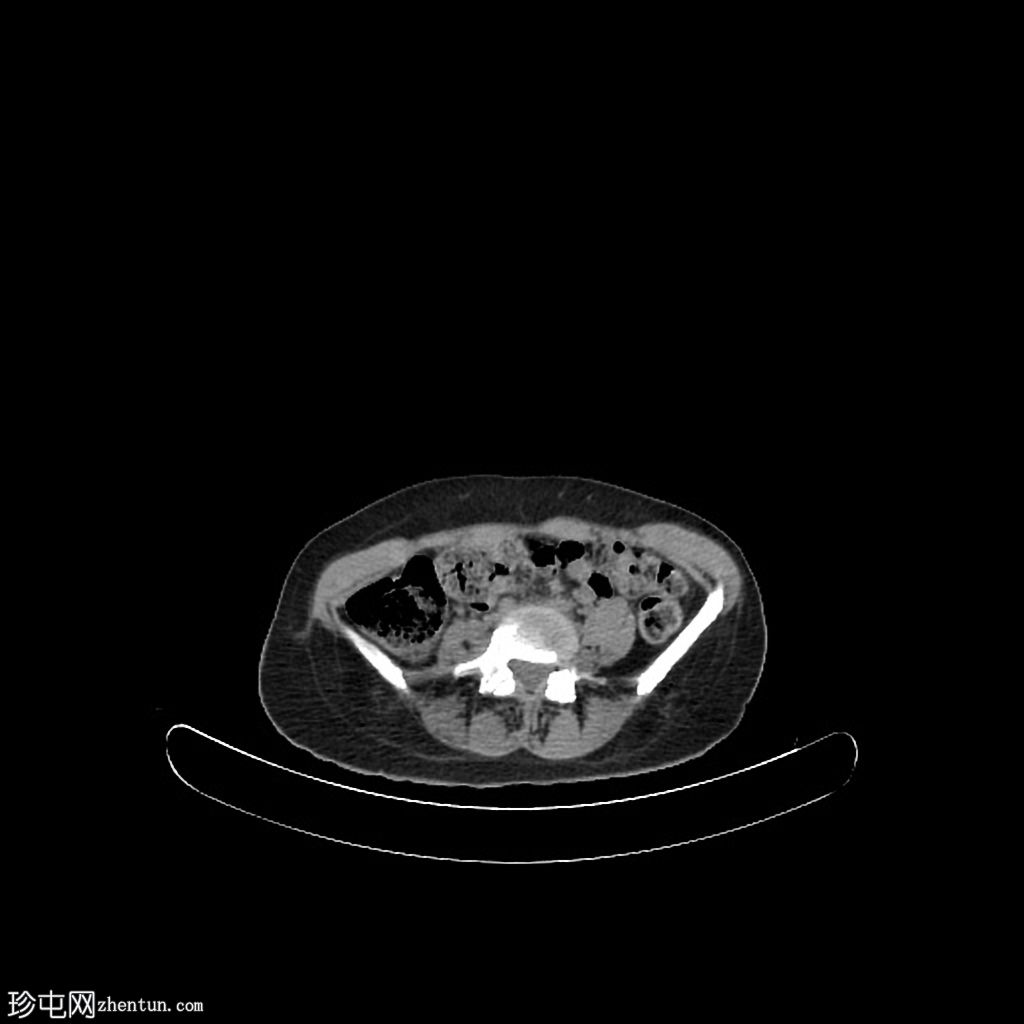
Axial low dose CT
丛状神经纤维瘤的恶性转化

Axial PET
丛状神经纤维瘤的恶性转化
Coronal PET
丛状神经纤维瘤的恶性转化
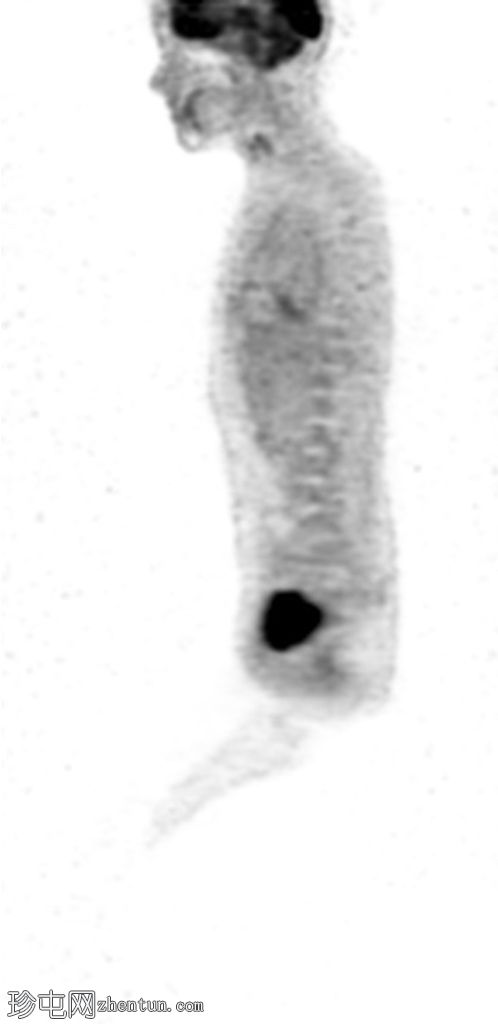
Sagittal PET
右侧 L5 神经根残端的 FDG 摄取适度增加 (SUVmax 5.34)。沿椎管从 L2 到 S1 的 FDG 摄取进一步轻度增加(在 L2-L3 水平看到局部更高的摄取 - SUV max 3.31)和腰骶丛神经根。
在手术部位、右侧髋关节周围的软组织、右侧闭孔肌和臀肌中以及与炎症保持一致的手术疤痕处发现了弥漫性非特异性摄取。
右大腿后侧可见高皮肤 - 皮下 FDG 摄取(手术期间报告烧伤)。
案例讨论
初次手术后,患者被诊断出患有右侧坐骨神经恶性神经鞘瘤(MNST),并被切除。由于组织学发现肿瘤向近端延伸,患者接受了第二次手术,切除了 L4、L5、S1、S2 和 S3 神经根。当患者接受核磁共振检查时,她抱怨她的慢性疼痛恶化和活动受限。 PET 扫描后,她失去了随访。
MRI显示椎管内肿瘤组织增大,腰骶神经丛根支受累增多,右侧L5神经根残端出现,疑似恶变。
右侧 L5 神经根残端局灶性适度增加的摄取引起 MPNST 的怀疑,但与良性神经纤维瘤的成像特征存在重叠。
大约 40-50% 的 MNST 发生在 1 型神经纤维瘤病 (NF1)1 患者中。其余病例是散发性的,10-13% 发生在先前放射治疗的部位 2, 3, 4。一些散发性丛状神经纤维瘤病例已在没有 NF1 其他特征的患者中被描述,由体细胞 NF1 嵌合引起 5, 6 。大约 10% 的 NF1 患者发生 MPNST,通常来自丛状神经纤维瘤 7。
该患者既往无放疗史,不知道是否受NF1影响(她没有NF1的临床特征,但NF1基因的分子遗传学检测结果未知)。
参考
1. Carroll, S. L. Molecular mechanisms promoting the pathogenesis of Schwann cell neoplasms. Acta Neuropathol. 123, 321–348. https://doi.org/10.1007/s00401-011-0928-6 (2012).
2. Kolberg, M. et al. Survival meta-analyses for >1800 malignant peripheral nerve sheath tumor patients with and without neurofibromatosis type 1. Neuro Oncol. 15, 135–147. https://doi.org/10.1093/neuonc/nos287 (2013).
3. Watson, K. L. et al. Patterns of recurrence and survival in sporadic, neurofibromatosis Type 1-associated, and radiation-associated malignant peripheral nerve sheath tumors. J. Neurosurg. 126, 319–329. https://doi.org/10.3171/2015.12.JNS152443 (2017).
4. LaFemina, J. et al. Oncologic outcomes of sporadic, neurofibromatosis-associated, and radiation-induced malignant peripheral nerve sheath tumors. Ann. Surg. Oncol. 20, 66–72. https://doi.org/10.1245/s10434-012-2573-2 (2013).
5. Ogose A, Hotta T, Imaizumi S, Saito H, Homma T, Takahashi HE. 2000. Deep-seated segmental neurofibromatosis without cafe′-au-lait spots. Skeletal Radiol 29:543–547.
6. Ruggieri M, Huson SM. 2001. The clinical and diagnostic implications of mosaicism in the neurofibromatoses. Neurology 56:1433–1443.
7. McGaughran JM, Harris DI, Donnai D, et al (1999) A clinical study of type 1 neurofibromatosis in north west England. J Med Genet 36: 197–203 |