概要
癌症因其细胞变化而闻名,有助于肿瘤生长和细胞增殖。作为这些变化的一部分,在几种癌症中鉴定出代谢重排,包括多发性骨髓瘤(MM),其是恶性浆细胞在骨髓(BM)中累积的病症。这些代谢变化包括MM细胞中代谢物的产生,抑制和积累以及代谢变化。 BM微环境的变化可能是进行此类调整的原因。与健康细胞相比,在MM细胞中发现糖酵解和谷氨酰胺酶的增强。代谢物和酶可以被上调或下调,并且在耐药性中起关键作用。因此,本综述将重点关注与抗药性出现相关的葡萄糖和谷氨酰胺代谢的变化。此外,代谢物不仅影响其他代谢成分,有利于癌症的发展;它们还干扰参与增殖和凋亡调节的转录因子。
关键词:代谢,多发性骨髓瘤,骨髓微环境
1.简介
在这篇综述中,我们关注多发性骨髓瘤(MM)中癌症代谢的机制,这是一种血液系统恶性肿瘤,被描述为骨髓功能障碍细胞(BM)的扩张。这种恶性浆细胞的扩增和积累与血清和尿液中高水平的单克隆蛋白(M-spike)有关[1]。这种疾病之前通常是一种癌前病症,称为意义不明的单克隆丙种球蛋白病(MGUS),MM出现[1,2]。恶性浆细胞的扩增和过量的M蛋白的产生导致MM中经常观察到的以下症状:高钙血症,肾衰竭,贫血和骨病变(CRAB特征)[3,4]。报告估计每年欧洲新发病例41,719例,死亡人数20,462例。在全球范围内,MM每年影响每100,000人中有1-5人。尽管治疗取得了进展,但MM仍然是一种无法治愈的疾病,由于人口老龄化,患病率继续增加,诊断时的中位年龄为73-75岁[5,6,7]。早期疗法是美法仑与泼尼松联合,然后是美法仑和自体造血干细胞移植。在过去十年中,新型疗法改善了MM患者的生存,例如蛋白酶体抑制剂硼替佐米和免疫调节药物(IMiDs)沙利度胺,来那度胺和泊马度胺。此外,已经显示了用单克隆抗体daratumumab的有希望的初步结果。这些药物还与免疫抑制药物地塞米松合用[8,9]。这些药物可以提高完全反应率和总体生存率[9]。尽管总体存活率有所提高,但MM患者最终复发。这种复发的主要原因是耐药性的发展。这可能是基因突变或核糖体蛋白(60S核糖体蛋白的单等位基因丢失)本质上,其中核糖体蛋白减少与肿瘤进展和耐药性相关;或BM外部微观环境[10,11]。
众所周知,实体肿瘤中强烈和复杂的新生血管形成会增加肿瘤的生长和转移[12,13]。类似地,尽管MM是位于BM中的非实体肿瘤,但通过分泌诸如血管内皮生长因子(VEGF)和成纤维细胞生长因子-2(FGF-2)的细胞因子来增加血管发育。此外,白细胞介素-6(IL-6)由BM内皮细胞分泌,其促进MM细胞中的细胞生长。这导致血管形成的增加,其促进MM进展并且与不良存活相关。虽然已经研究抗血管生成疗法作为MM中的抗癌剂,但这可能具有一些副作用。血管生成导致更高的氧通路,导致较低的缺氧环境。因此,抗血管生成疗法的使用将导致更加缺氧的环境,以及更高的肿瘤细胞的糖酵解速率[1,14,15,16]。
除了IL-6的作用外,还存在IL-6和IL-3的协同活性,导致浆细胞从外周血单核细胞分化[17]。
BM微环境由两个不同的隔室组成:细胞和非细胞隔室。前者包括一方面对免疫系统重要的造血细胞和另一方面非骨髓基质细胞(BMSC),成纤维细胞,成骨细胞和血管等非造血细胞[1,18]。非细胞区室由纤连蛋白,层粘连蛋白和胶原蛋白组成[19]。恶性细胞对BM微环境的功能有影响,有利于它们的存活和生长。实际上,MM细胞通过粘附与BMSC相互作用,导致细胞周期途径和抗细胞凋亡途径的激活,如Janus激酶(JAK)/信号转导和转录激活因子3(STAT3),这导致抗体的上调。凋亡蛋白BcL-xL和Mcl-1。 NF-κB信号传导也被凋亡蛋白抑制剂(IAP)激活作为抗凋亡蛋白[1,20]。 MM细胞对BM的这些作用可以解释MM患者中贫血的存在,因为浸润的MM细胞可能不利于骨髓红细胞生成细胞,这可能导致由于MM细胞产生特异性细胞因子(例如Fas配体)导致的红细胞凋亡( FL),肿瘤坏死因子(TNF)和TNF相关凋亡诱导配体(TRAIL)[21]。
MM的进一步特征在于骨溶解,其中恶性浆细胞激活破骨细胞(OC)祖细胞并引发破骨细胞骨吸收。通过血管细胞粘附分子1(VCAM-1)和α4β1整联蛋白在BM中粘附MM细胞来刺激破骨细胞形成。与核因子κB配体(RANKL)的受体激活剂一起,它们属于诱导骨溶解的破骨细胞生成因子[22,23]。此外,由恶性浆细胞分泌的白细胞介素-1β(IL-1β)和TNF-β被定义为破骨细胞激活因子(OAF),因为它们具有破骨细胞活化和骨重吸收功能[24]。
除了BM细胞在BM微环境中诱导的变化之外,与健康浆细胞相比,这些恶性浆细胞本身经历代谢变化。 MM细胞中已知的代谢重排是葡萄糖途径,谷氨酰胺途径,丝氨酸代谢,戊糖磷酸途径(PPP)和叶酸途径的调整。此外,细胞代谢和BM环境的总体变化诱导MM的耐药性。
2.一般癌症代谢
每个健康细胞都有义务从环境中输入营养物质以满足生物合成需求。这允许增殖,分化和迁移。葡萄糖和谷氨酰胺是哺乳动物细胞存活必不可少的[25]。实际上,葡萄糖可以通过不同的葡萄糖转运蛋白进入细胞:GLUT1(红细胞,血管内皮),GLUT2(肝细胞,胰腺β细胞,肠粘膜和肾细胞),GLUT3(神经元)和GLUT4(骨骼肌和心肌),其中每种膜蛋白的表达取决于细胞类型[26]。葡萄糖进入细胞后,糖酵解的过程开始;它经历了细胞质中的几次转化,最终产生2摩尔丙酮酸和2摩尔三磷酸腺苷(ATP)。首先,在加入磷酸基团后葡萄糖转化为葡萄糖-6-磷酸,这防止了葡萄糖的流出。形成果糖-6-磷酸,然后是果糖-2,6-二磷酸,d-甘油醛3-磷酸,1,3-二磷酸甘油酸,3-磷酸甘油酸,2-磷酸甘油酸和磷酸烯醇丙酮酸(PEP)。在最后一步中,丙酮酸在PEP转化后形成,PEP由丙酮酸激酶(PK)催化[27]。
接下来,丙酮酸进入线粒体的基质并通过丙酮酸脱氢酶(PDH)的酶活性被氧化成乙酰-CoA,丙酮酸脱氢酶是三羧酸循环(TCA)的开始,也称为Krebs循环,在有氧条件下条件。乙酰辅酶A与草酰乙酸的融合形成柠檬酸盐作为TCA循环中的下一代谢物[28]。接下来,产生异柠檬酸,然后产生α-酮戊二酸(αKG),琥珀酸盐,富马酸盐,苹果酸盐和草酰乙酸盐(图1)。通过到达草酰乙酸完成循环,然后重新开始[29]。每个重排步骤以电子的形式释放能量,所述能量被所谓的电子穿梭器接受,例如烟酰胺腺嘌呤二核苷酸(NAD +)和黄素腺嘌呤二核苷酸(FAD)。这些分子负责高能电子的传输。当能量释放时​​,电子穿梭机捕获能量并被还原成烟酰胺腺嘌呤二核苷酸氢(NADH)和FADH2。最后,电子穿梭机被运送到位于线粒体内膜的电子传递链,产生ATP [30]。氧化磷酸化(OXPHOS)是一种非常有效的机制,在有氧条件下从1摩尔葡萄糖中产生36摩尔ATP。然而,在厌氧条件下,由于细胞质中丙酮酸的减少而产生乳酸,然后通过单羧酸转运蛋白(MCT)从细胞中排出[28]。通过乳酸脱氢酶(LDH)实现丙酮酸盐还原成乳酸盐。
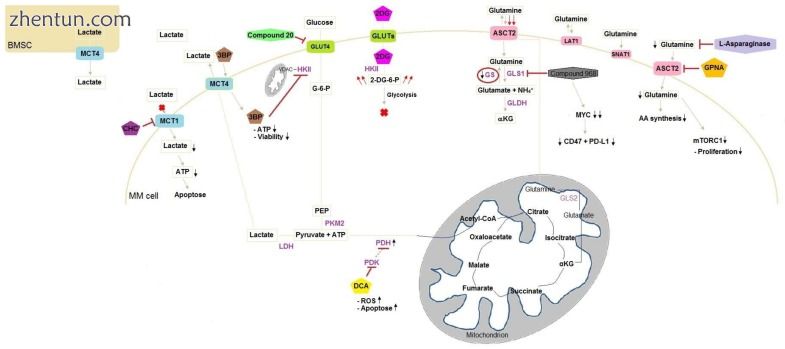
图1
MM细胞中葡萄糖和谷氨酰胺代谢中靶标的示意图。施用诱导刺激或抑制的化合物后MM细胞中的代谢重排。 3BP通过MCT4进入细胞并通过VDAC抑制连接到线粒体外膜的HKII,导致ATP减少和活细胞损失。 2DG通过GLUT进入细胞并被HKII磷酸化。磷酸化形式不能被代谢并因此导致糖酵解阻塞而累积。化合物20抑制GLUT4,导致化学增敏。在向MM细胞中添加DCA后抑制PDK对PDH的抑制,其抑制PDK。结果,PDH活性增加并且乳酸产生减少,从而增加TCA活性。 CHC是一种MCT1竞争性抑制剂,可阻止乳酸进入细胞。由于ATP减少,这种燃料的缺乏导致细胞凋亡。然而,BMSC向MM细胞提供乳酸。谷氨酰胺通过三种转运蛋白进入细胞:ASCT2,LAT1和SNAT1,ASCT2是主要的谷氨酰胺转运蛋白。化合物968抑制GLS诱导MYC降解和CD47和PD-L1降低。 MM细胞缺乏GS,导致细胞内谷氨酰胺浓度低并导致谷氨酰胺流入量增加。 GPNA是谷氨酰胺转运蛋白抑制剂并且在细胞内诱导缺乏谷氨酰胺,这不利于AA合成并降低mTORC1活性,导致较少的细胞增殖。 L-天冬酰胺酶不是抑制谷氨酰胺转运蛋白,而是水解谷氨酰胺。 AA,氨基酸; BMSC,骨髓基质细胞; 3BP,3-溴丙酮酸; CHC,α-氰基-4-羟基肉桂酸; DCA,二氯乙酸酯; 2DG,2-脱氧葡萄糖; 2-DG-6-P,2-脱氧葡萄糖-6-磷酸; G-6-P,葡萄糖-6-磷酸; GLDH,谷氨酸脱氢酶; GLS1,谷氨酰胺酶1; GLS2,谷氨酰胺酶2; GPNA,1-γ-谷氨酰基对硝基苯胺; GS,谷氨酰胺合成酶; HKII,己糖激酶II; LDH,乳酸脱氢酶; MM,多发性骨髓瘤; MYC,骨髓细胞瘤病癌基因细胞同源物; PDH,丙酮酸脱氢酶; PDK,丙酮酸脱氢酶激酶; PEP,磷酸烯醇丙酮酸; PKM2,丙酮酸激酶M2;活性氧,活性氧; VDAC,电压依赖性阴离子通道;

减少;
,强势减少;

, 增加;

,强势增长。
除葡萄糖外,谷氨酰胺是迄今为止最丰富的氨基酸之一,对维持和促进正常细胞功能至关重要。谷氨酰胺增强增殖,分化,细胞因子产生和细胞凋亡。此外,它是核苷酸和核酸合成的前体[31]。首先,谷氨酰胺可以通过几种转运蛋白如中性氨基酸转运蛋白(ASCT2)转运到细胞中(图1)。进入细胞后,谷氨酰胺可用于生物合成[32,33]。谷氨酰化过程发生在细胞的两个不同部分,类似于葡萄糖代谢:胞质溶胶和线粒体。首先,谷氨酰胺可以通过胞质溶胶中的谷氨酰胺酶1(GLS1)转化为谷氨酸。在线粒体中,它通过谷氨酰胺酶2(GLS2)转化,在那里它可以通过谷氨酸脱氢酶(GLDH)或氨基转移酶进一步氧化成αKG,然后如上所述通过产生线粒体NADH,NADPH和氨参与TCA循环[29, 34,35,36]。除了参与TCA循环外,谷氨酰胺还用于核酸的生物合成[36]。嘌呤核苷酸的形成始于5-磷酸-α-核糖基-1-焦磷酸(PRPP)通过谷氨酰胺PRPP转氨酶转化,其中谷氨酰胺向PRPP提供氨基并进一步归因于氮并以肌苷一磷酸结束,这是完全的在一系列反应后形成嘌呤核苷酸。在该核酸合成中,还使用甘氨酸,天冬氨酸,ATP和四氢叶酸[37,38]。
葡萄糖,谷氨酰胺和各种其他营养素进入细胞是这种复杂的代谢机制的开始,这对细胞呼吸起着至关重要的作用,从而激发这些营养素转化为生化能量。当比较糖酵解与谷氨酸分解时,两种过程都导致能量产生和核苷酸合成。不同之处在于糖酵解提供更多的乳酸并减少线粒体萎缩。谷氨酰胺解导致氨基酸合成和脂肪酸合成。这些机制共同促进癌细胞的生长和存活[39]。然而,癌细胞的特征在于代谢改变,并且这种癌症因癌症类型而异。由于疾病的高度异质性,代谢特征根据癌症类型而变化很大[28,40]。然而,大多数恶性细胞具有增强的有氧糖酵解,也称为“Warburg效应”,是共同的。这种效应被描述为在氧气存在下葡萄糖转化为乳酸[41]。由于肿瘤细胞通常存在于缺氧环境中,因此组成型和高糖酵解通量可能是恶性细胞对环境压力的适应[30]。由于解释癌细胞的高糖酵解通量,线粒体OXPHOS被认为被Warburg削弱或削弱。然而,最近的研究发现,线粒体OXPHOS机制仍然没有受到伤害,并且由于糖酵解增强而OXPHOS被抑制,而不是机制中的缺陷[28,42]。这种效应是可逆的:根据Fantin等人的观察,当糖酵解被抑制时,线粒体OXPHOS可以恢复其功能。 [28,43]。此外,增加的葡萄糖消耗可以通过成像技术正电子发射断层扫描(PET)用作成功的诊断工具,其中葡萄糖类似物,放射性氟标记(18F-氟脱氧葡萄糖(18F-FDG))用作示踪剂[25]。 ,41]。
在葡萄糖之后,谷氨酰胺最常用于癌细胞中的能量。通过αKG的产生,提供补缺通量的过程之一是谷氨酸分解[29]。氨基酸负责用于细胞增殖的各种重要组分形成[44]。如本综述前面所述,谷氨酰胺通过许多不同的转运蛋白进入细胞,并且可以直接用于这种氨基酸的分子结构中存在的氨基氮用于己糖胺和癌细胞中的核苷酸合成[44,45]。在进一步的步骤中,谷氨酰胺可以转化为谷氨酸,然后转化为进入TCA循环的αKG以产生能量。此外,He等人已经显示出谷氨酰胺的从头合成。在C6胶质瘤细胞中,谷氨酰胺合成酶(GS)位于细胞质中,通过氨和谷氨酸催化谷氨酰胺合成[44,46]。 He等人还报道,当C6细胞被剥夺谷氨酰胺时,GS表达上调并导致谷氨酰胺的从头合成[46]。此外,这一观察结果可用于PET示踪剂研究:13N-氨被肿瘤细胞摄取,从而进行谷氨酰胺合成,这提供了肿瘤细胞中谷氨酰胺酶率的信息[46]。另一个标志是谷氨酰胺进口必需氨基酸的能力。确实,尼克林等人。表明通过人类l型氨基酸转运蛋白1(LAT1)进入l-亮氨酸(必需氨基酸)会同时引起谷氨酰胺外流[47]。谷氨酰胺可以通过相同的机制导入其他必需氨基酸[28]。
此外,重要的是要提到癌细胞中广泛的葡萄糖和谷氨酰胺摄取是细胞外刺激如生长因子信号传导的结果[48]。尽管培养基中存在葡萄糖,但在细胞大小和ATP产生方面,显示剥夺生长因子的细胞受到负面影响。细胞不能维持正常的细胞生物能量,这可能导致程序性细胞死亡的激活[49]。总的来说,很明显环境因素会改变几种癌症中的肿瘤代谢。
除了葡萄糖和谷氨酰胺代谢在癌症中的重要性外,叶酸代谢也与癌症有关。据报道,低叶酸水平促进癌发生并且与细胞遗传学异常有关。此外,低叶酸水平显示在肿瘤过程中发挥作用[50]。除叶酸外,脯氨酸在癌症中也很重要。脯氨酸是一种在微环境中具有高丰度的氨基酸。脯氨酸脱氢酶/氧化酶(PRODH / POX)催化脯氨酸转化为吡咯啉-5-羧酸酯(P5C)。在此转换过程中,PRODH / POX向电子传递链提供电子并导致产生活性氧(ROS)。这引发细胞凋亡和抑制肿瘤生长和细胞增殖,其可用作癌症中的靶标。然而,通过谷氨酰胺通过骨髓细胞增多症癌基因细胞同源物(MYC)增强的脯氨酸生物合成有助于肿瘤发生。实际上,MYC通过miR-23a / b刺激谷氨酰胺酶,这与脯氨酸合成有关[51]。
3.多发性骨髓瘤(MM)的葡萄糖代谢
在癌症研究中,葡萄糖代谢是癌症代谢中研究最多的分支。然而,在MM中尚未完全阐明糖酵解。糖酵解途径中的第一个有趣的酶是己糖激酶II(HKII),其是四种HKs同种型的一部分。它是包括MM在内的几种癌症中广泛过表达的酶[52]。己糖激酶家族不可逆地催化糖酵解的第一步,其中葡萄糖在通过葡萄糖转运蛋白进入细胞后转化为葡萄糖-6-磷酸[36]。研究表明,HKII与线粒体外膜上存在的电压依赖性阴离子通道(VDAC)结合[36,52](图1)。磷酸肌醇-3激酶(PI3K)/ Akt信号传导促进了这种相互作用,导致稳定的高HKII水平导致恶性细胞的持续增殖[52,53,54]。组成型过表达的HKII可被具有烷基化特性的小分子3-溴丙酮酸(3BP)抑制。该化合物首先被鉴定为糖酵解和氧化磷酸化的抑制剂[36,55](图1)。高反应性分子,即丙酮酸的结构类似物,通过MCT进入细胞,并在靶向蛋白质烷基化后释放出溴自由基[55]。因此,乳酸不是通过MCT的唯一成分。进入3BP的原因是:(1)MCT的丰富表达; (2)可能是3BP和乳酸的相似分子结构; (3)高乳酸外排产生酸性细胞外环境,有利于恶性细胞中3BP的摄取[55,56]。
Niedźwiecka等人。在MM细胞中存在3BP诱导的形态学变化和流式细胞术分析表明,2和4小时后凋亡的MM细胞增加,均呈剂量依赖性[57]。此外,在添加3BP后,MM细胞中的ATP产生和存活率降低。此外,MM细胞系似乎比白血病细胞系更容易受到3BP的影响[42]。
有趣的是,2-脱氧葡萄糖(2DG)显示出与3BP相似的对MM细胞中ATP产生和细胞存活的影响。该第二种抗癌剂是葡萄糖类似物,并且在进入细胞后被HKII磷酸化成2-DG-6-磷酸。磷酸化形式不能被代谢,随后在细胞中积累并干扰糖酵解途径[58,59]。然而,由于其作为单一药物的有限治疗效果,2DG需要与其他治疗剂组合[59]。因此,就2D细胞中的细胞死亡和ATP消耗而言,3BP显示出比2DG更有说服力的抗癌剂[52] [图1]。
在几种酶和转化之后,糖酵解的最后步骤包括将磷酸烯醇丙酮酸(PEP)转化为丙酮酸和ATP,其在细胞的胞质溶胶中被PK催化。与HKII类似,PK存在四种同种型,其中PKM2似乎被上调,使其成为癌细胞中丰富的同种型[36,60]。 PKM2在肿瘤进展中起支持作用并抑制细胞凋亡[61]。此外,c-MYC致癌基因通过从未有丝分裂(NIMA)相关激酶2(NEK2)诱导高PKM2表达,这是一种调节细胞周期G2 / M期染色体分离的激酶[60]。此外,PKM2的高酶活性与乙酰辅酶A的增加有关,而相反产生更多的乳酸,导致华宝效应[62]。最近发现,MMM细胞中PKM2表达增加。此外,沉默PKM2导致MM细胞生长减少和G1 / S转换时细胞周期停滞[61]。
除了丙酮酸的形成之外,乳酸盐在癌细胞中高度产生并通过MCT运输出细胞。然而,一些论文表明乳酸可以掺入细胞并用作氧化磷酸化的燃料[63,64,65]。流入和流出取决于细胞内和细胞外乳酸的浓度以及与MCT结合的其他底物的存在[65]。骨髓瘤细胞表达MCT1以在细胞质中掺入乳酸并产生ATP。实际上,转运蛋白的敲低导致乳酸盐流入和乳酸衍生的ATP产生减少,从而诱导细胞凋亡[66]。除了敲除MCT1外,MCT1的竞争性抑制剂(α-氰基-4-羟基肉桂酸(CHC))也能够以剂量依赖的方式降低MM细胞将乳酸盐掺入细胞的能力[63]。通过添加丙酮酸脱氢酶激酶抑制剂(二氯乙酸酯(DCA))可以加速这种现象,通过将葡萄糖代谢从丙酮酸转化为乙酰辅酶A而不是丙酮酸转化为乳酸来达到目标​​[63,67,68,69, 70](图1)。已知乳酸盐被掺入MM细胞中表明后者存在于微环境中。实际上,骨髓瘤细胞供应源自周围环境的乳酸,其被描述为“反向Warburg效应”[63,66]。更准确地说,与MCT1相比,BM衍生的基质细胞通过MCT4分泌乳酸[66,71,72]。虽然MCT1抑制由于缺乏燃料而导致细胞凋亡,但MCT4抑制导致乳酸积累,终止于酸中毒[73]。
4. MM中的谷氨酰胺代谢
众所周知,谷氨酰胺是一种非必需氨基酸,在人体组织的不同机制中起着至关重要的作用。如前所述,谷氨酰胺进入细胞并被代谢,导致不同的结果。它通过GLS1和GLS2的活性转化为谷氨酸和氨(NH4 +)。在体外,人类骨髓瘤细胞系(HMCLs)显示谷氨酰胺产生过量的NH4 +,这导致假设MM细胞是谷氨酰胺成瘾[74]。实际上,已经检查了MM患者的BM吸出物在纯化的CD138 +细胞中的NH4 +水平。正如预测的那样,CD138 +细胞中谷氨酰胺存在的NH4 +水平显着高于CD138-部分[75]。还显示这些恶性浆细胞缺乏GS并因此依赖于细胞外谷氨酰胺摄取,当谷氨酰胺耗尽时导致细胞毒性作用。通过添加蛋白质亚砜亚胺(MSO)(一种GS抑制剂)进一步证明了这种缺乏GS,因为在谷氨酰胺消耗后细胞毒性作用仍然存在[74]。 MM细胞高度依赖谷氨酰胺可能导致有趣的治疗目标。
接下来,l-天冬酰胺酶,一种用于治疗急性淋巴细胞白血病(ALL)的分子,除了天冬酰胺的降解外,还具有水解谷氨酰胺的能力,并导致细胞内氨基酸的消耗和mTOR活性的抑制[74, 75,76]。此外,当1-天冬酰胺酶与蛋白酶体抑制剂硼替佐米组合时,会产生协同效应,导致MM细胞中细胞毒性增加[74,77,78]。第二种蛋白酶体抑制剂卡非佐米也显示出与1-天冬酰胺酶的协同作用,导致抗MM活性增强。 IL-6和胰岛素样生长因子-1(IGF-1)与1-天冬酰胺酶和卡非佐米联合使用,并未降低抗MM活性[76]。预计恶性浆细胞所在的BM的缺氧环境应加强对谷氨酰胺的依赖[77,78]。通过用1-γ-谷氨酰基 - 对硝基苯胺(GPNA)和苄基丝氨酸抑制谷氨酰胺转运蛋白ASCT2会降低谷氨酰胺流入并导致较低的增殖率[79](图1)。除ASCT2外,LAT1和钠偶联中性氨基酸转运蛋白1(SNAT1)也是MM细胞中表达的主要谷氨酰胺转运蛋白。然而,SNAT1和LAT1似乎对谷氨酰胺摄取的作用很小[78]。尽管目前缺乏最佳ASCT2抑制剂,但由于下游效应,包括mTORC1激酶活性的抑制,细胞增殖的改变,自噬和蛋白质合成,该靶标仍然令人感兴趣[77,80]。
MYC致癌基因存在于许多人类癌症中,通过逃避抗肿瘤机制如细胞凋亡,增殖抑制和细胞衰老,促进肿瘤生长,增殖,DNA复制,转录,蛋白质生物合成和代谢改变[81]。 MYC蛋白的转录活性在MM中上调,更确切地说是在MM进展的晚期阶段,并且与较差的存活相关[82]。此外,MYC参与谷氨酰胺酶,增强谷氨酰胺转运蛋白的表达和抑制谷氨酰胺酶抑制剂[82,83]。此外,谷氨酰胺消耗导致通过c-MYC积累的代谢物2-羟基戊二酸[84]。已经证明,谷氨酰胺酶抑制导致HMCL中的细胞凋亡以及MYC的降解。实际上,用抑制GLS的化合物968抑制谷氨酸分解导致MYC降解。此外,从培养基中去除谷氨酰胺会导致HMCL中MYC蛋白的降解和细胞凋亡[82]。从这些发现中得出的一个有趣的潜在理论是MM细胞可能对MYC调节的免疫应答具有敏感性。 MYC蛋白的降解会通过减少CD47和PD-L1来增强抗肿瘤免疫应答[82,85]。
最近的证据表明谷氨酰胺可以影响增殖,不依赖于谷氨酰胺代谢。通过添加谷氨酰胺代谢产生的中间底物如谷氨酸,2-氧代戊二酸和谷胱甘肽,从谷氨酰胺中剥夺癌细胞显示出抗增殖作用而没有任何拯救[33,86]。此外,Cacace等人证明,虽然谷氨酰胺剥夺通过下调HIF-1α导致糖酵解减少,但二甲基-2-氧戊二酸(DM-2-氧戊二酸)对HIF-1α的激活不能恢复细胞增殖。癌细胞缺乏谷氨酰胺,表明抗增殖作用是作为对细胞外谷氨酰胺不存在的反应而发生的[86]。由此得出结论,谷氨酰胺诱导的癌细胞增殖不仅仅依赖于谷氨酰胺代谢,还可以激活其他信号通路[86]。
在这方面,Cacace等报道谷氨酰胺激活(磷酸化)转录因子STAT3并控制细胞增殖[86]。似乎细胞外谷氨酰胺可以激活某些可以调节STAT3的细胞表面受体。作为候选人,作者提出了一种类似于Grp的受体,一种在细菌中鉴定出的谷氨酰胺受体。这一假设得到了其他代谢物也能作用于膜受体的事实的支持[86,87]。例如,乳酸可以激活GPR81,GPR81是主要在脂肪细胞中表达的Gi偶联受体,并且已经显示在不同的癌症中高度表达。当乳酸是唯一的能量来源时,GPR81沉默导致肿瘤生长减少,细胞增殖减少和线粒体活性降低[87]。这证实了代谢物对膜受体的作用的假设。这些发现显示在乳腺癌和宫颈癌中;然而,这些调查需要在MM中进行改进和完成[86,88]。
5. MM的耐药性
5.1.标准护理药物
在MM中,由于耐药性,改变的肿瘤细胞代谢降低了标准护理药物如硼替佐米和美法仑的治疗效果。代谢改变的主要原因是缺氧肿瘤环境[89]。实际上,HIF-1在缺氧环境中被激活并通过加强丙酮酸转化为乳酸而不是线粒体中丙酮酸的氧化来改变葡萄糖代谢。由于HIF-1活化,线粒体能量产生减少[90]。已经表明残留细胞由于BM中的缺氧而对治疗具有抗性,这导致复发。当通过分析原发性MM患者和健康供者之间的基因表达数据集比较HIF-1α和HIF-2α途径的水平时,在新诊断的MM患者中观察到HIF-1α和HIF-2α的明显富集[90,91, 92。在复发的MM患者和硼替佐米难治性骨髓瘤患者中也观察到这些途径的富集,并且与硼替佐米应答患者相比更加丰富[90]。此外,与新诊断的骨髓瘤患者相比,发现HKII和乳酸脱氢酶A(LDHA)在复发的MM患者中高度上调,表明葡萄糖代谢增加[90,93]。 HMCL暴露于低氧条件下并且用硼替佐米,地塞米松和美法仑治疗显示,治疗后过度表达的HIF-1α和LDHA的葡萄糖代谢活性升高[90]。通过HIF增强葡萄糖代谢与抗药性相关的知识产生了抑制MM细胞中葡萄糖摄取的有趣机会。实际上,根皮素(GLUT1抑制剂)和柔红霉素(一种化学治疗剂)的组合增强了后者在缺氧中的作用[90,94,95]。魏等人。表明化合物20(GLUT4抑制剂)导致MM细胞系和患者材料的地塞米松和美法仑的化学增敏[96]。除了GLUT1作为靶标,用利托那韦(GLUT4抑制剂)靶向MM细胞增加细胞毒性敏感性,并且与BH3模拟venetoclax一起,发生协同作用[97,98]。
除了针对葡萄糖摄取,HK似乎也是一个有趣的目标。 HKP抑制剂如3BP,2DG和lonidamine(LND)可增强体外常氧的药物反应;然而,体内没有观察到反应[90,99,100]。在缺氧条件下,硼替佐米降低了HKII的活性,而LDHA的活性没有降低,表明LDHA在硼替佐米耐药中的作用。此外,硼替佐米抗性细胞在LDHA敲低后失去其抗性,导致乳酸形成减少,并因此增加线粒体活性,在低氧条件下减少增殖,从而降低致瘤性[43,40,101]。
硼替佐米耐药不仅通过LDHA和HIF发生。实际上,最近已显示丝氨酸代谢在MM中对硼替佐米耐药性中具有其自身作用。丝氨酸生物合成通过细胞外输入或通过葡萄糖的细胞内合成开始。后者是许多癌症中最常用的丝氨酸生物合成途径。首先,葡萄糖如前所述进入细胞并通过糖酵解代谢。经过几次转换后,丝氨酸合成从3-磷酸甘油酸(3-PG)开始,由于磷酸甘油酸脱氢酶(PHGDH)的酶活性,后者被转化为3-磷酸羟基丙酮酸(PHP),这是丝氨酸合成途径中的限速步骤( SSP)。磷酸丝氨酸氨基转移酶(PSAT)将PHP转化为3-磷酸丝氨酸(P-Ser),最终转化为丝氨酸,由磷酸丝氨酸磷酸酶(PSPH)催化[102]。由于SSP参与生长和增殖,SSP被证明对癌细胞有益[36,103]。 PHGDH在硼替佐米抗性HMCL中显示(在RPMI-8226中显示)以及在不同HMCL中的PSAT和PSPH上调。与HIF相似,与药物反应性MM患者相比,在从硼替佐米难治性骨髓瘤患者吸出的CD138 +细胞中观察到PHGDH和PSPH的过表达。据报道剥夺丝氨酸细胞对RPMI-8226细胞中的硼替佐米活性有益[104]。实际上,饮食中没有丝氨酸导致小鼠肿瘤生长减少[104,105]。这些发现可能导致一种治疗MM疾病的有吸引力的方法,并且可以用作将过表达的PHGDH与肿瘤发生联系起来的诊断工具。
在SSP旁边,PPP已经在癌症中得到了积极的研究。 PPP由两个阶段组成:氧化阶段和非氧化阶段。第一阶段从糖酵解代谢中存在的葡萄糖-6-磷酸开始,并在几次转化后产生核酮糖-5-磷酸。一旦形成核酮糖-5-磷酸,就产生核苷酸并开始嘧啶和嘌呤合成。通过将核酮糖-5-磷酸转化为木酮糖-5-磷酸,然后转化为果糖-6-磷酸,可以将非氧化相转变为糖酵解代谢,其可以通过糖酵解进一步产生ATP [106,107]。研究表明MM细胞中PPP的上调以及SSP的过度表达导致硼替佐米抗性MM细胞的抗氧化活性更高[104]。陈等人。表明当施用表皮生长因子受体(EGFR)抑制剂(如吉非替尼和阿法替尼)导致MM细胞的反应有限时,PPP上调[108]。由于EGFR在一些癌症类型中被发现增加,因此当添加到标准护理药物中时,靶向后者可能是一种新的有吸引力的疗法[109]。然而,PPP的上调可以通过以下事实来解释:EGFR抑制引发代谢重排作为补偿机制以适应和存活EGFR信号传导的丧失。通过添加6-氨基烟酰胺(6-AN)可以减少这种抵抗力,6-氨基烟酰胺是一种抗代谢物,可抑制PPP中NADPH的供应,并与吉非替尼联合[108,110]。
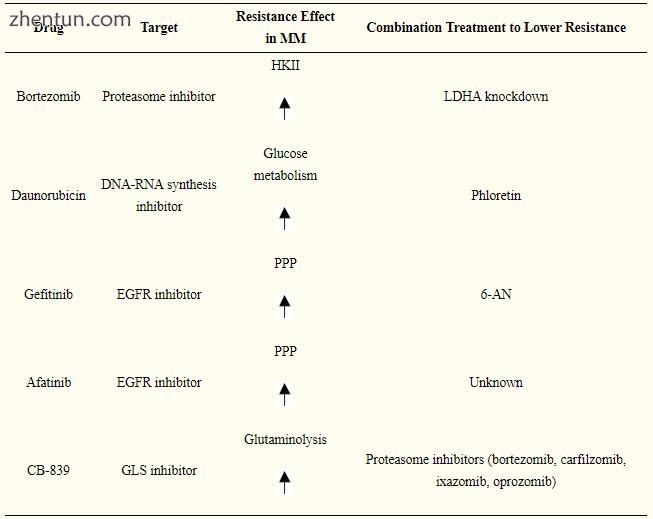
在谷氨酰胺代谢中也可以发现抗药性的原因。 如前所述,MM细胞中缺乏GS的表达,而GLS表达增加。 用选择性抑制剂CB-839靶向GLS并与蛋白酶体抑制剂(硼替佐米,卡非佐米,伊沙唑嗪和奥罗唑米)联合增强蛋白酶体抑制剂在体外和体内的细胞毒性作用,卡非佐米显示出最强的协同作用[111](表1)。
表格1
目标是降低MM细胞的耐药性。 6-AN,6-氨基烟酰胺; EGFR,表皮生长因子; GLS,谷氨酰胺酶;HKII; 己糖激酶II; LDHA,乳酸脱氢酶A; PPP,戊糖磷酸途径。
蛋白酶体抑制剂(硼替佐米,卡非佐米,伊沙唑嗪,oprozomib)
如前所述,BM微环境和MM细胞彼此相互作用,并且已知这种相互作用是MM中耐药性出现的基础。实际上,由Damiano和Dalton等人引入的细胞粘附介导的耐药性(CAM-DR)是粘附于细胞外基质(ECM)后耐药性的表现[112,113,114]。当在MM细胞系中促进PKM2表达时这种机制减弱,另一方面在PKM2敲低后支持它[61]。 PKM2通过调节PI3 / Akt和丝裂原活化蛋白激酶/细胞外信号调节激酶(MAPK / ERK1 / 2)信号通路来影响CAM-DR,这两种通路都参与肿瘤进展[115,116,117]。有趣的是,细胞外基质糖蛋白Reelin通过增强糖酵解和通过HIF-1α导致耐药性[118]。
5.2.免疫治疗
目前在MM中应用的另一种治疗形式是免疫疗法。这包括使用IMiDs来那度胺和pomalidomide,免疫检查点抑制剂,基于树突状细胞(DC)的疫苗和MM患者的同种异体移植[119]。 IMiD可以增强NK和(NK)T细胞的增殖和功能。如前所述,单克隆抗体daratumumab还可增强T细胞对骨髓瘤的免疫力[120]。免疫检查点抑制剂如nivolumab(一种靶向PD-1-PD-L1途径的抗PD-1抗体)增强抗肿瘤T细胞应答。此外,由DC融合肿瘤抗原组成的DC疫苗是加强MM免疫治疗的潜在机制[119]。嵌合抗原受体(CAR)T细胞疗法基于遗传修饰的自体T细胞,其表达CAR并特异性靶向肿瘤抗原。已经开发出用于MM中CAR T细胞疗法的靶标,并且对于难治性MM患者可能是有趣的[119,121]。
肿瘤微环境(TME)的代谢变化也可以降低免疫疗法的有益作用[122]。高葡萄糖和谷氨酰胺摄取率,广泛的乳酸产生和分泌使TME转变为肿瘤细胞的有利位置。然而,由于营养缺乏,酸中毒,废物积累和缺氧环境,这种形状的TME对T细胞是不利的[122,123]。 TME的酸化损害T细胞增殖并降低NK细胞的功能。缓冲pH可改善碳酸氢盐的免疫疗法结果,并可用于MM。此外,在MM中使用诸如2DG的抗癌剂并关闭糖酵解;然而,由于T细胞代谢受损,2DG不能与免疫治疗剂结合,导致T细胞抗肿瘤效果降低。类似地,DCA降低MM中TME中乳酸的量,这可能是酸化问题的解决方案。不幸的是,DCA损害了T细胞的功能[122]。与MM细胞相比,免疫细胞利用氨基酸起作用,例如1-精氨酸,它是巨噬细胞和DC中存在的非必需氨基酸。当肿瘤细胞分泌代谢物如乳酸时,精氨酸酶过表达,而精氨酸转化为尿素和鸟氨酸,通过干扰细胞周期进程导致T细胞功能障碍。由于已知MM细胞分泌乳酸,MM细胞可能通过这种机制损害T细胞功能[124]。
6.结论和未来展望
代谢变化是大多数癌症的一般标志。由于必须考虑大量因素,调查该领域是一项非常复杂的任务。然而,在过去十年中发表了越来越多关于癌症代谢的论文。 MM中的癌症代谢逐渐被阐明,并且该过程产生了新的治疗方法。骨髓瘤细胞中研究最多的两种成分是葡萄糖和谷氨酰胺,与许多其他癌症一样。如本综述所述,葡萄糖代谢中存在各种靶标。 HKII是第一种催化葡萄糖代谢开始的酶。与糖酵解的其他代谢物一起,可以将这些代谢物作为有希望的结果。类似地,涉及谷氨酰胺代谢的代谢物和酶可以靶向骨髓瘤细胞。尽管有临床前证据,但尚未对MM患者进行代谢改变剂如3BP,DCA,GLUT4抑制剂(化合物20)和GLS1抑制剂(化合物968)的临床试验。然而,L-天冬酰胺酶联合Doxil®(PEG-脂质体多柔比星)和地塞米松的临床试验正处于II期临床试验阶段。此外,2DG的临床试验已经完成,并且已经证明它具有安全的毒性特征;然而,它作为单一药物不是很有效,因此可以考虑与蛋白酶体抑制剂的联合治疗(根据ClinicalTrials.gov)。
有关MM的抗药性的有希望的数据已经公布。对蛋白酶体抑制剂硼替佐米的抗性与骨髓瘤细胞中不同代谢途径的上调有关,这些途径可成功靶向。此外,对新兴免疫治疗剂的耐药性与代谢有关。然而,解决这种抗性仍然是一个问题,因为2DG和DCA等药物也具有免疫抑制作用。由于高特异性和功效,对代谢药物和免疫治疗剂的潜在其他组合的更多研究将是有趣的。此外,免疫疗法可以适应每个患者,允许个性化治疗,这将进一步提高存活率。理想地,靶向MM代谢而不影响包围的免疫细胞的药剂,与对MM细胞上存在的特异性抗原作出反应的免疫疗法相结合,将是骨髓瘤治疗的巨大改进。尽管目前的发展,MM患者仍然进展到一定的治疗抵抗阶段。耐药性可由药物外排,细胞凋亡抑制,药物失活,药物引起的DNA损伤修复和表观遗传效应引起[125]。另一个问题是癌症祖细胞的存在。这些细胞通常具有耐药性,并且在治疗后仍然存在于患者体内。不幸的是,癌症祖细胞不仅似乎是癌症复发的原因;它们也可以迁移并引起转移[125,126,127]。因此,研究耐药性的需要仍然是MM和其他癌症的主要需求。
此外,还有更多需要在MM中进行调查的代谢途径,例如叶酸途径和脯氨酸代谢,这在其生物合成和分解代谢途径中显示出有希望且非常有趣的目标。 此外,与葡萄糖和谷氨酰胺代谢相关的缺氧是一种有趣的探索途径,与MM中的脯氨酸代谢一起,以减少药物抗性和改善存活。 仍然需要全面了解MM癌症代谢以改善现有靶标和药物。
缩略语
αKGAlpha酮戊二酸
ALL急性淋巴细胞白血病
6-AN 6-氨基烟酰胺
ASCT2中性氨基酸转运蛋白2
ATP三磷酸腺苷
BM骨髓
BMSC骨髓基质细胞
3BP 3-溴丙酮酸盐
CAM-DR细胞粘附介导的耐药性
CAR嵌合抗原受体
CHCα-氰基-4-羟基肉桂酸
DC树突状细胞
DCA二氯乙酸盐
2DG 2-脱氧葡萄糖
DM二甲基
ECM细胞外基质
EGFR表皮生长因子
ERK1 / 2细胞外信号调节激酶
FAD黄素腺嘌呤二核苷酸
18F-FDG氟标记的氟脱氧葡萄糖
FGF-2成纤维细胞生长因子-2
FL fas配体
GLDH谷氨酸脱氢酶
GLS1谷氨酰胺酶1
GLS2谷氨酰胺酶2
GPNA 1-γ-谷氨酰基对硝基苯胺
GS谷氨酰胺合成酶
HKII己糖激酶II
HMCL人骨髓瘤细胞系
IAP抑制细胞凋亡蛋白
IGF-1胰岛素样生长因子-1
IL-1β白细胞介素-1β
IL-6白细胞介素-6
IMiDs免疫调节
JAK Janus激酶
LAT1人L型氨基酸转运蛋白1
LDH乳酸脱氢酶
LDHA乳酸脱氢酶A.
MAPK丝裂原活化蛋白激酶
MCT单羧酸转运蛋白
MGUS未确定意义的单克隆丙种球蛋白病
MM多发性骨髓瘤
MSO蛋氨酸亚砜亚胺
MYC髓细胞瘤病癌基因细胞同源物
NAD烟酰胺腺嘌呤二核苷酸
NADH烟酰胺腺嘌呤二核苷酸氢
NH4 +氨
NK自然杀伤细胞
OAF破骨细胞活化因子
OC 破骨细胞
OXPHOS氧化磷酸化
PDH丙酮酸脱氢酶
PEP磷酸烯醇丙酮酸
PET正电子发射断层扫描
PI3K磷酸肌醇-3激酶
PK丙酮酸激酶
PPP戊糖磷酸盐途径
PRPP 5-磷酸-α-核糖基-1-焦磷酸酯
核因子κB配体的RANKL受体激活剂
SNAT1钠偶联中性氨基酸转运蛋白1
STAT3信号转导和转录激活因子3
TCA三羧酸循环
TME肿瘤微环境
肿瘤坏死因子肿瘤坏死因子
TNF-β肿瘤坏死因子-β
TRAIL TNF相关凋亡诱导配体
VCAM-1血管细胞粘附分子1
VDAC电压依赖性阴离子通道
VEGF血管内皮生长因子
参考:
Metabolic Features of Multiple Myeloma
1. Kristinsson S.Y., Björkholm M., Goldin L.R., Blimark C., Mellqvist U.H., Wahlin A., Turesson I., Landgren O. Patterns of hematologic malignancies and solid tumors among 37,838 first-degree relatives of 13,896 multiple myeloma patients in Sweden. Int. J. Cancer. 2009;125:2147–2150. doi: 10.1002/ijc.24514. [PMC free article] [PubMed] [CrossRef]
2. Kawano Y., Moschetta M., Manier S., Glavey S., Görgün GT., Roccaro A.M., Anderson K.C., Ghobrial I.M. Targeting the bone marrow microenvironment in multiple myeloma. Immunol. Rev. 2015;263:160–172. doi: 10.1111/imr.12233. [PubMed] [CrossRef]
3. Kühnel A., Blau O., Nogai K.A., Blau I.W. The Warburg effect in Multiple Myeloma and its microenvironment. Med. Res. Arch. 2017;5:1–16.
4. Rajkumar S.V. Evolving diagnostic criteria for multiple myeloma. Hematol. Am. Soc. Hematol. Educ. Program. 2015;2015:272–278. doi: 10.1182/asheducation-2015.1.272. [PubMed] [CrossRef]
5. Ramsenthaler C., Kane P., Gao W., Siegert R.J., Edmonds P.M., Schey S.A., Higginson I.J. Prevalence of symptoms in patients with multiple myeloma: A systematic review and meta-analysis. Eur. J. Haematol. 2016;97:416–429. doi: 10.1111/ejh.12790. [PubMed] [CrossRef]
6. Ferlay J., Soerjomataram I., Dikshit R., Eser S., Mathers C., Rebelo M., Parkin D.M., Forman D., Bray F. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012. Int. J. Cancer. 2015;136:E359–E386. doi: 10.1002/ijc.29210. [PubMed] [CrossRef]
7. Kumar S.K., Rajkumar S.V., Dispenzieri A., Lacy M.Q., Hayman S.R., Buadi F.K., Zeldenrust S.R., Dingli D., Russell S.J., Lust J.A., et al. Improved survival in multiple myeloma and the impact of novel therapies. Blood. 2008;111:2516–2520. doi: 10.1182/blood-2007-10-116129. [PMC free article] [PubMed] [CrossRef]
8. Bianchi G., Richardson P.G., Anderson K.C. Promising therapies in multiple myeloma. Blood. 2015;126:300–310. doi: 10.1182/blood-2015-03-575365. [PMC free article] [PubMed] [CrossRef]
9. Moreau P., Attal M., Facon T. Frontline therapy of multiple myeloma. Blood. 2015;125:3076–3084. doi: 10.1182/blood-2014-09-568915. [PubMed] [CrossRef]
10. Russo A., Saide A., Smaldone S., Faraonio R., Russo G. Role of uL3 in Multidrug Resistance in p53-Mutated Lung Cancer Cells. Int. J. Mol. Sci. 2017;18:547 doi: 10.3390/ijms18030547. [PMC free article] [PubMed] [CrossRef]
11. Russo A., Russo G. Ribosomal Proteins Control or Bypass p53 during Nucleolar Stress. Int. J. Mol. Sci. 2017;18:140 doi: 10.3390/ijms18010140. [PMC free article] [PubMed] [CrossRef]
12. Folkman J., Watson K., Ingber D., Hanahan D. Induction of angiogenesis during the transition from hyperplasia to neoplasia. Nature. 1989;339:58–61. doi: 10.1038/339058a0. [PubMed] [CrossRef]
13. Carmeliet P. Angiogenesis in life, disease and medicine. Nature. 2005;438:932–936. doi: 10.1038/nature04478. [PubMed] [CrossRef]
14. Vacca A., Ribatti D. Angiogenesis and vasculogenesis in multiple myeloma: Role of inflammatory cells. Recent Results Cancer Res. 2011;183:87–95. doi: 10.1007/978-3-540-85772-3_4. [PubMed] [CrossRef]
15. Hose D., Moreaux J., Meissner T., Seckinger A., Goldschmidt H., Benner A., Mahtouk K., Hillengass J., Rème T., De Vos J., et al. Induction of angiogenesis by normal and malignant plasma cells. Blood. 2009;114:128–143. doi: 10.1182/blood-2008-10-184226. [PubMed] [CrossRef]
16. Vacca A., Ria R., Semeraro F., Merchionne F., Coluccia M., Boccarelli A., Scavelli C., Nico B., Gernone A., Battelli F., et al. Endothelial cells in the bone marrow of patients with multiple myeloma. Blood. 2003;102:3340–3348. doi: 10.1182/blood-2003-04-1338. [PubMed] [CrossRef]
17. Caligaris-Cappio F., Bergui L., Gregoretti M.G., Gaidano G., Gaboli M., Schena M., Zallone A.Z., Marchisio P.C. Role of bone marrow stromal cells in the growth of human multiple myeloma. Blood. 1991;77:2688–2693. [PubMed]
18. Shafat M.S., Gnaneswaran B., Bowles K.M., Rushworth S.A. The bone marrow microenvironment—Home of the leukemic blasts. Blood Rev. 2017;31:277–286. doi: 10.1016/j.blre.2017.03.004. [PubMed] [CrossRef]
19. Lemaire M., Deleu S., De Bruyne E., Van Valckenborgh E., Menu E., Vanderkerken K. The microenvironment and molecular biology of the multiple myeloma tumor. Adv. Cancer Res. 2011;110:19–42. doi: 10.1016/B978-0-12-386469-7.00002-5. [PubMed] [CrossRef]
20. Hideshima T., Bergsagel P.L., Kuehl W.M., Anderson K.C. Advances in biology of multiple myeloma: Clinical applications. Blood. 2004;104:607–618. doi: 10.1182/blood-2004-01-0037. [PubMed] [CrossRef]
21. Moyo T.K., Bouchnita A., Eymard N., Volpert V., Koury M.J. Effects of bone marrow infiltration by multiple myeloma on erythropoiesis. Blood. 2015;126:2143.
22. Christoulas D., Terpos E., Dimopoulos M.A. Pathogenesis and Management of Myeloma Bone Disease. Expert Rev. Hematol. 2009;2:385–398. doi: 10.1586/ehm.09.36. [PubMed] [CrossRef]
23. Silvestris F., Ciavarella S., De Matteo M., Tucci M., Dammacco F. Bone-Resorbing Cells in Multiple Myeloma: Osteoclasts, Myeloma Cell Polykaryons, or Both? Oncologist. 2009;14:264–275. doi: 10.1634/theoncologist.2008-0087. [PubMed] [CrossRef]
24. Merico F., Bergui L., Gregoretti M.G., Ghia P., Aimo G., Lindley I.J., Caligaris-Cappio F. Cytokines involved in the progression of multiple myeloma. Clin. Exp. Immunol. 1993;92:27–31. doi: 10.1111/j.1365-2249.1993.tb05943.x. [PMC free article] [PubMed] [CrossRef]
25. Pavlova N.N., Thompson C.B. The emerging hallmarks of cancer metabolism. Cell Metab. 2016;23:27–47. doi: 10.1016/j.cmet.2015.12.006. [PMC free article] [PubMed] [CrossRef]
26. Brown G.K. Glucose transporters: Structure, function and consequences of deficiency. J. Inherit. Metab. Dis. 2000;23:237–246. doi: 10.1023/A:1005632012591. [PubMed] [CrossRef]
27. Alfarouk K.O., Verduzco D., Rauch C., Muddathir A.K., Bashir H.H., Elhassan G.O., Ibrahim M.E., Orozco J.D.P., Cardone R.A., Reshkin S.J. Glycolysis, tumor metabolism, cancer growth and dissemination. A new pH-based etiopathogenic perspective and therapeutic approach to an old cancer question. Oncoscience. 2014;1:777–802. doi: 10.18632/oncoscience.109. [PMC free article] [PubMed] [CrossRef]
28. Zheng J. Energy metabolism of cancer: Glycolysis versus oxidative phosphorylation. Oncol. Lett. 2012;4:1151–1157. doi: 10.3892/ol.2012.928. [PMC free article] [PubMed] [CrossRef]
29. DeBerardinis R.J., Chandel N.S. Fundamentals of cancer metabolism. Sci. Adv. 2016;2:2:1–2:18. doi: 10.1126/sciadv.1600200. [PMC free article] [PubMed] [CrossRef]
30. Pfeiffer T., Schuster S., Bonhoeffer S. Cooperation and competition in the evolution of ATP-producing pathways. Science. 2001;292:504–507. doi: 10.1126/science.1058079. [PubMed] [CrossRef]
31. Newsholme P., Procopio J., Lima M.M.R., Pithon-Curi T.C., Curi R. Glutamine and glutamate—Their central role in cell metabolism and function. Cell Biochem. Funct. 2003;21:1–9. doi: 10.1002/cbf.1003. [PubMed] [CrossRef]
32. Pochini L., Scalise M., Galluccio M., Indiveri C. Membrane transporters for the special amino acid glutamine: Structure/function relationships and relevance to human health. Front. Chem. 2014;2:61:1–61:23. doi: 10.3389/fchem.2014.00061. [PMC free article] [PubMed] [CrossRef]
33. Altman B.J., Stine Z.E., Dang C.V. From Krebs to clinic: Glutamine metabolism to cancer therapy. Nat. Rev. Cancer. 2016;16:619–634. doi: 10.1038/nrc.2016.71. [PMC free article] [PubMed] [CrossRef]
34. Curthoys N.P., Watford M. Regulation of glutaminase activity and glutamine metabolism. Annu. Rev. Nutr. 1995;15:133–159. doi: 10.1146/annurev.nu.15.070195.001025. [PubMed] [CrossRef]
35. Moreadith R.W., Lehninger A.L. The pathways of glutamate and glutamine oxidation by tumor cell mitochondria. Role of mitochondrial NAD(P)+-dependent malic enzyme. J. Biol. Chem. 1984;259:6215–6221. [PubMed]
36. Hirschey M.D., DeBerardinis R.J., Diehl A.M., Drew J.E., Frezza C., Green M.F., Jones L.W., Ko Y.H., Le A., Lea M.A., et al. Dysregulated metabolism contributes to oncogenesis. Semin. Cancer Biol. 2015;35:129–150. doi: 10.1016/j.semcancer.2015.10.002. [PMC free article] [PubMed] [CrossRef]
37. Lane A.N., Fan T.W.M. Regulation of mammalian nucleotide metabolism and biosynthesis. Nucleic Acids Res. 2015;43:2466–2485. doi: 10.1093/nar/gkv047. [PMC free article] [PubMed] [CrossRef]
38. Cory J.G., Cory A.H. Critical roles of glutamine as nitrogen donors in purine and pyrimidine nucleotide synthesis: Asparaginase treatment in childhood acute lymphoblastic leukemia. In Vivo. 2006;20:587–589. [PubMed]
39. Alfarouk K.O., Shayoub M.E.A., Muddathir A.K., Elhassan G.O., Bashir A.H.H. Evolution of Tumor Metabolism might Reflect Carcinogenesis as a Reverse Evolution process (Dismantling of Multicellularity) Cancers. 2011;3:3002–3017. doi: 10.3390/cancers3033002. [PMC free article] [PubMed] [CrossRef]
40. Zu X.L., Guppy M. Cancer metabolism: Facts, fantasy, and fiction. Biochem. Biophys. Res. Commun. 2004;313:459–465. doi: 10.1016/j.bbrc.2003.11.136. [PubMed] [CrossRef]
41. Gatenby R.A., Gillies R.J. Why do cancers have high aerobic glycolysis? Nat. Rev. Cancer. 2004;4:891–899. doi: 10.1038/nrc1478. [PubMed] [CrossRef]
42. Koppenol W.H., Bounds P.L., Dang C.V. Otto Warburg’s contributions to current concepts of cancer metabolism. Nat. Rev. Cancer. 2011;11:325–337. doi: 10.1038/nrc3038. [PubMed] [CrossRef]
43. Fantin V.R., St-Pierre J., Leder P. Attenuation of LDH-A expression uncovers a link between glycolysis, mitochondrial physiology, and tumor maintenance. Cancer Cell. 2006;9:425–434. doi: 10.1016/j.ccr.2006.04.023. [PubMed] [CrossRef]
44. Martinez-Outschoorn U.E., Peiris-Pageès M., Pestell R.G., Sotgia F., Lisanti M.P. Cancer metabolism: A therapeutic perspective. Nat. Rev. Clin. Oncol. 2017;14:11–31. doi: 10.1038/nrclinonc.2016.60. [PubMed] [CrossRef]
45. DeBerardinis R.J., Cheng T. Q’s next: The diverse functions of glutamine in metabolism, cell biology and cancer. Oncogene. 2010;29:313–324. doi: 10.1038/onc.2009.358. [PMC free article] [PubMed] [CrossRef]
46. He Q., Shi X., Zhang L., Yi C., Zhang X., Zhang X. De novo glutamine synthesis: Importance for the proliferation of glioma cells and potentials for its detection with 13N-ammonia. Mol. Imaging. 2016;15:1–9. doi: 10.1177/1536012116645440. [PMC free article] [PubMed] [CrossRef]
47. Nicklin P., Bergman P., Zhang B., Triantafellow E., Wang H., Nyfeler B., Yang H., Hild M., Kung C., Wilson C., et al. Bidirectional transport of amino acids regulates mTOR and autophagy. Cell. 2009;136:521–534. doi: 10.1016/j.cell.2008.11.044. [PMC free article] [PubMed] [CrossRef]
48. Thompson C.B. Rethinking the regulation of cellular metabolism. Cold Spring Harb. Symp. Quant. Biol. 2011;76:23–29. doi: 10.1101/sqb.2012.76.010496. [PubMed] [CrossRef]
49. Rathmell J.C., vander Heiden M.G., Harris M.H., Frauwirth K.A., Thompson C.B. In the absence of extrinsic signals, nutrient utilization by lymphocytes is insufficient to maintain either cell size or viability. Mol. Cell. 2000;6:683–692. doi: 10.1016/S1097-2765(00)00066-6. [PubMed] [CrossRef]
50. Glynn S.A., Albanes D. Folate and cancer: A review of the literature. Nutr. Cancer. 1994;22:101–119. doi: 10.1080/01635589409514336. [PubMed] [CrossRef]
51. Liu W., Phang J.M. Oncogene and Cancer—From Bench to Clinic. Volume 15. InTech; London, UK: 2013. pp. 359–390.
52. Nakano A., Miki H., Nakamura S., Harada T., Oda A., Amou H., Fujii S., Kagawa K., Takeuchi K., Ozaki S., et al. Up-regulation of hexokinaseII in myeloma cells: Targeting myeloma cells with 3-bromopyruvate. J. Bioenerg. Biomembr. 2012;44:31–38. doi: 10.1007/s10863-012-9412-9. [PubMed] [CrossRef]
53. Mathupala S.P., Ko Y.H., Pedersen P.L. Hexokinase II: Cancer’s double-edged sword acting as both facilitator and gatekeeper of malignancy when bound to mitochondria. Oncogene. 2006;25:4777–4786. doi: 10.1038/sj.onc.1209603. [PMC free article] [PubMed] [CrossRef]
54. Robey R.B., Hay N. Mitochondrial hexokinases, novel mediators of the antiapoptotic effects of growth factors and Akt. Oncogene. 2006;25:4683–4696. doi: 10.1038/sj.onc.1209595. [PubMed] [CrossRef]
55. Lis P., Dyląg M., Niedźwiecka K., Ko Y.H., Pedersen P.L., Goffeau A., Ułaszewski S. The HK2 dependent “Warburg Effect” and mitochondrial oxidative phosphorylation in cancer: Targets for effective therapy with 3-bromopyruvate. Molecules. 2016;21:1730 doi: 10.3390/molecules21121730. [PubMed] [CrossRef]
56. Azevedo-Silva J., Queirós O., Ribeiro A., Baltazar F., Young K.H., Pedersen P.L., Preto A., Casal M. The cytotoxicity of 3-bromopyruvate in breast cancer cells depends on extracellular pH. Biochem. J. 2015;467:247–258. doi: 10.1042/BJ20140921. [PubMed] [CrossRef]
57. Niedźwiecka K., Dyląg M., Augustyniak D., Majkowska-Skrobek G., Cal-Bąkowska M., Ko Y.H., Pedersen P.L., Goffeau A., Ułaszewski S. Glutathione may have implications in the design of 3-bromopyruvate treatment protocols for both fungal and algal infections as well as multiple myeloma. Oncotarget. 2016;7:65614–65626. doi: 10.18632/oncotarget.11592. [PMC free article] [PubMed] [CrossRef]
58. Zhang X.D., Deslandes E., Villedieu M., Poulain L., Duval M., Gauduchon P., Schwartz L., Icard P. Effect of 2-deoxy-d-glucose on various malignant cell lines in vitro. Anticancer Res. 2006;26:3561–3566. [PubMed]
59. Zhang D., Li J., Wang F., Hu J., Wang S., Sun Y. 2-Deoxy-d-glucose targeting of glucose metabolism in cancer cells as a potential therapy. Cancer Lett. 2014;355:176–183. doi: 10.1016/j.canlet.2014.09.003. [PubMed] [CrossRef]
60. Gu Z., Xia J., Xu H., Frech I., Tricot G., Zhan F. NEK2 Promotes Aerobic Glycolysis in Multiple Myeloma Through Regulating Splicing of Pyruvate Kinase. J. Hematol. Oncol. 2017;10:17:1–17:11. doi: 10.1186/s13045-017-0392-4. [PMC free article] [PubMed] [CrossRef]
61. He Y., Wang Y., Liu H., Xu X., He S., Tang J., Huang Y., Miao X., Wu Y., Wang Q. Pyruvate kinase isoform M2 (PKM2) participates in multiple myeloma cell proliferation, adhesion and chemoresistance. Leuk. Res. 2015;39:1428–1436. doi: 10.1016/j.leukres.2015.09.019. [PubMed] [CrossRef]
62. Tamada M., Suematsu M., Saya H. Pyruvate Kinase M2: Multiple faces for conferring benefits on cancer cells. Clin. Cancer Res. 2012;18:5554–5561. doi: 10.1158/1078-0432.CCR-12-0859. [PubMed] [CrossRef]
63. Fujiwara S., Wada N., Kawano Y., Okuno Y., Kikukawa Y., Endo S., Nishimura N., Ueno N., Mitsuya H., Hata H. Lactate, a putative survival factor for myeloma cells, is incorporated by myeloma cells through monocarboxylate transporters 1. Exp. Hematol. Oncol. 2015;4:12:1–12:8. doi: 10.1186/s40164-015-0008-z. [PMC free article] [PubMed] [CrossRef]
64. Sonveaux P., Végran F., Schroeder T., Wergin M.C., Verrax J., Rabbani Z.N., de Saedeleer C.J., Kennedy K.M., Diepart C., Jordan B.F. Targeting lactate-fueled respiration selectively kills hypoxic tumor cells in mice. J. Clin. Investig. 2008;118:3930–3942. doi: 10.1172/JCI36843. [PMC free article] [PubMed] [CrossRef]
65. Doherty J.R., Cleveland J.L. Targeting lactate metabolism for cancer therapeutics. J. Clin. Investig. 2013;123:3685–3692. doi: 10.1172/JCI69741. [PMC free article] [PubMed] [CrossRef]
66. Fujiwara S., Wada N., Kawano Y., Kikukawa Y., Mitsuya H., Hata H. Lactate is a crucial energy source for multiple myeloma (MM) cells in bone marrow microenvironment. Blood. 2013;122:3109.
67. Zhang S., Hulver M.W., McMillan R.P., Cline M.A., Gilbert E.R. The pivotal role of pyruvate dehydrogenase kinases in metabolic flexibility. Nutr. Metab. 2014;11:10:1–10:9. doi: 10.1186/1743-7075-11-10. [PMC free article] [PubMed] [CrossRef]
68. Niewisch M.R., Kuçi Z., Wolburg H., Sautter M., Krampen L., Deubzer B., Handgretinger R., Bruchelt G. Influence of dichloroacetate (DCA) on lactate production and oxygen consumption in neuroblastoma cells: Is DCA a suitable drug for neuroblastoma therapy? Cell. Physiol. Biochem. 2012;29:373–380. doi: 10.1159/000338492. [PubMed] [CrossRef]
69. Sanchez W.Y., McGee S.L., Connor T., Mottram B., Wilkinson A., Whitehead J.P., Vuckovic S., Catley L. Dichloroacetate inhibits aerobic glycolysis in multiple myeloma cells and increases sensitivity to bortezomib. Br. J. Cancer. 2013;108:1624–1633. doi: 10.1038/bjc.2013.120. [PMC free article] [PubMed] [CrossRef]
70. Fujiwara S., Kawano Y., Yuki H., Okuno Y., Nosaka K., Mitsuya H., Hata H. PDK1 inhibition is a novel therapeutic target in multiple myeloma. Br. J. Cancer. 2013;108:170–178. doi: 10.1038/bjc.2012.527. [PMC free article] [PubMed] [CrossRef]
71. Romero-Garcia S., Moreno-Altamiranon M.M.B., Prado-Garcia H., Sánchez-García F.J. Lactate contribution to the tumor microenvironment: Mechanisms, effects on immune cells and therapeutic relevance. Front. Immunol. 2016;7:52:1–52:11. doi: 10.3389/fimmu.2016.00052. [PMC free article] [PubMed] [CrossRef]
72. Rattigan Y.I., Patel B.B., Ackerstaff E., Sukenick G., Koutcher J.A., Glod J.W., Banerjee D. Lactate is a mediator of metabolic cooperation between stromal carcinoma associated fibroblasts and glycolytic tumor cells in the tumor microenvironment. Exp. Cell Res. 2012;318:326–335. doi: 10.1016/j.yexcr.2011.11.014. [PMC free article] [PubMed] [CrossRef]
73. Matsumoto T., Jimi S., Migita K., Takamatsu Y., Hara S. Inhibition of glucose transporter 1 induces apoptosis and sensitizes multiple myeloma cells to conventional chemotherapeutic agents. Leuk. Res. 2016;41:103–110. doi: 10.1016/j.leukres.2015.12.008. [PubMed] [CrossRef]
74. Bolzoni M., Chiu M., Accardi F., Vescovini R., Airoldi I., Storti P., Todoerti K., Agnelli L., Missale G., Andreoli R., et al. Dependence on glutamine uptake and glutamine addiction characterize myeloma cells: A new attractive target. Blood. 2016;128:667–679. doi: 10.1182/blood-2016-01-690743. [PubMed] [CrossRef]
75. Accardi F., Chiu M., Bolzoni M., Storti P., Todoerti K., Agnelli L., Ferrari M., Missale G., Aversa F., Bussolati O., et al. Ammonium Production and Glutamine-Addiction of Myeloma Cells: New Attractive Targets in Multiple Myeloma. Blood. 2014;124:2067.
76. Minetto P., Soncini D., Cagnetta A., Guolo F., Retali V., Rivoli G., Bisso N., Di Felice N., Miglino M., Canepa L., et al. Glutamine-Dependence Targeting By Asparaginase Significantly Increases Anti-Myeloma Activity of Proteasome Inhibitors. Blood. 2017;130:1796.
77. Giuliani N., Chiu M., Bolzoni M., Accardi F., Bianchi M.G., Toscani D., Aversa F., Bussolati O. The potential of inhibiting glutamine uptake as a therapeutic target for multiple myeloma. Expert Opin. Ther. Targets. 2017;21:231–234. doi: 10.1080/14728222.2017.1279148. [PubMed] [CrossRef]
78. Corbet C., Feron O. Metabolic and mind shifts: From glucose to glutamine and acetate addictions in cancer. Curr. Opin. Clin. Nutr. Metab. Care. 2015;18:346–353. doi: 10.1097/MCO.0000000000000178. [PubMed] [CrossRef]
79. Chen L., Cui H. Targeting Glutamine Induces Apoptosis: A Cancer Therapy Approach. Int. J. Mol. Sci. 2015;16:22830–22855. doi: 10.3390/ijms160922830. [PMC free article] [PubMed] [CrossRef]
80. Jeon Y.J., Khelifa S., Ratnikov B., Scott D.A., Feng Y., Parisi F., Ruller C., Lau E., Kim H., Brill L.M., et al. Regulation of glutamine carrier proteins by RNF5 determines breast cancer response to ER stressinducing chemotherapies. Cancer Cell. 2015;27:354–369. doi: 10.1016/j.ccell.2015.02.006. [PMC free article] [PubMed] [CrossRef]
81. Gabay M., Li Y., Felsher D.W. MYC activation is a hallmark of cancer initiation and maintenance. Cold Spring Harb. Perspect. Med. 2014;4:6:1–6:13. doi: 10.1101/cshperspect.a014241. [PMC free article] [PubMed] [CrossRef]
82. Effenberger M., Bommert K.S., Kunz V., Kruk J., Leich E., Rudelius M., Bargou R., Bommert K. Glutaminase inhibition in multiple myeloma induces apoptosis via MYC degradation. Oncotarget. 2017;8:85858–85867. doi: 10.18632/oncotarget.20691. [PMC free article] [PubMed] [CrossRef]
83. Wise D.R., DeBerardinis R.J., Mancuso A., Sayed N., Zhang X.Y., Pfeiffer H.K., Nissim I., Daikhin E., Yudkoff M., McMahon S.B., et al. Myc regulates a transcriptional program that stimulates mitochondrial glutaminolysis and leads to glutamine addiction. Proc. Natl. Acad. Sci. USA. 2008;105:18782–18787. doi: 10.1073/pnas.0810199105. [PMC free article] [PubMed] [CrossRef]
84. Gonsalves W.I., Ramakrishnan V., Hitosugi T., Ghosh T., Jevremovic D., Dutta T., Sakrikar D., Petterson X.M., Wellik L., Kumar S.K., et al. Glutamine-derived 2-hydroxyglutarate is associated with disease progression in plasma cell malignancies. JCI Insight. 2018;3:e94543. doi: 10.1172/jci.insight.94543. [PMC free article] [PubMed] [CrossRef]
85. Casey S.C., Tong L., Li Y., Do R., Walz S., Fitzgerald K.N., Gouw A.M., Baylot V., Gütgemann I., Eilers M., et al. MYC regulates the antitumor immune response through CD47 and PD-L1. Science. 2016;352:227–231. doi: 10.1126/science.aac9935. [PMC free article] [PubMed] [CrossRef]
86. Cacace A., Sboarina M., Vazeille T., Sonveaux P. Glutamine activates STAT3 to control cancer cell proliferation independently of glutamine metabolism. Oncogene. 2017;36:2074–2084. doi: 10.1038/onc.2016.364. [PMC free article] [PubMed] [CrossRef]
87. Roland C.L., Arumugam T., Deng D., Liu S.H., Philip B., Gomez S., Burns W.R., Ramachandran V., Wang H., Cruz-Monserrate Z., et al. Cell surface lactate receptor GPR81 is crucial for cancer cell survival. Cancer Res. 2014;74:5301–5310. doi: 10.1158/0008-5472.CAN-14-0319. [PMC free article] [PubMed] [CrossRef]
88. Yao C., Li Y.Y., Li J., Zhang H.Y., Wang F., Bai X., Li S.S. STAT3 regulates hypoxia-induced epithelial mesenchymal transition in oesophageal squamous cell cancer. Oncol. Rep. 2016;36:108–116. doi: 10.3892/or.2016.4822. [PMC free article] [PubMed] [CrossRef]
89. Denko N.C. Hypoxia, HIF1 and glucose metabolism in the solid tumour. Nat. Rev. Cancer. 2008;8:705–713. doi: 10.1038/nrc2468. [PubMed] [CrossRef]
90. Maiso P., Huynh D., Moschetta M., Sacco A., Aljawai Y., Mishima Y., Asara J.M., Roccaro A.M., Kimmelman A.C., Ghobrial I.M. Metabolic signature identifies novel targets for drug resistance in Multiple Myeloma. Cancer Res. 2015;75:2071–2082. doi: 10.1158/0008-5472.CAN-14-3400. [PMC free article] [PubMed] [CrossRef]
91. Schaefer C.F., Anthony K., Krupa S., Buchoff J., Day M., Hannay T., Buetow K.H. PID: The Pathway Interaction Database. Nucleic Acids Res. 2009;37 674–679. doi: 10.1093/nar/gkn653. [PMC free article] [PubMed] [CrossRef] 674–679. doi: 10.1093/nar/gkn653. [PMC free article] [PubMed] [CrossRef]
92. Mulligan G., Mitsiades C., Bryant B., Zhan F., Chng W.J., Roels S., Koenig E., Fergus A., Huang Y., Richardson P., et al. Gene expression profiling and correlation with outcome in clinical trials of the proteasome inhibitor bortezomib. Blood. 2007;109:3177–3188. doi: 10.1182/blood-2006-09-044974. [PubMed] [CrossRef]
93. Liu Z., Jia X., Duan Y., Xiao H., Sundqvist K.G., Permert J., Wang F. Excess glucose induces hypoxia-inducible factor-1α in pancreatic cancer cells and stimulates glucose metabolism and cell migration. Cancer Biol. Ther. 2013;14:428–435. doi: 10.4161/cbt.23786. [PMC free article] [PubMed] [CrossRef]
94. Zub K.A., de Sousa M.M.L., Sarno A., Sharma A., Demirovic A., Rao S., Young C., Aas P.A., Ericsson I., Sundan A., et al. Modulation of Cell Metabolic Pathways and Oxidative Stress Signaling Contribute to Acquired Melphalan Resistance in Multiple Myeloma Cells. PLoS ONE. 2015;10:3:1–3:20. doi: 10.1371/journal.pone.0119857. [PMC free article] [PubMed] [CrossRef]
95. Cao X., Fang L., Gibbs S., Huang Y., Dai Z., Wen P., Zheng X., Sadee W., Sun D. Glucose uptake inhibitor sensitizes cancer cells to daunorubicin and overcomes drug resistance in hypoxia. Cancer Chemother. Pharmacol. 2007;59:495–505. doi: 10.1007/s00280-006-0291-9. [PubMed] [CrossRef]
96. Wei C., Bajpai R., Sharma H., Heitmeier M., Jain A.D., Matulis S.M., Nooka A.K., Mishra R.K., Hruz P.W., Schiltz G.E., et al. Development of GLUT4-selective antagonists for multiple myeloma therapy. Eur. J. Med. Chem. 2017;139:573–586. doi: 10.1016/j.ejmech.2017.08.029. [PMC free article] [PubMed] [CrossRef]
97. Bajpai R., Matulis S.M., Wei C., Nooka A.K., Von Hollen H.E., Lonial S., Boise L.H., Shanmugam M. Targeting glutamine metabolism in multiple myeloma enhances BIM binding to BCL-2 eliciting synthetic lethality to venetoclax. Oncogene. 2016;35:3955–3964. doi: 10.1038/onc.2015.464. [PMC free article] [PubMed] [CrossRef]
98. Dalva-Aydemir S., Bajpai R., Martinez M., Adekola K.U., Kandela I., Wei C., Singhal S., Koblinski J.E., Raje N.S., Rosen S.T., et al. Targeting the Metabolic Plasticity of Multiple Myeloma with FDA-Approved Ritonavir and Metformin. Clin. Cancer Res. 2015;21:1161–1171. doi: 10.1158/1078-0432.CCR-14-1088. [PMC free article] [PubMed] [CrossRef]
99. Kurtoglu M., Gao N., Shang J., Maher J.C., Lehrman M.A., Wangpaichitr M., Savaraj N., Lane A.N., Lampidis T.J. Under normoxia, 2-deoxy-D-glucose elicits cell death in select tumor types not by inhibition of glycolysis but by interfering with N-linked glycosylation. Mol. Cancer Ther. 2007;6:3049–3058. doi: 10.1158/1535-7163.MCT-07-0310. [PubMed] [CrossRef]
100. Maher J.C., Krishan A., Lampidis T.J. Greater cell cycle inhibition and cytotoxicity induced by 2-deoxy-D-glucose in tumor cells treated under hypoxic vs aerobic conditions. Cancer Chemother. Pharmacol. 2004;53:116–122. doi: 10.1007/s00280-003-0724-7. [PubMed] [CrossRef]
101. Miao P., Sun X., Liu J., Huang G. Lactate dehydrogenase a in cancer: A promising target for diagnosis and therapy. IUBMB Life. 2013;65:904–910. doi: 10.1002/iub.1216. [PubMed] [CrossRef]
102. Mattaini K.R., Sullivan M.R., Vander Heiden M.G. The importance of serine metabolism in cancer. J. Cell Biol. 2016;214:249–257. doi: 10.1083/jcb.201604085. [PMC free article] [PubMed] [CrossRef]
103. Locasale J.W. Serine, glycine and one-carbon units: Cancer metabolism in full circle. Nat. Rev. Cancer. 2013;13:572–583. doi: 10.1038/nrc3557. [PMC free article] [PubMed] [CrossRef]
104. Zaal E.A., Wu W., Jansen G., Zweegman S., Cloos J., Berkers C.R. Bortezomib resistance in multiple myeloma is associated with increased serine synthesis. Cancer Metab. 2017;5:7:1–7:12. doi: 10.1186/s40170-017-0169-9. [PMC free article] [PubMed] [CrossRef]
105. Maddocks O.D.K., Athineos D., Cheung E.C., Lee P., Zhang T., van den Broek N.J.F., Mackay G.M., Labuschagne C.F., Gay D., Kruiswijk F., et al. Modulating the therapeutic response of tumours to dietary serine and glycine starvation. Nature. 2017;544:372–376. doi: 10.1038/nature22056. [PubMed] [CrossRef]
106. Patra K.C., Hay N. The pentose phosphate pathway and cancer. Trends Biochem. Sci. 2014;39:347–354. doi: 10.1016/j.tibs.2014.06.005. [PMC free article] [PubMed] [CrossRef]
107. Horecker B.L. The pentose phosphate pathway. J. Biol. Chem. 2002;277:47965–47971. doi: 10.1074/jbc.X200007200. [PubMed] [CrossRef]
108. Chen Y., Huang R., Ding J., Ji D., Song B., Yuan L., Chang H., Chen G. Multiple myeloma acquires resistance to EGFR inhibitor via induction of pentose phosphate pathway. Sci. Rep. 2015;5:9925:1–9925:8. doi: 10.1038/srep09925. [PMC free article] [PubMed] [CrossRef]
109. Normanno N., De Luca A., Bianco C., Strizzi L., Mancino M., Maiello M.R., Carotenuto A., de Feo G., Caponigro F., Salomon D.S. Epidermal growth factor receptor (EGFR) signaling in cancer. Gene. 2006;366:2–16. doi: 10.1016/j.gene.2005.10.018. [PubMed] [CrossRef]
110. Hothersall J.S., Gordge M., Noronha-Dutra A.A. Inhibition of NADPH supply by 6-aminonicotinamide: Effect on glutathione, nitric oxide and superoxide in J774 cells. FEBS Lett. 1998;434:97–100. doi: 10.1016/S0014-5793(98)00959-4. [PubMed] [CrossRef]
111. Thompson R.M., Dytfeld D., Reyes L., Robinson R.M., Smith B., Manevich Y., Jakubowiak A., Komarnicki M., Przybylowicz-Chalecka A., Szczepaniak T., et al. Glutaminase inhibitor CB-839 synergizes with carfilzomib in resistant multiple myeloma cells. Oncotarget. 2017;8:35863–35876. doi: 10.18632/oncotarget.16262. [PMC free article] [PubMed] [CrossRef]
112. Katz B.Z. Adhesion molecules—The lifelines of multiple myeloma cells. Semin. Cancer Biol. 2010;20:186–195. doi: 10.1016/j.semcancer.2010.04.003. [PubMed] [CrossRef]
113. Burger J.A., Ghia P., Rosenwald A., Caligaris-Cappio F. The microenvironment in mature B-cell malignancies: A target for new treatment strategies. Blood. 2009;114:3367–3375. doi: 10.1182/blood-2009-06-225326. [PMC free article] [PubMed] [CrossRef]
114. Damiano J.S., Cress A.E., Hazlehurst L.A., Shtil A.A., Dalton W.S. Cell adhesion mediated drug resistance (CAM-DR): Role of integrins and resistance to apoptosis in human myeloma cell lines. Blood. 1999;93:1658–1667. [PMC free article] [PubMed]
115. Zhu J., Wang M., Cao B., Hou T., Mao X. Targeting the phosphatidylinositol 3-kinase/AKT pathway for the treatment of multiple myeloma. Curr. Med. Chem. 2014;21:3173–3187. doi: 10.2174/0929867321666140601204513. [PubMed] [CrossRef]
116. Steinbrunn T., Stühmer T., Sayehli C., Chatterjee M., Einsele H., Bargou R.C. Combined targeting of MEK/MAPK and PI3K/Akt signalling in multiple myeloma. Br. J. Haematol. 2012;159:430–440. doi: 10.1111/bjh.12039. [PubMed] [CrossRef]
117. Medina E.A., Oberheu K., Polusani S.R., Ortega V., Velagaleti G.V., Oyajobi B.O. PKA/AMPK signaling in relation to adiponectin’s antiproliferative effect on multiple myeloma cells. Leukemia. 2014;28:2080–2089. doi: 10.1038/leu.2014.112. [PubMed] [CrossRef]
118. Qin X., Lin L., Cao L., Zhang X., Song X., Hao J., Zhang Y., Wei R., Huang X., Lu J., et al. Extracellular matrix protein Reelin promotes myeloma progression by facilitating tumor cell proliferation and glycolysis. Sci. Rep. 2017;7:45305:1–45305:12. doi: 10.1038/srep45305. [PMC free article] [PubMed] [CrossRef]
119. Tamura H. Immunopathogenesis and immunotherapy of multiple myeloma. Int. J. Hematol. 2018;107:278–285. doi: 10.1007/s12185-018-2405-7. [PubMed] [CrossRef]
120. Krejcik J., Frerichs K.A., Nijhof I.S., van Kessel B., van Velzen J.F., Bloem A.C., Broekmans M.E.C., Zweegman S., van Meerloo J., Musters R.J.P. Monocytes and Granulocytes Reduce CD38 Expression Levels on Myeloma Cells in Patients Treated with Daratumumab. Clin. Cancer Res. 2017;23:7498–7511. doi: 10.1158/1078-0432.CCR-17-2027. [PMC free article] [PubMed] [CrossRef]
121. Hosen N., Matsunaga Y., Hasegawa K., Matsuno H., Nakamura Y., Makita M., Watanabe K., Yoshida M., Satoh K., Morimoto S. The activated conformation of integrin β7 is a novel multiple myeloma-specific target for CAR T cell therapy. Nat. Med. 2017;23:1436–1443. doi: 10.1038/nm.4431. [PubMed] [CrossRef]
122. Kouidhi S., Ben Ayed F., Benammar Elgaaied A. Targeting Tumor Metabolism: A New Challenge to Improve Immunotherapy. Front. Immunol. 2018;9:353. doi: 10.3389/fimmu.2018.00353. [PMC free article] [PubMed] [CrossRef]
123. Beckermann K.E., Dudzinski S.O., Rathmell J.C. Dysfunctional T cell metabolism in the tumor microenvironment. Cytokine Growth Factor Rev. 2017;35:7–14. doi: 10.1016/j.cytogfr.2017.04.003. [PMC free article] [PubMed] [CrossRef]
124. Noël G., Fontsa M.L., Willard-Gallo K. The impact of tumor cell metabolism on T cell-mediated immune responses and immuno-metabolic biomarkers in cancer. Semin. Cancer Biol. 2018:1–28. doi: 10.1016/j.semcancer.2018.03.003. [PubMed] [CrossRef]
125. Housman G., Byler S., Heerboth S., Lapinska K., Longacre M., Snyder N., Sarkar S. Drug resistance in cancer: An overview. Cancers. 2014;6:1769–1792. doi: 10.3390/cancers6031769. [PMC free article] [PubMed] [CrossRef]
126. Parkin B., Ouillette P., Li Y., Keller J., Lam C., Roulston D., Li C., Shedden K., Malek S.N. Clonal evolution and devolution after chemotherapy in adult acute myelogenous leukemia. Blood. 2013;121:369–377. doi: 10.1182/blood-2012-04-427039. [PMC free article] [PubMed] [CrossRef]
127. Navin N., Krasnitz A., Rodgers L., Cook K., Meth J., Kendall J., Riggs M., Eberling Y., Troge J., Grubor V., et al. Inferring tumor progression from genomic heterogeneity. Genome Res. 2010;20:68–80. doi: 10.1101/gr.099622.109. [PMC free article] [PubMed] [CrossRef] |