介绍
长期以来,超声一直被用作肝脏和胆道树手术的解剖学和诊断指南。 B型超声技术于1970年代问世,可以实时查看二维(2D)超声图像,这有助于其在各种情况下的使用,包括开放性胆囊切除术以评估胆总管(CBD)用于结石并定义导管和血管解剖[1-3]。然而,由于相对容易获得触觉操纵和CBD的探查,在开放手术时代的胆囊切除术中,超声和术中胆道造影(IOC)均未常规使用。 1990年代初期,腹腔镜胆囊切除术的迅速采用最初与CBD损伤率的急剧上升有关。除了需要一种可靠的方法通过腹腔镜评估胆总管结石之外,呼吁对严重并发症的增加进行补救的呼吁也引起了对术中腹腔镜超声检查(LUS)和IOC的重新关注。尽管仍然存在关于这些方式在降低CBD损伤率方面的作用的争论,但毫无疑问,它们是有价值的工具,可以使高级外科医师在腹腔镜下观察和接近胆道的解剖关系。
目前,在腹腔镜胆囊切除术中,LUS和IOC都是检测CBD结石和勾勒解剖结构的绝佳选择。 LUS具有几个明显的优势,包括缺少放射和对比染料,无需插管胆囊管即可进行重复检查的能力以及相对优越的时间和成本效益。此外,由于腹腔镜检查是一种表面成像方式,因此LUS可以评估可见表面以外的结构。本章介绍在腹腔镜胆囊切除术中进行LUS的技术,并解释所产生的超声图像。本文还回顾了有关LUS有效性的可用临床数据,无论是单独使用还是与IOC进行比较。
适应症
在腹腔镜胆囊切除术中使用超声波有两个主要功能:CBD结石的鉴定以及胆道和血管解剖学的检查和确认。关于这两种功能,LUS可以有选择地使用或以常规方式使用。当以选择性方式(类似于选择性IOC)应用时,如果术前或术中怀疑胆总管结石症,则使用LUS。该评估可以基于许多术前因素,包括黄疸,胆红素或转氨酶水平升高,经腹部超声检查发现扩张的CBD或胆总管结石,脂肪酶水平升高或胆结石性胰腺炎病史。术中观察CBD扩张或胆囊管扩张和/或胆囊管内有结石也可提示胆总管结石的存在。当对肝胆三角的解剖方向存在疑问时,LUS可选择性地用于解剖学识别,以确认CBD和肝总管相对于解剖平面的位置,或确认导管或导管异常初次解剖时确定的血管形态。
作者提倡在腹腔镜胆囊切除术中使用LUS的常规方法,在这种情况下,无论术前是否怀疑胆总管结石或术中解剖结构是否容易确定,均应在每例病例中进行LUS检查。常规使用方法有几个优点。它使外科医生可以更快地积累广泛的LUS经验,并熟悉正常导管解剖的超声检查外观。这样可以在困难和可能有压力的情况下(例如具有炎症性疾病或异常解剖结构的情况)解释LUS图像时更有信心。如果外科手术受训人员在这种情况下提供帮助,则常规使用可使他们增加对LUS技术的暴露,并通过第二种可视化方式增强腹腔镜下所见解剖结构的认知相关性。此外,常规的LUS使用协议允许其他手术室工作人员熟悉该程序及其相关技术,并保证在案中可以使用必要的设备。
设备
现代腹腔镜超声探头旨在实现高效可靠的术中使用。作者使用直径10 mm的探头,该探头可以插入标准的10或11 mm腹腔镜套管针(8666型换能器,BK Medical,Herlev,丹麦),尽管其他几种类似的探头也可以从市场上买到。探头主要使用B模式(即二维)超声,频率在5到10 MHz之间。腹腔镜评估胆道系统期间最常用的频率是7和7.5 MHz。长度在3到7厘米之间的线性或曲线超声阵列是最佳的。
具有垂直和水平可偏转尖端的探头有助于获得可变的视角,并且大多数都结合了多普勒超声技术,可将流量测量结果同时叠加到主超声图像上。此功能可用于区分胆管和邻近的脉管系统,尤其是在对靠近肝总管和肝固有动脉分叉的胆管树成像时。可以在每次使用后对现代探头进行消毒,从而消除了对无菌探头套的需求,无菌套可能会撕裂,造成手术区域的污染,并且通常难以通过腹腔镜套管针引入。
有效使用LUS的关键是内窥镜操作套件,该套件可在“画中画”显示中同时将两个图像传输到观察监视器(图5.1)。这允许外科医生在腹腔镜下将超声图像与其解剖位置相关联,以及在手术领域中有效地操纵LUS探头。另外,记录腹腔镜和超声图像的能力有助于医学文献记录和回顾性教学。
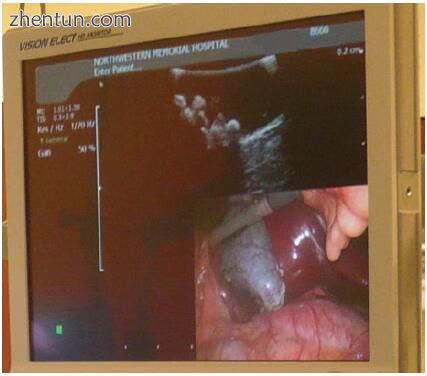
图5.1手术室监控器配置为以“画中画”视图同时显示超声图像和腹腔镜图像
腹腔镜超声技术初始解剖
尽管一些作者描述了在建立气腹后立即在腹腔镜胆囊切除术中使用LUS,但在常规情况下,作者更喜欢在超声检查之前对肝囊三角进行初步解剖。使用标准的四端口技术,将钝性和电灼解剖相结合,可从肝胆三角中去除所有纤维组织和脂肪组织,以建立“安全性的关键观点”。保留LUS直到进行此解剖后才有几个优点。最重要的是,仔细彻底地解剖是防止CBD损伤的最重要手段。通过在LUS检查之前完成此解剖,外科医生不会冒被超声上看似正常的解剖结构所误导的风险。此外,通过解剖打开肝胆三角可简化和完成LUS检查。胆囊从其腹膜附着在肝床上的下侧释放出来,从而使胆小管进一步从胆囊管-CBD连接处缩回。这使得LUS易于识别和勾勒出导管结构,并使外科医生在LUS期间以更大的活动性来操纵漏斗,以创建各种视角。
如果在解剖过程中无法确定解剖结构以形成“关键视图”,则可以更早地使用LUS来检查与所讨论区域相关的导管。在解剖困难或混乱的情况下,可以联合使用LUS和IOC建立更可靠的解剖学检查。但是,仅应将LUS和IOC视为提供其他信息的工具,而不应提供确定的评估。如果使用这些方法后,对于关键的导管和/或血管结构的解剖关系存在任何不确定性,则外科医生应毫不犹豫地转换为开放手术,以确保最佳安全性。
术中扫描
对“临界视图”的解剖完成后,将超声探头连接到扫描仪,并将监视器切换到“画中画”视图。使用标准的“US”四端口配置,可以通过上腹部或脐带套管针引入超声探头。尽管作者更喜欢上腹技术(视频5.1),但是每种方法都有其自身的优点和缺点。通常,当无法通过一根套管针将CBD的特定结构或部分可视化时,必须切换探头位置,并且一些作者主张在每种情况下都必须从两个方向进行常规成像。尽管作者发现这很少需要,但外科医生必须对这两种技术都非常熟悉。
胃上扫描技术
扫描上腹部的套管针时,外科医生站立在患者的左侧,用右手操纵探头,而左手则使用通过两个右肋下套管针的更内侧放置的抓取器来缩回胆囊漏斗。助手通过外侧肋下套管针将胆囊眼底上方肝脏撤回,并操作相机。探头朝着胆囊的方向插入,扫描阵列朝后。将食指放在与扫描阵列相反的一侧以握住探针,以在后续探针操作过程中保持空间定向是很有帮助的。
首先将探头直接放置在胆囊壁上。 然后可以调整超声成像的景深和增益,以优化图像。 胆囊内的液体应显示为无回声(即黑色),任何结石均应为高回声(即白色)并在其声场中超出其位置而产生“阴影”(图5.2)。 扫描胆囊时,可以识别出其他息肉,例如息肉。 与结石相反,息肉会出现较少的高回声,不会产生阴影,可能会在多普勒上出现血流,并且不会掉落到胆囊内的相关部位。
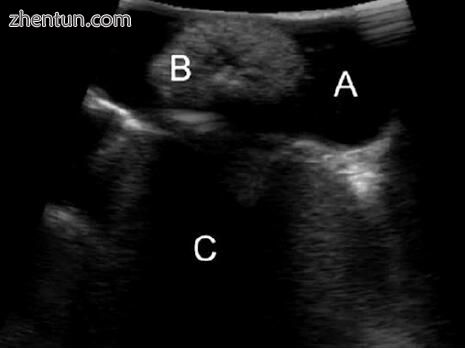
图5.2胆囊成像,显示低回声胆囊液(A),大回声结石(B)和由该结石形成的超声阴影(C)
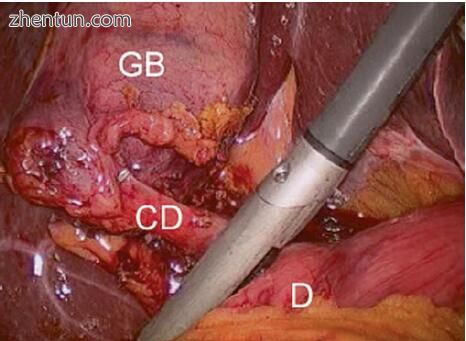
图5.3扫描上腹部套管针时对胆道树成像的起始位置。探头放置在肝十二指肠韧带的中部,高于十二指肠(D),次于胆囊管(CD)和胆囊(GB)
一旦对超声图进行了微调并检查了胆囊,就将探头放置在肝十二指肠韧带的中部,扫描阵列朝后(图5.3)。然后操纵探针以便可视化门三联征结构:CBD,肝固有动脉和门静脉。探头的位置垂直于肝十二指肠韧带,因此,所有三个结构在横向方向上均可见,并在超声图像上显示为圆圈。 CBD和肝动脉的直径通常较小,并在相同的前后平面中对齐,并在较大的门静脉腹侧。这种正常配置会产生所谓的“米老鼠头”超声波图像外观(图5.4)。
然后将探头沿肝十二指肠韧带向下移动并朝十二指肠移动,以扫描CBD的长度。在此步骤中,外科医生应缓慢移动探针,同时只能在一个平面内移动而不旋转。这将使可视化胰上CBD的整个长度,并最小化跳过包含结石的一段导管的风险。在此步骤中,探头应轻轻放在肝十二指肠韧带上。如果施加的压力太大,CBD将被压缩并从视线中遮挡。相反,如果将探头从韧带表面上提起,则会丢失声窗和超声图像。对于肝十二指肠韧带无脂肪的非常瘦的患者,这可能是一个问题。为了解决这个问题,可以注入盐水以淹没右上象限并充当声耦合器,以创建更好的声窗。但是,在实际实践中,作者发现这几乎没有必要,而且会增加时间。
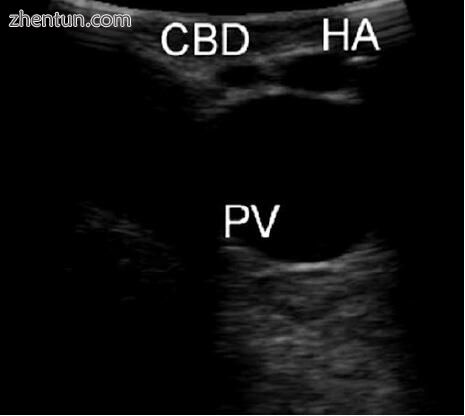
图5.4可视化门三联征,在前视横断面中看到一条普通的胆总管(CBD)和肝固有动脉(HA)以及后部门静脉(PV)的“米老鼠头”外观
由于对CBD进行了连续成像,因此外科医生应首先寻找导管内结石和淤渣。石头出现强烈的高回声,并在与扫描阵列相对的一侧(即,朝向超声图像的底部)产生声音阴影(图5.5)。一旦检测到,就可以使用超声卡尺功能测量宝石的直径。这有助于确定通过腹腔镜或开放式CBD探查或内镜逆行胰胆管造影(ERCP)清除结石的最有效方法。污泥定义为回声的导管内碎片,由直径小于2 mm的颗粒组成,通常不会导致阴影。在作者对LUS的最初经验中,作者将尝试通过引入到胆囊管中的导管冲洗来治疗CBD污泥的所有发现。但是,作者发现这种污泥通常不会产生临床后果,现在可以对导致胆道阻塞或胰腺炎的情况进行干预。
在其胰腺上部分成像后,当CBD进入胰腺实质时向远端跟踪。当CBD进入胰腺时,其路径偏向患者的右侧,朝向Vater壶腹。为了沿着该路线顺着导管,将LUS探头保持在一个固定位置,该位置紧靠十二指肠的上缘并沿顺时针方向缓慢旋转。通过这种运动,应将CBD保持在超声图像上的横向方向(图5.6)。应遵循导管直到其进入十二指肠。壶腹的肌肉括约肌通常被视为围绕导管最远端的低回声环(图5.7)。此外,通常可以看到胰管横越CBD下方的胰腺。在某些患者中,存在长且常见的CBD胰管节段,并且可以通过超声检查予以记录,这可能导致胆结石性胰腺炎的发展。
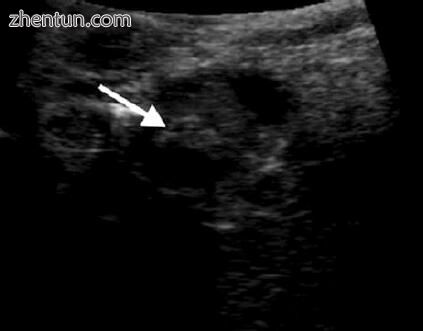
图5.5胆总管内可见的高回声结石(箭头)
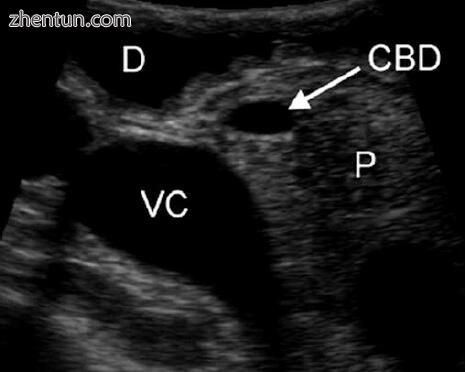
图5.6可见胆总管(CBD)穿过相对高回声的胰腺实质(P)。 十二指肠前(D)和后下腔静脉(VC)也可见
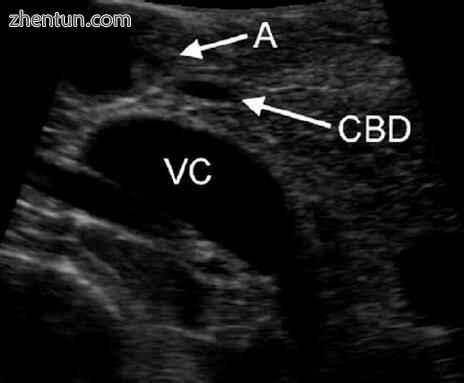
图5.7可以看到远端胆总管(CBD)刚好通过Vater(A)的壶腹进入十二指肠。下腔静脉(VC)在胰腺后部可见
与肝十二指肠韧带的脂肪组织相比,胰腺组织相对高回声。这会使胰腺内导管段中CBD结石的检测更加困难。在许多系列中,胰腺内远端CBD的完全可视化和结石检测率低于胰腺上部分,并且一些作者将远端CBD成像描述为腹腔镜胆囊切除术中LUS的“致命弱点” [12-14] ]。如果远端CBD的可视化不充分,可以执行一些操作以改善图像质量。通常,简单地将LUS探头直接放在十二指肠上,使换能器朝后,并在施加轻微的向下压力(以置换空气)的同时进行扫描,即可获得胰腺内CBD的出色图像。如果此操作无法提供足够的可视化效果,则可以通过鼻胃管将盐水注入胃和十二指肠,从而形成更好的声学窗口。如果上腹可视化不充分,也可以通过脐带套管针重新放置探头。在CBD狭窄的患者中,可通过通过胆囊导管切开术引入的导管将盐水注入导管。这起到了扩张CBD的作用,并可能使远端CBD结石更好地可视化,但需要与IOC相同的导管切开术和插管术。
在对CBD的全长进行了令人满意的结石评估后,人们开始将注意力转向检查肝胆三角的解剖结构。探头返回到肝十二指肠韧带上方的原始位置,然后移动头朝上,直到看到CBD和胆囊管之间的连接为止(图5.8)。在腹腔镜图像上注明该连接的位置,以确保在最初解剖“安全性的关键观点”后做出的解剖学假设实际上是正确的。 LUS还可以用于测量胆囊管的长度,以确保有足够的空间用于夹子的应用。为此,将胆囊漏斗侧向缩回,以使胆囊管垂直于CBD定向。偶尔可以获取胆囊管的纵向图像,并使用超声卡尺功能直接测量其长度。如果解剖结构不允许纵视,则可通过向右上象限注入生理盐水并沿横断面向下扫查胆囊直至观察到从漏斗到狭窄的胆囊管的过渡来估计胆囊管的长度。然后测量从该点(即,胆囊管的原点)到超声图像右侧的CBD横向图像的距离。使用这项技术,一项研究确定,在87%的病例中,测得的胆囊管长度在通过IOC或完全切除胆囊管至CBD交界处确定的长度的5毫米内。
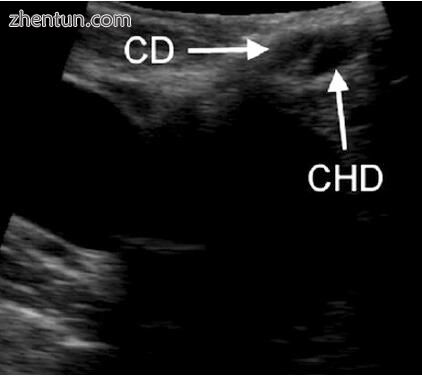
图5.8对胆囊管(CD)和肝总管(CHD)接合形成胆总管时进行了成像
在检查了胆囊管和胆囊-CBD交界处之后,将探头滑动至另一头以可视化肝总管以及左右肝管。在此步骤中,当扫描通过上腹套管针时,肝脏边缘通常会阻塞探针。如果发生这种情况,可以将探针尖端向右弯曲以创建肝管的纵向视图。
脐扫描技术
与通过上腹套管针扫描时看到的横向视图相反,脐带技术可创建CBD的纵向图像。这允许同时查看导管的整个部分,因此,它是许多作者的首选技术[12,13]。然而,从脐带位置进行扫描需要通过上腹套管针移除并重新插入腹腔镜。将腹腔镜头朝下抬起,将监视器朝着桌子的头部摆放时,探头的运动在“镜像”中可见,并且是违反直觉的。这使探头的操作变得笨拙,尤其是对于那些刚接触该技术的人员,因此可以延长执行检查所需的时间。因此,尽管外科医生应精通两种技术,但由于最初的方法通常无法观察到CBD的特定部分,因此作者更喜欢上腹扫描。
脐部扫描始于胆囊从底和漏斗处的退缩。探头位于肝脏上方,并使用V段作为声学窗口将胆囊可视化。与上腹部技术一样,该视图用于调整超声图像,并检查胆囊中是否有结石和息肉。然后将探针向内移动至IV段肝脏上方,并观察到肝管和肝动脉的汇合。使用多普勒模式识别动脉血流有助于使这些结构分支附近的解剖结构定向。
一旦确定了肝总管,将检查其是否有结石和淤渣。当探头穿过脐带套管针进入时,将在纵截面上看到肝管和CBD(图5.9)。使用典型的设置,导管的近端部分将朝超声图像的左侧出现。为了检查管道的整个宽度,请缓慢地前后旋转探针。一旦对导管的一部分进行了完整扫描,就滑动探头以便向远端扫描。当CBD进入胰头时,其超声图像会从纵向变为倾斜,因为导管会弯曲到患者的右侧并进入十二指肠。
一旦对CBD进行了彻底的结石扫描,便会检查胆囊管CBD接头的解剖结构。为了获得这种观点,应重新抓紧胆囊,并从侧面收回漏斗。从脐带套管针,可以在横断面上看到胆囊导管,并沿其长度方向。使用脐带扫描技术识别囊性CBD连接可能会更加困难,因为常常无法同时可视化这两个结构。这可以通过将探头尖端向左偏转以获取横断面的胆囊管和CBD的图像来纠正,在某种意义上可以复制通过上腹部扫描获得的视图。
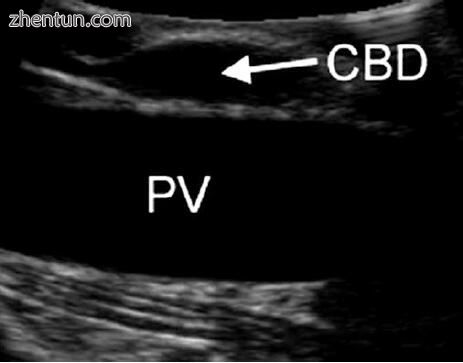
图5.9在通过脐带套管针扫描时,在纵截面中看到的总胆管(CBD)和门静脉(PV)
临床结果与术中胆管造影的比较
由于LUS和IOC通常用于相同的两个目的,即检测CBD结石和识别胆道解剖结构,因此很自然,应该比较这两种方式在这些任务中的功效。但是,尽管有必要了解每种技术的相对优势和劣势,但外科医生不应仅依赖于另一种技术。在某些情况下,有必要在一次手术中同时使用两种成像方法,以确认胆总管结石的存在或解释混乱或异常的解剖结构。因此,建议使用两种方法进行常规练习,尤其是在外科医生的早期经验和培训外科学员时。
与IOC相比,LUS具有几个离散的优势。 LUS不使用辐射,因此可以在怀孕期间安全地进行手术,而不会使手术室人员暴露于潜在有害的辐射之下;此外,不需要专门的放射技术人员的帮助。没有使用对比染料,对碘过敏的患者禁止使用IOC。 IOC还需要导管插入胆囊管,因此如果在初次解剖时误解了胆道解剖结构,则存在CBD损伤的风险。另一方面,LUS基本上没有并发症的风险,并且与IOC不同,在解剖过程中可以很容易地多次进行IOC,以重新评估解剖结构。相反,IOC通常提供更全面的胆道解剖学“路线图”,并且是进行腹腔镜胆总管探查的第一步技术步骤。
通常,LUS比IOC具有更大的可行性,根据经验,扫描成功率接近100%(表5.1)[12、14、16-25]。报告的故障通常归因于最初的学习曲线或设备故障,而IOC由于无法插入小囊性导管和由于胆囊管结石,瓣膜或曲折导致的造影剂通道阻塞而导致的故障率约为10%。在比较这两种方式的研究中,LUS被一致地证明具有更短的完成时间[12,14,16–23,26]。
常见胆管结石的检测
大量研究评估了LUS和IOC在检测CBD结石方面的相对成功(表5.2)[12、14、16、17、20-25、27]。此外,已经发表了两个荟萃分析,比较了LUS和IOC [26,28]。尽管在这些研究中对每位患者均采用了两种方法,并且将发现进行了比较,但是在评估其结果时必须考虑一些方法学问题。最重要的是,没有黄金标准的考试规范,可以用来比较各自的形态并验证是否真正存在宝石。由于在这种情况下对所有患者进行CBD探查在道德上是不合理的,因此统一假设LUS和IOC的阴性结果均为真实阴性。这种假设可能会低估假阴性检查的次数,因为遗漏的结石可以通过而不会引起症状。这可能是一个很小的风险,因为一些研究报告说,对患者进行了例行随访(范围为6至30个月),并且在两种检查均阴性的情况下,没有遗漏结石。
在大多数研究中,通过手术CBD探查或ERCP对阳性检查(在LUS或IOC上)进行了检查,以确认结果并清除导管。但是,这种方法可能会高估误报的数量,因为术中检测到的CBD结石可能在CBD探索或ERCP时就已经过去了。此外,在大多数研究中,外科医生在不盲目地观看两种检查的情况下,因此在初始结果为阳性的情况下,可能会影响第二项检查的性能和解释(在大多数情况下为IOC)。应当考虑到这些限制来评估可用数据。最后,超声检查是高度依赖操作者的,从而使得研究之间的采集,敏感性,特异性和整体诊断准确性存在差异。
与IOC相比,评估LUS的两项荟萃分析确定了相似的敏感性和特异性。 Jamal等。发现LUS的敏感性和特异性分别为90%和99%,而IOC分别为87%和98%。 Aziz等。发现LUS的敏感性和特异性为87%和100%,而IOC的敏感性和特异性为87%和99%。个别研究表明,检测CBD结石的敏感性对于LUS为71%至100%,对于IOC为75%至100%[12、14、16、17、20-25、27]。仔细研究几个发现LUS不如IOC敏感的系列是有益的。汤普森及其同事发现,LUS的累积敏感性为90%,而IOC的累积敏感性为98%。但是,当作者将其系列细分为三个时间段时,他们发现140例患者的前一组对LUS的敏感性为77%,而后78例和142例患者为100%和96%。这种改善主要是由于在远端CBD的胰腺内部分更好地检测了结石。在第二个患者队列中,作者例行插管胆囊管并注射盐水以扩张CBD。在第三组患者中,只有在初次检查时无法充分观察到远端CBD的情况下,作者才有选择地执行此操作。同样,Falcone等。随着经验的增加,LUS的敏感性得到了改善。在研究之前,基线经验超过10次LUS考试的外科医生比其经验不足的同事更有可能可视化远端CBD:73%对23%。当询问执行LUS的困难程度时,经验丰富的队列更倾向于认为该程序“简单”(71%vs 24%),而认为该过程“困难”(29%vs 60%)的可能性较小。 。
Birth和同事发现LUS的敏感性为83%,而IOC的敏感性为100%。与先前讨论的研究类似,LUS遗漏的所有四块结石均位于远端CBD的壶腹前位置。在通过鼻胃管向胃和十二指肠中注入400毫升生理盐水后,LUS可以看到其中三颗遗漏的结石。但是,作者仍然将它们视为假阴性,因为它们最初被LUS遗漏,只有在执行IOC之后才被发现。这两项研究的结果表明,增加操作员经验和辅助操作以改善远端CBD成像均可将LUS敏感性提高至与IOC相同或更高的水平。但是,外科医生应记住,对远端CBD成像可能是LUS的一个挑战。如果无法清楚地检查胰管内部分,并且怀疑存在CBD结石,则应进行IOC以确认无结石。
尽管这两种方式在CBD结石的检测中都具有很高的特异性,但LUS在这方面优于IOC,假阳性几率几乎为零。尽管很少见,但在IOC期间确实会出现假阳性结果,这主要是由于CBD中的气泡被误认为是石头。因此,一些作者建议在IOC上检测到CBD结石时,使用LUS作为验证性测试。
解剖学检查
通常,IOC比LUS更好地描述了胆道解剖结构。这是因为IOC允许外科医生同时可视化整个胆道树,因此可以确认胆囊管与肝胆总管的关系。相反,LUS一次只能显示一个横截面。因此,必须通过腹腔镜将这些2D图像与其位置相关联,从心理上构建胆道解剖结构的完整视图。这可能具有挑战性,尤其是在严重炎症或解剖结构异常的情况下。一项研究发现,LUS仅能检测出在IOC上发现的82%的解剖异常。另一个结果表明,IOC在14%的病例中显示出不同的解剖结构,但LUS无法将其中任何一个可视化。尽管这些变体中的大多数都在胆囊管-CBD交界处上方的近端胆道树中,但这些发现提醒使用LUS来解释未知或令人困惑的胆道解剖结构。作者的首选是在解剖困难或解剖结构异常使导管关系不确定的情况下使用IOC。
但是,就解剖学检查而言,LUS确实比IOC提供了多个优势。在超声图像上叠加彩色多普勒信号的能力在描绘血管和导管结构方面非常有用。这可以帮助确认动脉解剖结构的变化,例如置换右肝动脉,在解剖肝胆三角时可能会受伤。与IOC相比,LUS还提供了一种更精确的距离测量方法,这对于可靠地确定导管直径,结石大小以及两个解剖结构之间的间隔至关重要。通常,由于造影剂注入后扩张,导管边缘模糊以及在与导管相同的平面上缺乏可靠的参考长度,IOC往往会高估CBD的真实直径。最后,LUS不需要囊性导管插入术,并且可以在整个手术中多次使用。如果在解剖早期不能轻易确定导管结构,这些特征通常使其在严重胆囊炎的情况下对IOC有利。
多项研究已解决了使用常规LUS进行解剖学鉴定是否会导致CBD损伤和其他胆道并发症发生率降低的问题。
与IOC相似,只有间接证据表明这一主张,即使经过20年的辩论和研究,任何一种常规影像学检查方法降低CBD损伤的能力仍存在争议。 Biffl及其同事比较了一家机构的胆道并发症发生率,该机构中两名外科医生常规使用LUS,而其他三名外科医生则选择性地使用IOC。常规的LUS组无胆道并发症,而非LUS外科医生的胆道并发症率为2.5%,其中CBD损伤率为0.8%,CBD结石保留率为0.7%。尽管非LUS外科医生平均进行了更多的手术,但接受急性胆囊炎手术的患者比例却较低,但仍存在这种差异。另一项多中心研究表明,在一系列1381例常规LUS腹腔镜胆囊切除术中,未发生CBD损伤。在这些情况下,使用LUS描绘胆道解剖结构能够防止6%的病例转换为开放手术。此外,作者发现仅在2%的案例中才真正需要补充IOC。
成本
虽然在评估LUS或IOC的使用时应首先考虑患者的安全性和避免胆道并发症,但与这些方式相关的成本是重要的次要考虑因素,尤其是在常规使用时。尽管超声扫描仪的初始购买成本很高,但可以在多个外科专业领域的多种手术中使用。几项研究表明,在每种情况下,LUS比IOC便宜,这主要是由于使用了一次性导管以及IOC期间放射技师的费用。一项研究发现,LUS的平均成本为131美元,而IOC为408美元。作者计算出,即使选择性使用IOC,每次胆囊切除术的平均费用也高达157美元,因此仍比常规LUS昂贵。另一项研究发现,LUS和IOC的每箱成本分别为362美元和665美元,基于此差异,在使用95次后,超声扫描仪本身的成本将可以收回。一项针对常规LUS与常规IOC和预期管理相比的成本效益的最新研究表明,LUS在质量调整生命年(QALY)和每例成本方面均具有优势。根据一次性设备和额外的操作时间对作者自己的数据进行检查后发现,与IOC相比,LUS每箱节省的成本为145美元。
结论
LUS提供了一种在腹腔镜胆囊切除术中检查胆道系统的极好方法,其主要目的是定义解剖关系并检测胆总管结石症。除了实现这些目标之外,LUS还可以使外科医生在进行手术解剖之前和手术过程中观察肝胆三角和肝十二指肠韧带。这样可以更深入地了解这些复杂的解剖结构的通常令人迷惑且潜在危险的二维腹腔镜视图。由于这个原因,作者以常规方式使用LUS,并强调将其用于医学生和外科住院医师的课程中。尽管LUS较IOC具有许多优势,但应将这两种模式视为互补。无论是以常规方式还是选择性方式使用,现代腹腔镜外科医生都必须熟悉这两种技术,以优化患者安全并简化腹腔镜胆囊切除术中CBD结石的检测和治疗。
参考文献
Choledocholithiasis Comprehensive Surgical Management
1.Lane RJ, Coupland GA. Ultrasonic indications to explore the common bile duct. Surgery. 1982;91(3):268–74.
2.Sigel B, Machi J, Beitler JC, Donahue PE, Bombeck CT, Baker RJ, et al. Comparative accu-racy of operative ultrasonography and cholangiography in detecting common duct calculi. Surgery. 1983;94(4):715–20.
3.Jakimowicz JJ, Rutten H, Jurgens PJ, Carol EJ. Comparison of operative ultrasonography and radiography in screening of the common bile duct for calculi. World J Surg. 1987;11(5):628–34.
4.Strasberg SM, Hertl M, Soper NJ. An analysis of the problem of biliary injury during laparo-scopic cholecystectomy. J Am Coll Surg. 1995;180(1):101–25.
5.Hakamada K, Narumi S, Toyoki Y, Nara M, Oohashi M, Miura T, et al. Intraoperative ultrasound as an educational guide for laparoscopic biliary surgery. World J Gastroenterol. 2008;14(15):2370–6. 102 J. M. Jorge and N. J. Soper
6.Soper NJ. The utility of ultrasonography for screening the common bile duct during laparo-scopic cholecystectomy. J Laparoendosc Adv Surg Tech A. 1997;7(5):271–6.
7.Strasberg SM, Brunt LM. Rationale and use of the critical view of safety in laparoscopic cho-lecystectomy. J Am Coll Surg. 2010;211(1):132–8.
8.Perry KA, Myers JA, Deziel DJ. Laparoscopic ultrasound as the primary method for bile duct imaging during cholecystectomy. Surg Endosc. 2008;22(1):208–13.
9.Santambrogio R, Bianchi P, Opocher E, Verga M, Montorsi M. Prevalence and laparoscopic ultrasound patterns of choledocholithiasis and biliary sludge during cholecystectomy. Surg Laparosc Endosc Percutan Tech. 1999;9(2):129–34.
10.Wu JS, Dunnegan DL, Soper NJ. The utility of intracorporeal ultrasonography for screening of the bile duct during laparoscopic cholecystectomy. J Gastrointest Surg. 1998;2(1):50–60.
11.Halpin VJ, Dunnegan D, Soper NJ. Laparoscopic intracorporeal ultrasound versus fluoroscopic intraoperative cholangiography: after the learning curve. Surg Endosc. 2002;16(2):336–41. Epub 2002/04/23
12.Birth M, Ehlers KU, Delinikolas K, Weiser HF. Prospective randomized comparison of laparo-scopic ultrasonography using a flexible-tip ultrasound probe and intraoperative dynamic chol-angiography during laparoscopic cholecystectomy. Surg Endosc. 1998;12(1):30–6.
13.Catheline JM, Turner R, Rizk N, Barrat C, Buenos P, Champault G. Evaluation of the biliary tree during laparoscopic cholecystectomy: laparoscopic ultrasound versus intraoperative chol-angiography: a prospective study of 150 cases. Surg Laparosc Endosc. 1998;8(2):85–91.
14.Machi J, Tateishi T, Oishi AJ, Furumoto NL, Oishi RH, Uchida S, et al. Laparoscopic ultra-sonography versus operative cholangiography during laparoscopic cholecystectomy: review of the literature and a comparison with open intraoperative ultrasonography. J Am Coll Surg. 1999;188(4):360–7.
15.Tomonaga T, Filipi CJ, Lowham A, Martinez T. Laparoscopic intracorporeal ultrasound cystic duct length measurement: a new technique to prevent common bile duct injuries. Surg Endosc. 1999;13(2):183–5.
16.Catheline JM, Turner R, Paries J. Laparoscopic ultrasonography is a complement to cholangi-ography for the detection of choledocholithiasis at laparoscopic cholecystectomy. Br J Surg. 2002;89(10):1235–9.
17.Thompson DM, Arregui ME, Tetik C, Madden MT, Wegener M. A comparison of laparoscopic ultrasound with digital fluorocholangiography for detecting choledocholithiasis during laparo-scopic cholecystectomy. Surg Endosc. 1998;12(7):929–32.
18.Falcone RA Jr, Fegelman EJ, Nussbaum MS, Brown DL, Bebbe TM, Merhar GL, et al. A prospective comparison of laparoscopic ultrasound vs intraoperative cholangiogram during laparoscopic cholecystectomy. Surg Endosc. 1999;13(8):784–8.
19.Rijna H, Eijsbouts QA, Barkhof F, de Brauw LM, Cuesta MA. Assessment of the biliary tract by ultrasonography and cholangiography during laparoscopic cholecystectomy: a prospective study. Eur J Ultrasound. 1999;9(2):127–33.
20.Rthlin MA, Schb O, Schlumpf R, Largiadèr F. Laparoscopic ultrasonography during chole-cystectomy. Br J Surg. 1996;83:1512–6.
21.Li JW, Feng B, Wu L, Wang ML, Lu AG, Zang L, et al. Intraoperative cholangiography and laparoscopic ultrasonography are complementary in the detection of occult choledocholithia-sis. Med Sci Monit. 2009;15(9):126–30.
22.Barteau JA, Castro D, Arregui ME, Tetik C. A comparison of intraoperative ultrasound versus cholangiography in the evaluation of the common bile duct during laparoscopic cholecystec-tomy. Surg Endosc. 1995;9(5):490–6.
23.Tranter SE, Thompson MH. A prospective single-blinded controlled study comparing lapa-roscopic ultrasound of the common bile duct with operative cholangiography. Surg Endosc. 2003;17(2):216–9.
24.Siperstein A, Pearl J, Macho J, Hansen P, Gitomirsky A, Rogers S. Comparison of laparoscopic ultrasonography and fluorocholangiography in 300 patients undergoing laparoscopic chole-cystectomy. Surg Endosc. 1999;13(2):113–7.
25.Greig JD, John TG, Mahadaven M, Garden OJ. Laparoscopic ultrasonography in the evalua-tion of the biliary tree during laparoscopic cholecystectomy. Br J Surg. 1994;81:1202–6.
26.Jamal KN, Smith H, Ratnasingham K, Siddiqui MR, McLachlan G, Belgaumkar AP. Meta-- analysis of the diagnostic accuracy of laparoscopic ultrasonography and intraoperative cholan-giography in detection of common bile duct stones. Ann R Coll Surg Engl. 2016;98(4):244–9.
27.Goletti O, Buccianti P, Ferrari M, Celona G, Chiarugi M, Cavina E. Laparoscopic sonog-raphy: a real alternative to cholangiography during laparoscopic cholecystectomy? Hepato-- Gastroenterology. 1995;42(5):612–8.
28.Aziz O, Ashrafian H, Jones C, Harling L, Kumar S, Garas G, Holme T, Darzi A, Zacharakis E, Athanasiou T. Laparoscopic ultrasonography versus intra-operative cholangiogram for the detection of common bile duct stones during laparoscopic cholecystectomy: a meta-analysis of diagnostic accuracy. Int J Surg. 2014;12(7):712–9.
29.Kimura T, Umehara Y, Yoshida M, Sakuramachi S, Kawabe A, Suzuki K. Laparoscopic ultra-sonography and operative cholangiography prevent residual common bile duct stones in lapa-roscopic cholecystectomy. Surg Laparosc Endosc Percutan Tech. 1999;9(2):124–8.
30.Rothlin M, Largiader F. The anatomy of the hepatoduodenal ligament in laparoscopic sonog-raphy. Surg Endosc. 1994;8(3):173–80.
31.Teefey SA, Soper NJ, Middleton WD, Balfe DM, Brink JA, Strasberg SM, et al. Imaging of the common bile duct during laparoscopic cholecystectomy: sonography versus videofluoroscopic cholangiography. AJR Am J Roentgenol. 1995;165(4):847–51.
32.Pfluke JM, Bowers SP Jr. Laparoscopic intraoperative biliary ultrasonography: findings during laparoscopic cholecystectomy for acute disease. J Laparoendosc Adv Surg Tech A. 2011;21(6):505–9.
33.Biffl WL, Moore EE, Offner PJ, Franciose RJ, Burch JM. Routine intraoperative laparoscopic ultrasonography with selective cholangiography reduces bile duct complications during lapa-roscopic cholecystectomy. J Am Coll Surg. 2001;193(3):272–80.
34.Machi J, Johnson JO, Deziel DJ, Soper NJ, Berber E, Siperstein A, et al. The routine use of laparoscopic ultrasound decreases bile duct injury: a multicenter study. Surg Endosc. 2009;23(2):384–8.
35.Machi J, Oishi AJ, Tajiri T, Murayama KM, Furumoto NL, Oishi RH. Routine laparoscopic ultrasound can significantly reduce the need for selective intraoperative cholangiography dur-ing cholecystectomy. Surg Endosc. 2007;21(2):270–4.
36.Sun SX, Kulaylat AN, Hollenbeak CS, Soybel DI. Cost-effective decisions in detect-ing silent common bile duct gallstones during laparoscopic cholecystectomy. Ann Surg. 2016;263(6):1164–72. |