介绍
胆总管结石的发生率从选择性胆囊切除术病例的5%左右到急诊病例的20%不等,并且随着年龄的增加而增加[1-4]。鉴于此,欧洲内窥镜手术协会(EAES)建议对所有患有胆石症的患者进行胆总管性胆石症的调查。胆总管结石的临床表现可能从无症状性结石(胆管影像学偶然发现)到胆绞痛以及急性,危及生命的疾病如急性胆管炎和胆结石性胰腺炎。与胆总管结石相关的并发症是医疗服务的主要负担。在作者所在的机构中,外科医生在胆总管结石患者的分类,评估和管理中起主要作用。这种实践模型的结构已经很好地建立,将为读者进行描述。此外,本章还将介绍一种安全,经济高效且广泛适用的CBD结石病治疗方法。
本章中的讨论将主要集中在由CBD结石引起的综合征患者的检查和管理上。急性胰腺炎(AP),胆管炎和黄疸的恶性原因在本章中并不重要,尽管对于外科医生而言,认识到胆道良性和恶性疾病的表现可能存在很大的重叠是很重要的。简短的部分将描述警告标志,这些警告标志应促使外科医生考虑是恶性病因,而不是普通的导管结石是造成患者表现的根本原因。
专业胆道公司的实践模型
在作者的机构中,所有诊断为或疑似急性胆道疾病的患者都被转介到负责处理胆结石疾病的唯一胆道外科专家公司。所有推荐都经过分类,并经过审查以确定其紧急程度。胆道公司的专职外科医生负责指导新患者的评估和管理。
在回顾了胆结石病患者的既往结果后,建立了由一家手术公司负责胆道急症患者的评估和管理的共识方法。建立该协议是为了简化此类患者的护理。在采用这种方法之前,怀疑胆管结石的患者通常要进行两次手术(内镜处理,然后进行胆囊切除术)。一些患者接受了阴性的内镜逆行胰胆管造影(ERCP),使他们面临无益的风险。此外,术前内镜管理会延迟手术评估,患者需要等待更长的时间才能进行明确的手术治疗。在与内科医生,肠胃科医生和外科医生讨论后,制定了一种护理胆道患者的新方法。原则上同意,未经专业胆道公司的外科医生对患者的病例进行审查或讨论,不得进行内镜干预。新方法的目标是通过为每位患者选择最佳治疗方法来减少住院时间和再入院时间,包括在适当的时候在入院时进行明确的手术。这种方法帮助作者确定了最适合立即进行主要外科手术的患者,而不是那些经过初始内镜治疗或需要进一步无创胆管成像的患者。
在作者的机构中,常规的术中胆道造影术用于识别CBD结石,从而有助于大多数患者的诊断算法。术中胆管成像的发现指导进一步腹腔镜治疗胆管结石。胆道急诊有专门的手术室时间,以方便安排患者。大量急诊胆道病例也为作者的受训人员提供了绝佳的机会,帮助他们发展胆管成像和腹腔镜胆管探查技能。
胆绞痛或急性胆囊炎
表现为胆源性疼痛的患者应接受病史和身体检查。除了询问主要主诉外,重要的是询问黄疸,尿色暗淡和尿样粪便的发作情况,以及确定患者是否经历了意外体重减轻,因为这些症状会引起人们对常见症状的怀疑。导管结石或可能的恶性肿瘤(尤其是体重减轻的情况)。患者应接受实验室检查,包括全血细胞计数(CBC),肝功能检查(LFT)和淀粉酶/脂肪酶检查,并应进行胆囊超声检查。一旦确认了胆结石的诊断,通常可以根据胆结石疾病综合征之一(例如,胆绞痛,胆囊炎,胰腺炎等)对患者进行分类。对于大多数稳定的胆绞痛或胆囊炎患者,可通过腹腔镜胆囊切除术(LC)进行术中影像学检查和胆管探查(如有必要)进行治疗(图3.1)。当胆管探查失败或外科医生不执行此手术时,应选择开放性胆总管探查术或术后ERCP术,或不将胆道支架置入乳头内。在ERCP术后放置胆道支架有助于胆管插管。就结局而言,与两阶段治疗(ERCP加胆囊切除术)相比,单阶段方法已被描述具有相同的疗效和安全性,但住院时间和费用更短[6-11]。不幸的是,单阶段方法未能获得更广泛的接受,尽管有文献报道胆管造影的敏感性(97%)和特异性(99%),但它在外科手术中的使用率也有所下降[12-18] 。这些外科导管清除术和胆道造影术的技术取决于用户,并且随着经验的增加而提高。因此,必须让受训人员接触这些技术以发展专业知识,并且外科医生必须继续进行胆管造影以保持这些技能。即使外科医生仅进行胆管造影(而不是普通的导管探查),对于按照美国胃肠内镜协会(ASGE)准则具有中等风险的患者,手术优先采用手术优先的策略也要优于两阶段管理首先,患者住院时间较短,而其他普通导管检查较少(内镜超声,ERCP或磁共振胆管胰胰腺造影[MRCP])。
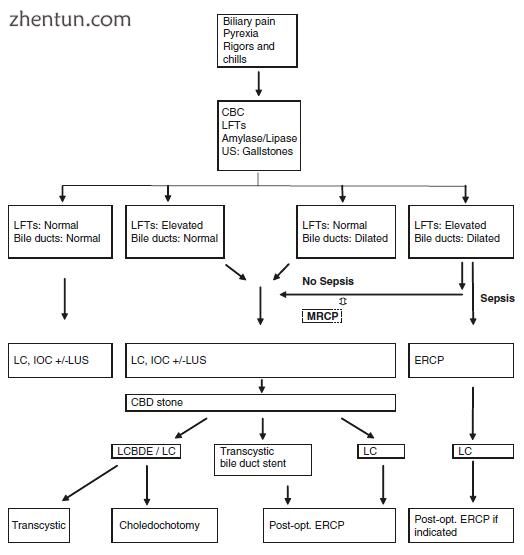
图3.1诊断和处理可疑胆总管结石的途径。 LFTs肝功能检查,CBC全血细胞计数,US超声扫描,LC腹腔镜胆囊切除术,IOC术中胆道造影,MRCP磁共振胆胰管造影,ERCP内镜逆行胰胆管造影,LCBDE腹腔镜胆总管探查术,LUS腹腔镜超声检查
胆结石性胰腺炎
介绍
胆结石占急性胰腺炎病例的35.75%[6-8]。胆结石相关的胰腺炎是由于结石从胆囊经胆囊管进入胆总管或很少在胆总管内重新形成结石而引起的。在这两种情况下,瓦特壶腹的水平处都有阻塞,这会导致急性胰腺炎。
怀疑诊断为急性胰腺炎的患者应接受实验室检查,包括CBC,包括LFT在内的完整代谢检测以及淀粉酶/脂肪酶。应该命令右上腹超声检查是否存在胆结石,如果没有其他原因引起的胰腺炎,则将其暗示为可能的病因。胰腺炎的严重程度应使用许多众所周知的评分系统(在第2章中介绍)中的任何一种来确定,并建立超支持性护理。临床改善,临床状况恶化或诊断不确定的患者应通过对比增强计算机断层扫描(CT)进行进一步评估,以确定是否还有其他并发症,例如急性液体收集,胰腺坏死或胰腺周围并发症(例如静脉)血栓形成或假性动脉瘤形成。
轻度至中度胰腺炎
大多数患者将患有轻度或中度胰腺炎,通过支持治疗可迅速改善。这些患者在发作缓解后应在同一住院期间接受胆囊切除术(图3.2),因为如果没有进行胆囊切除术,则25%的患者继续发生胰腺炎的复发发作,并可能导致明显的发病率,甚至导致死亡。约有10%的病例[20-23]。为患者提供及时的胆囊切除术很重要,因为在反复发作的患者中,有23.3%的患者在上次发作后30天内复发。在荷兰的一项前瞻性,多中心,随机对照试验(PONCHO试验)中,比较了同期入院的胆囊切除术与间隔胆囊切除术(30天后)的比较,结果显示胆囊切除术与胆囊结石相关并发症的风险降低(5%比17%)。相比间隔胆囊切除术。早期胆囊切除术也已被证明具有成本效益,并减少了再次入院[12,26,27]。在不适合手术的患者中,与仅在2年观察时的观察结果(17.1%)相比,ERCP括约肌切开术在降低复发性胰腺炎的风险(8.2%)方面已显示出优势,因此值得推荐。尽管有这些数据和指南建议对胆结石性胰腺炎患者在同一次入院时进行手术,但医学界在确保患者接受推荐治疗方面依从性仍然较差[29-33]。例如,对美国Medicare患者的一项研究显示,只有57%的患者实际接受了相同准入的胆囊切除术,而从未接受过胆囊切除术的患者中,有55%的患者从未接受过外科医生的评估,只有28%接受ERCP降低风险的人。在作者的机构中,患者接受常规手术中胆管造影术的同等入院胆囊切除术。如果患者在同一次入院期间拒绝接受手术,则应计划在2周内进行间隔性胆囊切除术和术中胆管成像,以减少复发的机会。
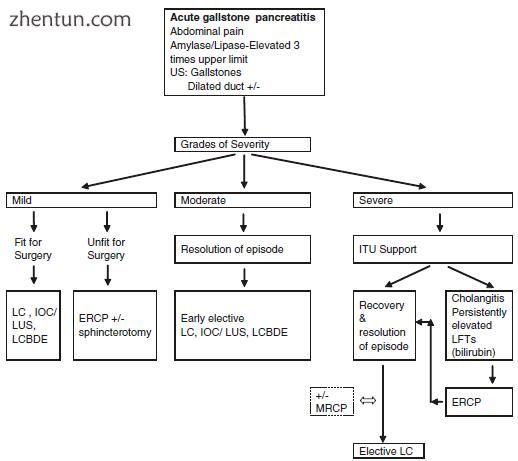
图3.2急性胆结石相关性胰腺炎的诊断和处理。US超声扫描,LFTs肝功能检查,国际电联强化治疗单位,ERCP内镜逆行胰胆管造影术,LC腹腔镜胆囊切除术,IOC术中胆道造影,LCBDE腹腔镜胆总管探查术,LUS腹腔镜超声检查,MRCP磁共振胰胆管造影
严重或并发胰腺炎
重症胰腺炎患者需要加护病房(ICU)支持,不适合立即手术(图3.2)。对于重症急性胰腺炎,胰腺坏死或大量胰周收集的患者,建议在考虑进行胆囊切除术之前至少延迟6周,因为早期干预可能会导致败血症并发症和感染的胰周液收集的发生率更高[29, 35]。
磁共振胰胆管造影
MRCP在胆结石性胰腺炎患者护理中的作用应受到限制,因为它会增加不必要的费用并延误护理时间。在像作者这样的由术者进行术中影像检查的中心,常规的术前MRCP没有作用[19,36,37]。它的使用应仅限于存在诊断不确定性的情况或不进行术中影像检查以确定哪些患者应接受治疗性ERCP的中心。
内镜逆行胰胆管造影的作用
同样,ERCP在胆结石性胰腺炎患者护理中的作用应受到限制,如果考虑到疾病的自然病史,则最好予以了解。在大多数情况下,胆结石会自发通过Vater壶腹,几乎50%的患者在症状发作后24小时内就通过了结石。因此,不建议在未发生急性胰腺炎的情况下进行常规术前ERCP,因为这会增加费用,延长住院时间并可能有害。术前唯一应使用ERCP的情况是重度胆结石诱发的胰腺炎,肝功能检查受阻或紊乱或胆管炎[29,40,41]。术中ERCP被描述为当外科医生对执行中的胆总管探查感到不舒服时的一种选择,但是由于其后勤方面的挑战而获得较少的普及。术后ERCP是一个很好的挽救选择,最适合术中影像学检查阳性且胆管扩张无法进行或失败的患者。
急性胆管炎
胆总管结石是急性胆管炎的常见原因,占病例的28–70%[41–43]。急性胆管炎的诊断应基于诸如右上腹疼痛,发烧和黄疸(查科特三联征)这样的主诉,即使该三联征可能只出现在50-75%的病例中。患者应接受包括CBC在内的实验室研究,以及包括LFT,C反应蛋白(CRP)在内的综合代谢研究,凝血研究以及胆道成像。超声检查是评估胆囊和胆管的很好的初始检查方法,尽管它对常见的胆管结石不是很敏感,但它可以显示间接的胆道阻塞征象,例如扩张的胆管。 《东京指南》(在第2章中讨论)基于该初步检查的结果提供了胆管炎的具体诊断标准和严重程度分类[44,45]。除非怀疑有恶性肿瘤或诊断不确定性,否则通常无需进行其他影像学检查,例如MRCP或CT。
图3.3中描述的途径为急性胆管炎患者的治疗提供了一般指导,并且主要基于急性胆管炎的严重程度。大多数患者将对最初的抗生素治疗和其他辅助措施产生反应,但最终的病因(胆总管结石)最终需要解决。这些患者的护理的两个目标是清除结石的胆管并清除结石的来源:胆囊。
选修LC
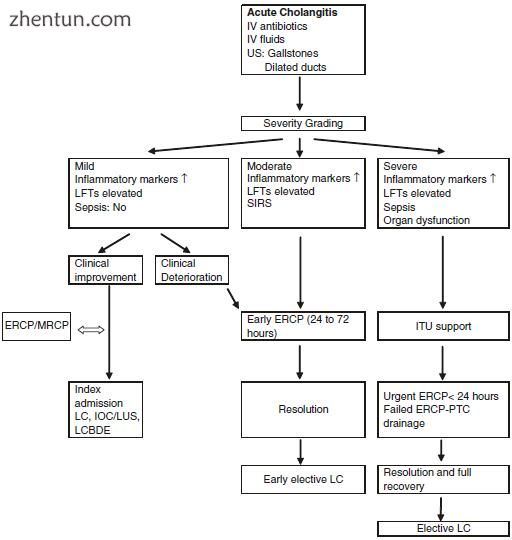
图3.3疾病严重程度指导胆结石相关性急性胆管炎患者的治疗。静脉注射,超声检查,LFTs肝功能检查,SIRS全身炎症反应综合征,ERCP内镜逆行胰胆管造影,ITU强化治疗单位,LC腹腔镜胆囊切除术,IOC术中胆道造影,LCBDE腹腔镜胆总管探查术,PTC经皮肝穿刺术胆管造影,LUS腹腔镜超声检查,SIRS严重炎症反应综合征
轻度胆管炎
大多数轻度胆管炎患者将在支持治疗下得到临床改善,应在同一住院期间接受胆囊切除术并进行术中影像检查(必要时进行胆管探查)。在没有胆管探查或术中成像功能的医院中,术前ERCP(有或没有MRCP)清除胆道树,然后进行胆囊切除术是合理的选择。与胆结石性胰腺炎一样,间隔性胆囊切除术很重要,如果患者有适当的手术风险,应行间隔胆囊切除术。长期不进行胆囊切除术且仅接受内镜括约肌切开术的患者有再发胆汁性疾病进一步发作,恢复和增加死亡率的风险[23,46]。
中度至重度胆管炎
对于中度至重度急性胆管炎患者,ERCP是首选治疗方法,因为这些患者可能具有血流动力学不稳定和败血症,因此很不适合进行手术。进行紧急(<24小时)或早期(<72小时)内镜减压的必要性应取决于疾病的严重程度,患者的反应以及当地资源的可用性。患有严重疾病且需要器官支持且对静脉抗生素的反应失败的患者将需要紧急(<24小时)胆道减压[48,49]。在这组患者中,如果不立即进行胆汁引流,结局将大大恶化。同样,中度胆管炎患者在24小时后仍无改善,需要早期(<72小时)内镜下胆管减压术[47-49]。
内镜减压的替代方法
对于未能通过ERCP或无法进行ERCP的患者(例如,无法插管,不稳定的患者,因胃旁路术而改变的解剖结构,食管狭窄,胃出口梗阻等),经皮肝穿刺胆管造影(PTC) )是打捞选项。 ERCP和PTC均可用于结石摘除和支架放置。但是,通过PTC进行结石的成功性不如ERCP,因此可能需要反复尝试以清理管道。尽管如此,即使仅通过PTC即可实现减压,这也足以使患者稳定下来,并且可以采用组合式结扎方法,其中导线通过PTC引流管进入十二指肠,以帮助通过ERCP插管。当ERCP和PTC均无法实现胆道减压时,内镜超声(EUS)引导的经肠胆道引流术也是一种替代方法,但是目前只有少数几个中心在进行此项技术[51,52]。胆道外科手术引流是最后的选择,因为它会增加发病率和死亡率,而且鉴于ERCP或PTC的可用性,如今很少需要这样做。如果在病情稳定的情况下,在没有进行ERCP或PTC的设施的医院中照顾严重胆管炎患者的医生应考虑将其转移到具有这些功能的区域专科病房。
间隔性胆囊切除术
内镜清除成功的中度至重度胆管炎患者应最终行胆囊切除术,以减少复发问题的风险。间隔性胆囊切除术的时机尚不清楚,但建议行内镜下括约肌切开术后至少1周至最多6周[23,54,55]。已经确定这种方法可以减少发病率和住院时间[23,54]。具有多系统器官并发症的患者应等到完全康复后再考虑进行择期手术。
解剖结构改变患者的胆石症治疗
解剖改变的患者(例如,Roux-en-Y胃旁路术(RYGB)或Billroth II重建术后)的胆总管结石的处理既是诊断又是治疗上的挑战。尽管RYGB后胆总管胆囊炎的估计比率可能仅为0.4%,但从头胆囊结石形成的比率约为40%,并且随着减肥手术的利用不断增加,普通外科医师现在已经发现其中许多患者为胆道疾病投诉。在解剖结构改变的患者中,Roux肢或传入肢的长度限制了传统内窥镜进入胆道的通道,如果没有先进的技术(例如球囊肠镜或手术辅助通路),则很难或不可能进行ERCP [57,58]。
出现胆道症状的患者应与任何先前提到的胆道患者(病史和体格检查,实验室检查和超声检查)具有相同的初始评估。在对这些患者进行初次评估时也应考虑MRCP,因为它可以在诊断不确定的情况下提供帮助,并有助于计划干预措施(例如,确保在需要时提供ERCP)。
胆囊原位患者
如前所述,应根据每种临床综合征的适当算法,对仍在原位的胆囊患者进行治疗(图3.4)。对于需要紧急胆道引流的血流动力学不稳定的患者,应考虑采用PTC,外科辅助ERCP或通过通用导管探查进行外科引流(如果有专业知识)。如果认为患者适合进行胆囊切除术,则应考虑一些其他考虑因素来计划手术。最简单的情况是,如果外科医生进行常规的术中影像检查,并且在必要时能够进行普通导管探查;这些病例可以直接进行手术。如果外科医生不进行普通导管探查,但能够进行术中影像检查,则应确定术前胆总管结石的风险(基于临床,实验室和超声检查结果)。如果风险较低,则外科医生应进行术中影像学检查。在不太可能发生的术中影像学检查为阳性的情况下,如果可行,可以进行术中ERCP。如果无法立即获得ERCP,则外科医生可能会放置胃造口管以进行ERCP间隔治疗(在先前的胃旁路手术的情况下),或者外科医生可能会选择关闭并计划间隔腹腔镜辅助的ERCP。如果无法获得术中影像,或者怀疑有可能存在胆总管结石,则可以进行术前MRCP(如果尚未完成),如果胆囊切除术可以制定手术辅助的ERCP计划。
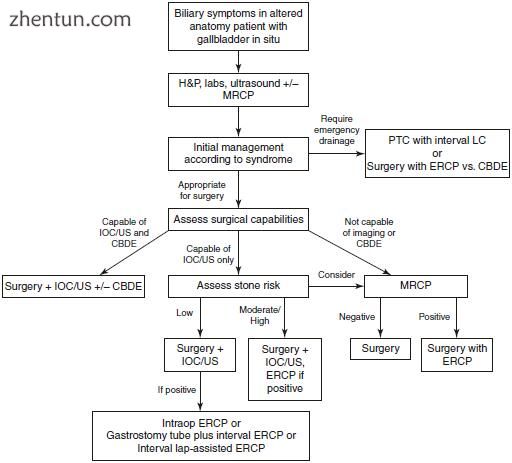
图3.4解剖结构改变,原位怀疑CBD结石和胆囊的患者的处理H&P历史和体格检查,US超声,CBDE胆总管探查,PTC经皮肝穿刺胆道造影,MRCP磁共振胆胰管造影,LC腹腔镜胆囊切除术,ERCP内镜逆行胰胆管造影,IOC术中胆管造影
曾进行过胆囊切除术的患者
有先前胆囊切除术史的患者应根据临床综合征进行相同的初始评估和处理(图3.5)。需要紧急引流的患者可以进行PTC或外科辅助ERCP或普通导管探查(如果无法获得)。稳定且影像学阳性的患者可能会进行各种治疗,包括手术辅助的ERCP,经皮穿刺肝穿石取石,胆总管探查,内镜超声引导下的提取或其他混合技术,这些方法均获得了不同程度的成功[59– 62]。当前,没有关于最佳方法的指导或建议。这些复杂患者的管理决定必须个性化,并且可能需要综合的多学科团队讨论,同时要考虑当前的具体问题,患者的临床状况以及可用的专业知识和资源。对于这些复杂的患者,应考虑咨询或转诊至专科中心。
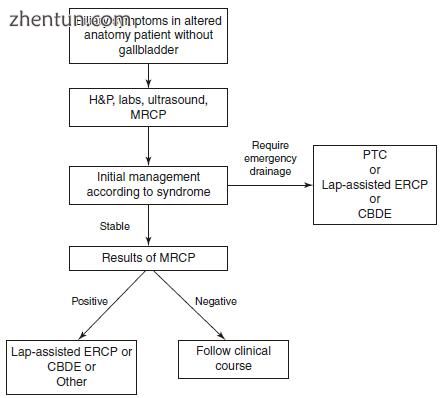
图3.5有先前胆囊切除史的可疑CBD结石的解剖结构改变患者的处理。 H&P病史和体格检查,CBDE胆总管造影,PTC经皮经肝胆管造影,MRCP磁共振胆胰管造影,ERCP内镜逆行胰胆管造影
黄疸和疑似恶性肿瘤
有黄疸(无典型的胆道疼痛症状),体重减轻或怀疑存在恶性肿瘤的患者应进行彻底调查。区分黄疸的医学原因和手术原因以启动适当的治疗很重要。所有患者均应进行如图3.6所示的常规检查,包括右上腹超声检查以及腹部和骨盆的CT扫描。如果在最初的影像学检查中未发现原因,为了进一步评估黄疸情况下的胆道解剖,应进行MRCP。当上述研究尚无定论或进一步评估黄疸,病因不明的胆道扩张或需要检查胰腺时,内镜超声检查和/或ERCP很有用[65,66]。鉴于恶性或黄疸患者需要进行复杂的评估和决策,英国的大多数医院都在实施专门的黄疸途径。这涉及初级保健医师,放射科医生,肠胃科医生和外科医生的共同努力,以完成调查,确定诊断并以快速的方式开始治疗[67-69]。
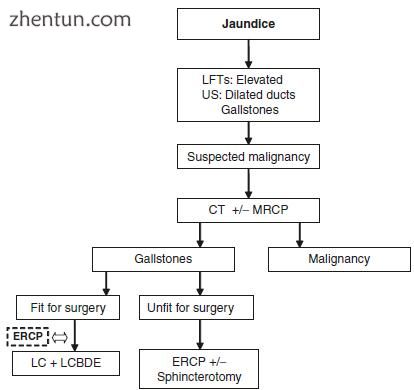
图3.6黄疸患者的诊断和处理。US超声扫描,LFTs肝功能检查,CT计算机断层扫描,MRCP磁共振胰胆管造影,ERCP内镜逆行胰胆管造影,LC腹腔镜胆囊切除术,LCBDE腹腔镜胆总管探查
摘要/重点
胆总管结石的管理既是诊断又是治疗上的挑战。
单纯性胆石性胰腺炎患者无需常规术前ERCP。
急性重症胰腺炎患者一旦完全康复,应考虑进行手术。
急性重症胆管炎应在24小时内进行紧急ERCP,以提高发病率并降低死亡率。
解剖结构改变的患者的胆总管结石的处理非常复杂,通常需要多学科的讨论和协调。
所有黄疸或怀疑有恶性肿瘤的患者都应进行彻底检查,以查明潜在的病理并适当地进行治疗。
参考文献
Choledocholithiasis Comprehensive Surgical Management
1.Collins C, Maguire D, Ireland A, Fitzgerald E, O’Sullivan GC. A prospective study of com-mon bile duct calculi in patients undergoing laparoscopic cholecystectomy: natural history of choledocholithiasis revisited. Ann Surg. 2004;239(1):28–33.
2.Hunter JG. Laparoscopic transcystic common bile duct exploration. Am J Surg. 1992;163(1):53– 6. discussion 57–58
3.Petelin JB. Laparoscopic common bile duct exploration. Surg Endosc. 2003;17(11):1705–15.
4.Shojaiefard A, Esmaeilzadeh M, Ghafouri A, Mehrabi A. Various techniques for the sur-gical treatment of common bile duct stones: a meta review. Gastroenterol Res Pract. 2009;2009:840208.
5.Martin CJ, Cox MR, Vaccaro L. Laparoscopic transcystic bile duct stenting in the management of common bile duct stones. ANZ J Surg. 2002;72(4):258–64.
6.Cuschieri A, Lezoche E , Morino M , Croce E, Lacy A, Toouli J, Faggioni A, , Ribeiro VM, Jakimowicz J, Visa J, Hanna GB.. E.A.E.S. multicenter prospective randomized trial compar-ing two-stage vs single-stage management of patients with gallstone disease and ductal calculi. Surg Endosc 1999;13(10):952-957.
7.Bansal VK, Misra MC, Rajan K, Kilambi R, Kumar S, Krishna A, Kumar A, Pandav CS, Subramaniam R, Arora MK, Garg PK. Single-stage laparoscopic common bile duct explora-tion and cholecystectomy versus two-stage endoscopic stone extraction followed by laparo-scopic cholecystectomy for patients with concomitant gallbladder stones and common bile duct stones: a randomized controlled trial. Surg Endosc. 2014;28(3):875–85.
8.Rogers SJ, Cello JP, Horn JK, Siperstein AE, Schecter WP, Campbell AR, Mackersie RC, Rodas A, Kreuwel HT, Harris HW. Prospective randomized trial of LC + LCBDE vs ERCP/ S+LC for common bile duct stone disease. Arch Surg. 2010;145:28–33.
9.Koc B, Karahan S, Adas G, Tutal F, Guven H, Ozsoy A. Comparison of laparoscopic com-mon bile duct exploration and endoscopic retrograde cholangiopancreatography plus laparo-scopic cholecystectomy for choledocholithiasis: a prospective randomized study. Am J Surg. 2013;206:457–63.
10.Noble H, Tranter S, Chesworth T, Norton S, Thompson M. A randomized, clinical trial to com-pare endoscopic sphincterotomy and subsequent laparoscopic cholecystectomy with -primary laparoscopic bile duct exploration during cholecystectomy in higher risk patients with cho-ledocholithiasis. J Laparoendosc Adv Surg Tech A. 2009;19:713–20.
11.Rhodes M, Sussman L, Cohen L, Lewis MP. Randomised trial of laparoscopic exploration of common bile duct versus postoperative endoscopic retrograde cholangiography for common bile duct stones. Lancet. 1998;351:159–61.
12.Isla A, Griniatsos J, Rodway A. Single-stage definitive laparoscopic management in mild acute biliary pancreatitis. J Laparoendosc Adv Surg Tech A. 2003;13(2):77–81.
13.Banks PA, Bollen TL, Dervenis C, Gooszen HG, Johnson CD, Sarr MG, et al. Classification of acute pancreatitis--2012: revision of the Atlanta classification and definitions by international consensus. Gut. 2013;62(1):102–11.
14.Ito K, Ito H, Whang EE. Timing of cholecystectomy for biliary pancreatitis: do the data sup-port current guidelines? J Gastrointest Surg. 2008;12(12):2164–70.
15.Kharbutli B, Velanovich V. Management of preoperatively suspected choledocholithiasis: a decision analysis. J Gastrointest Surg. 2008;12(11):1973–80.
16.Kimura Y, Arata S, Takada T, Hirata K, Yoshida M, Mayumi T, et al. Gallstone-induced acute pancreatitis. J Hepatobiliary Pancreat Sci. 2010;17(1):60–9.
17.Iranmanesh P, Frossard JL, Mugnier-Konrad B, Morel P, Majno P, Nguyen-Tang T, et al. Initial cholecystectomy vs sequential common duct endoscopic assessment and subsequent cholecystectomy for suspected gallstone migration: a randomized clinical trial. JAMA. 2014;312(2):137–44.
18.Altieri MS, Yang J, Obeid N, Zhu C, Talamini M, Pryor A. Increasing bile duct injury and decreasing utilization of intraoperative cholangiogram and common bile duct exploration over 14 years: an analysis of outcomes in New York State. Surg Endosc. 2017;32(2):667–74. //doi.org/10.1007/s00464-017-5719-2.
19.Nassar AH, Mirza A, Qandeel H, Ahmed Z, Zino S. Fluorocholangiography: Reincarnation in the laparoscopic era-evaluation of intra-operative cholangiography in 3635 laparoscopic cholecystectomies. Surg Endosc. 2016;30(5):1804–11.
20.Cameron DR, Goodman AJ. Delayed cholecystectomy for gallstone pancreatitis: re--admissions and outcomes. Ann R Coll Surg Engl. 2004;86(5):358–62.
21.Sandzen B, Rosenmuller M, Haapamaki MM, Nilsson E, Stenlund HC, Oman M. First attack of acute pancreatitis in sweden 1988 - 2003: incidence, aetiological classification, procedures and mortality - a register study. BMC Gastroenterol. 2009;9:18.
22.Moreau JA, Zinsmeister AR, Melton LJ 3rd, DiMagno EP. Gallstone pancreatitis and the effect of cholecystectomy: a population-based cohort study. Mayo Clin Proc. 1988;63(5):466–73.
23.McAlister VC, Davenport E, Renouf E. Cholecystectomy deferral in patients with endoscopic sphincterotomy. Cochrane Database Syst Rev. 2007;4:CD006233.
24.Hernandez V, Pascual I, Almela P, Anon R, Herreros B, Sanchiz V, Minguez M, Benages A. Recurrence of acute gallstone pancreatitis and relationship with cholecystectomy or endo-scopic sphincterotomy. Am J Gastroenterol. 2004;99(12):2417–23.
25.da Costa DW, Bouwense SA, Schepers NJ, Besselink MG, van Santvoort HC, van Brunschot S, Dutch Pancreatitis Study Group, et al. Same-admission versus interval cholecystectomy for mild gallstone pancreatitis (PONCHO): a multicentre randomised controlled trial. Lancet. 2015;386(10000):1261–8.
26.Targarona EM, Balague C, Espert JJ, Perez Ayuso RM, Ros E, Navarro S, et al. Laparoscopic treatment of acute biliary pancreatitis. Int Surg. 1995;80(4):365–8.
27.Stromberg C, Nilsson M. Nationwide study of the treatment of common bile duct stones in sweden between 1965 and 2009. Br J Surg. 2011;98(12):1766–74.
28.Hwang SS, Li BH, Haigh PI. Gallstone pancreatitis without cholecystectomy. JAMA Surg. 2013;148(9):867–72.
29.Working Group IAP/APA Acute Pancreatitis Guidelines. IAP/APA evidence-based guidelines for the management of acute pancreatitis. Pancreatology. 2013;13(4 Suppl 2):e1–15.
30.Anonymous. UK guidelines for the management of acute pancreatitis. Gut. 2005;54 (Suppl 3):iii1–9.
31.Forsmark CE, Baillie J. AGA Institute technical review on acute pancreatitis. Rev Gastroenterol Mex. 2007;72(3):257–85.
32.Uhl W, Warshaw A, Imrie C, Bassi C, McKay CJ, Lankisch PG, et al. IAP guidelines for the surgical management of acute pancreatitis. Pancreatology. 2002;2(6):565–73.
33.Kimura Y, Takada T, Kawarada Y, Hirata K, Mayumi T, Yoshida M, et al. JPN guidelines for the management of acute pancreatitis: treatment of gallstone-induced acute pancreatitis. J Hepato-Biliary-Pancreat Surg. 2006;13(1):56–60.
34.Trust MD, Sheffield KM, Boyd CA, Benarroch-Gampel J, Zhang D, Townsend CM Jr, Riall TS. Gallstone pancreatitis in older patients: are we operating enough? Surgery. 2011;150(3):515–25.
35.Nealon WH, Bawduniak J, Walser EM. Appropriate timing of cholecystectomy in patients who present with moderate to severe gallstone-associated acute pancreatitis with peripancre-atic fluid collections. Ann Surg. 2004;239(6):741–9. discussion 749–751
36.Hanif F, Ahmed Z, Samie MA, Nassar AH. Laparoscopic transcystic bile duct exploration: The treatment of first choice for common bile duct stones. Surg Endosc. 2010;24(7):1552–6.
37.Gough V, Stephens N, Ahmed Z, Nassar AH. Intrahepatic choledochoscopy during trans-- cystic common bile duct exploration; technique, feasibility and value. Surg Endosc. 2012;26(11):3190–4.
38.Darge K, Anupindi S. Pancreatitis and the role of US, MRCP and ERCP. Pediatr Radiol. 2009;39(Suppl 2):S153–7.
39.Uhl W, Muller CA, Krahenbuhl L, Schmid SW, Scholzel S, Buchler MW. Acute gallstone pancreatitis: timing of laparoscopic cholecystectomy in mild and severe disease. Surg Endosc. 1999;13(11):1070–6.
40.Folsch UR, Nitsche R, Ludtke R, Hilgers RA, Creutzfeldt W. Early ERCP and papillotomy compared with conservative treatment for acute biliary pancreatitis. The German Study Group on Acute Biliary Pancreatitis. N Engl J Med. 1997;336(4):237–42.
41.van Santvoort HC, Besselink MG, de Vries AC, Boermeester MA, Fischer K, Bollen TL, et al. Early endoscopic retrograde cholangiopancreatography in predicted severe acute biliary pan-creatitis: a prospective multicenter study. Ann Surg. 2009;250(1):68–75.
42.Saik RP, Greenburg AG, Farris JM, Peskin GW. Spectrum of cholangitis. Am J Surg. 1975;130(2):143–50.
43.Huibregtse K, Carr-Locke DL, Cremer M, Domschke W, Fockens P, Foerster E, et al. Biliary stent occlusion--a problem solved with self-expanding metal stents? European Wallstent Study Group. Endoscopy. 1992;24(5):391–4.
44.Okamoto K, Takada T, Strasberg SM, Solomkin JS, Pitt HA, Garden OJ, et al. Tg13 man-agement bundles for acute cholangitis and cholecystitis. J Hepatobiliary Pancreat Sci. 2013;20(1):55–9.
45.Takada T, Strasberg SM, Solomkin JS, Pitt HA, Gomi H, Yoshida M, et al. Tg13: updated tokyo guidelines for the management of acute cholangitis and cholecystitis. J Hepatobiliary Pancreat Sci. 2013;20(1):1–7.
46.Boerma D, Rauws EA, Keulemans YC, Janssen IM, Bolwerk CJ, Timmer R, et al. Wait-and-- see policy or laparoscopic cholecystectomy after endoscopic sphincterotomy for bile-duct stones: a randomised trial. Lancet. 2002;360(9335):761–5.
47.Maple JT, Ikenberry SO, Anderson MA, Appalaneni V, Decker GA, Committee ASOP, et al. The role of endoscopy in the management of choledocholithiasis. Gastrointest Endosc. 2011;74(4):731–44.
48.Bornman PC, van Beljon JI, Krige JE. Management of cholangitis. J Hepato-Biliary-Pancreat Surg. 2003;10(6):406–14.
49.Boender J, Nix GA, de Ridder MA, Dees J, Schutte HE, van Buuren HR, et al. Endoscopic sphincterotomy and biliary drainage in patients with cholangitis due to common bile duct stones. Am J Gastroenterol. 1995;90(2):233–8.
50.van der Velden JJ, Berger MY, Bonjer HJ, Brakel K, Lameris JS. Percutaneous treatment of bile duct stones in patients treated unsuccessfully with endoscopic retrograde procedures. Gastrointest Endosc. 2000;51(4 Pt 1):418–22.
51.Minaga K, Kitano M, Imai H, Yamao K, Kamata K, Miyata T, et al. Urgent endoscopic ultrasound--guided choledochoduodenostomy for acute obstructive suppurative cholangitis-- induced sepsis. World J Gastroenterol. 2016;22(16):4264–9.
52.Artifon EL, Takada J, Okawa L, Moura EG, Sakai P. EUS-guided choledochoduodenostomy for biliary drainage in unresectable pancreatic cancer: a case series. JOP. 2010;11(6):597–600.
53.McNabb-Baltar J, Trinh QD, Barkun AN. Biliary drainage method and temporal trends in patients admitted with cholangitis: a national audit. Can J Gastroenterol. 2013;27(9):513–8.
54.Schiphorst AH, Besselink MG, Boerma D, Timmer R, Wiezer MJ, van Erpecum KJ, et al. Timing of cholecystectomy after endoscopic sphincterotomy for common bile duct stones. Surg Endosc. 2008;22(9):2046–50.
55.Li VK, Yum JL, Yeung YP. Optimal timing of elective laparoscopic cholecystectomy after acute cholangitis and subsequent clearance of choledocholithiasis. Am J Surg. 2010;200(4):483–8.
56.Kini S, Kannan U. Effect of bariatric surgery on future general surgical procedures. J Minim Access Surg. 2011;7(2):126–31.
57.Evans JA, Muthusamy VR, Acosta RD, Bruining DH, Chandrasekhara V, American Society for Gastrointestinal Endoscopy Standards of Practice C, et al. The role of endoscopy in the bariatric surgery patient. Gastrointest Endosc. 2015;81(5):1063–72.
58mittee ASoP. The role of endoscopy in the bariatric surgery patient. Surg Endosc. 2015;29(5):1007–17.
59.Ahmed AR, Husain S, Saad N, Patel NC, Waldman DL, O’Malley W. Accessing the common bile duct after roux-en-y gastric bypass. Surg Obes Relat Dis. 2007;3(6):640–3.
60.Snauwaert C, Laukens P, Dillemans B, Himpens J, De Looze D, Deprez PH, et al. Laparoscopy-- assisted transgastric endoscopic retrograde cholangiopancreatography in bariatric roux-en-y gastric bypass patients. Endosc Int Open. 2015;3(5):E458–63.
61.Saleem A, Levy MJ, Petersen BT, Que FG, Baron TH. Laparoscopic assisted ERCP in roux-- en--y gastric bypass (RYGB) surgery patients. J Gastrointest Surg. 2012;16(1):203–8.
62.Bowman E, Greenberg J, Garren M, Guda N, Rajca B, Benson M, et al. Laparoscopic-assisted ercp and eus in patients with prior roux-en-y gastric bypass surgery: a dual-center case series experience. Surg Endosc. 2016;30(10):4647–52.
63.Williams EJ, Green J, Beckingham I, Parks R, Martin D, Lombard M, et al. Guidelines on the management of common bile duct stones (CBDS). Gut. 2008;57(7):1004–21.
64.Lacitignola S, Minardi M. Management of common bile duct stones: a ten-year experience at a tertiary care center. JSLS. 2008;12(1):62–5.
65.Shah JN, Bhat YM, Hamerski CM, Kane SD, Binmoeller KF. Feasibility of nonradiation eus-based ercp in patients with uncomplicated choledocholithiasis (with video). Gastrointest Endosc. 2016;84(5):764–9.
66.Verma D, Kapadia A, Eisen GM, Adler DG. EUS vs MRCP for detection of choledocholithia-sis. Gastrointest Endosc. 2006;64(2):248–54.
67.Anonymous. British society of gastroenterology (2009) acute jaundice. 2009. bsg.org.uk.
68.Anonymous. Ashford and St. Peter’s hospitals NHS Foundation Trust (2011) painless obstruc-tive jaundice. Ambulatory emergency care pathways. Ashford and St. Peter’s Hospitals NHS Foundation Trust. 2011. asphnhs.uk.
69.Mitchell J, Hussaini H, McGovern D, Farrow R, Maskell G, Dalton H. The “jaundice hotline” for the rapid assessment of patients with jaundice. BMJ. 2002;325(7357):213–5. |