视交叉上核或核(SCN)是下丘脑中大脑的一个微小区域,位于视交叉的正上方。 它负责控制昼夜节律。 它产生的神经元和激素活动在24小时内调节许多不同的身体功能,使用大约20,000个神经元。[1]
SCN与大脑的许多其他区域相互作用。 它含有几种细胞类型和几种不同的肽(包括加压素和血管活性肠肽)和神经递质。
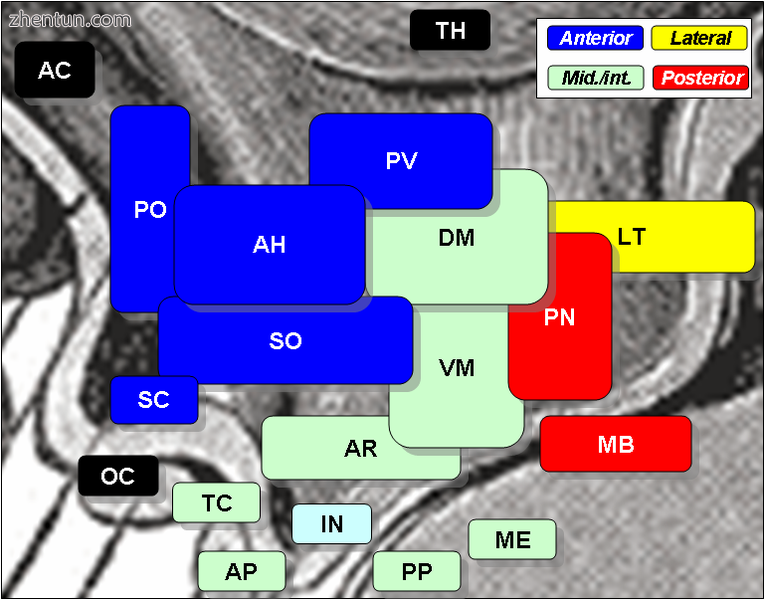
视交叉上核是SC,位于左中心,标记为蓝色。
光学交叉是OC,就在下面,用黑色标记。
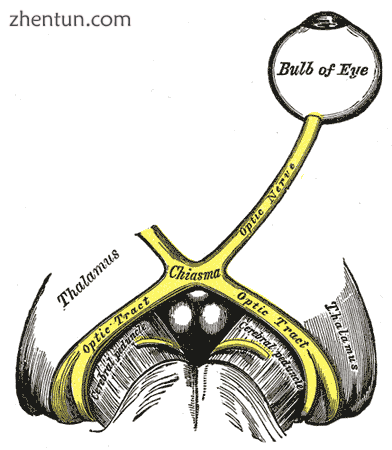
左视神经和视神经束。 (视交叉上核没有标记,但图表说明了区域。)
目录
1 位置
2 昼夜节律效应
3 吸热(温血)和放热(冷血)脊椎动物的昼夜节律
3.1 吸热和吸热的SCN
3.2 由脊椎动物的SCN控制的行为
4 来自视网膜的其他信号
5 基因表达
5.1 果蝇
5.2 哺乳动物
6 电生理学
7 参考
位置
SCN位于下丘脑的前部,紧邻背侧,或上部(因此上)到与第三脑室双侧(在两侧)的视交叉(CHO)。
昼夜节律效应
不同的生物,如细菌,[2]植物,真菌和动物,表现出基于遗传的近24小时节律。尽管所有这些时钟似乎都基于相似类型的遗传反馈环,但所涉及的特定基因被认为在每个王国中独立进化。哺乳动物行为和生理学的许多方面显示出昼夜节律性,包括睡眠,身体活动,警觉性,激素水平,体温,免疫功能和消化活动。 SCN在整个身体上协调这些节奏,如果SCN被摧毁,节奏性就会丢失。例如,在具有SCN损伤的大鼠中维持总睡眠时间,但是睡眠发作的长度和时间变得不稳定。 SCN通过同步“从属振荡器”保持对身体的控制,“从属振荡器”表现出他们自己的近24小时节律并控制局部组织中的昼夜节律现象。[3]
SCN通过视网膜下丘脑束接收来自视网膜中的专门光敏神经节细胞的输入。腹外侧SCN(vlSCN)中的神经元具有光诱导基因表达的能力。视网膜中含有黑视素的神经节细胞通过视网膜下丘脑束直接连接到腹外侧SCN。当视网膜接收光时,vlSCN在整个SCN中传递该信息,允许将人或动物的日常节律夹带,同步到24小时周期。夹带生物(包括人类)对外源性线索(如光/暗循环)的重要性,可以通过几种昼夜节律睡眠障碍来反映,这种过程不能正常发挥作用。[4]
背内侧SCN(dmSCN)中的神经元被认为具有内源性24小时节律,可以在恒定的黑暗中持续存在(人类平均约24小时11分钟)。[5] GABA能机制将SCN的腹侧和背侧区域联系起来。
SCN向其他下丘脑核和松果腺发送信息,以调节体温和激素如皮质醇和褪黑激素的产生。
吸热(温血动物)和体温(冷血动物)脊椎动物的昼夜节律

热吸收的蛇的热成像图像环绕着吸热的人的手
关于代谢过程和昼夜节律控制行为的直接神经元调节的信息在吸热或体温脊椎动物中并不为人所知,尽管已经对模型动物如哺乳动物小鼠和体温爬行动物的SCN进行了广泛的研究,特别是蜥蜴。已知SCN不仅涉及来自视网膜下丘脑的神经支配的光感受,还涉及能够产生恒温的脊椎动物的体温调节,以及调节体外脊椎动物内的生物钟的运动和其他行为输出。[6]当与SCN和邻近下丘脑的各种其他核的相应结构和性质相比时,两类脊椎动物之间的行为差​​异提供了对这些行为如何是不同昼夜节律调节的结果的见解。最终,必须进行许多神经行为学研究,以完全确定SCN对脊椎动物的昼夜调节行为的直接和间接作用。
吸热和吸热的SCN
通常,外部温度不影响吸热动物行为或昼夜节律,因为这些动物通过稳态体温调节保持其体内温度恒定的能力;然而,哺乳动物中的外围振荡器(参见昼夜节律)对温度脉冲敏感,并且将经历昼夜节律钟阶段的重置和相关的遗传表达,这表明尽管在SCN内具有主振荡器,但外围昼夜节律振荡器可能是彼此独立的实体。 此外,当用热脉冲处理来自小鼠的SCN的个体神经元时,观察到类似的振荡器复位,但是当用相同的热脉冲处理处理完整的SCN时,SCN通过表现出未改变的昼夜节律来抵抗温度变化。振荡阶段。[6]在体外动物,尤其是废墟蜥蜴Podacris sicula中,温度已被证明会影响SCN内的昼夜节律振荡器。[7]这反映了吸热和体温脊椎动物之间潜在的进化关系,以及等温线如何依赖环境温度来影响它们的昼夜节律和行为,并且吸热具有进化的SCN以基本上忽略外部温度并使用光感受作为在其内部夹带昼夜节律振荡器的手段。 SCN。此外,吸热和体温脊椎动物之间SCN的差异表明,吸热中耐温SCN的神经元组织负责驱动这些动物的体温调节行为,这与其他动物不同,因为它们依赖于外部温度参与某些行为。
由脊椎动物的SCN控制的行为
已经对负责控制昼夜节律的基因进行了重要的研究,特别是在SCN内。了解Clock(Clk)和Period2(Per2)的基因表达,这是负责调节SCN个体细胞内昼夜节律的众多基因中的两个,可以更好地理解遗传表达如何影响昼夜节律的调节。控制行为。对蠕虫蜥蜴和小鼠的体温调节的研究已经告知了两种脊椎动物的神经和遗传成分在经历诱导的低温条件时的某些联系。某些研究结果反映了SCN在结构和遗传上的进化如何导致两种脊椎动物的特征和刻板的体温调节行为的参与。
小鼠:在脊椎动物中,已知哺乳动物是能够进行稳态体温调节的吸热。已经证明小鼠在SCN内具有一些热敏性,尽管经历低温的小鼠对体温的调节对于它们是处于明亮或黑暗环境中更敏感;已经表明,在黑暗条件下和经历低温的小鼠即使在禁食时也能保持稳定的体内温度。在光照条件下,小鼠在相同的禁食和低温条件下表现出体温下降。通过分析野生型和敲除菌株中Clock基因的遗传表达,以及分析SCN中神经元的活性以及在上述条件下与下丘脑邻近核的连接,已经证明SCN是其中心。控制昼夜体温节律。[8]因此,这种昼夜节律控制包括哺乳动物参与维持体内平衡的许多体温调节行为的直接和间接影响。
破坏蜥蜴:已经对各种光照和黑暗条件下SCN的昼夜节律振荡细胞中表达的基因进行了几项研究,以及在爬行动物中诱导亚低温的效果。在结构方面,蜥蜴的SCN与老鼠的SCN更为相似,具有背内侧部分和腹外侧核心。[9]然而,蜥蜴中与昼夜节律相关的Per2基因的遗传表达与爬行动物和鸟类中的相似,尽管已知鸟类具有由侧向和中间部分组成的独特SCN结构[10]。研究蜥蜴SCN是因为蜥蜴的体型小和体温小,对于理解这类脊椎动物如何在昼夜节律动态中改变其行为是非常宝贵的,但尚未确定冷血脊椎动物的系统是否减速为由于体温过低导致SCN活性降低或代谢活动减少[7]。
来自视网膜的其他信号
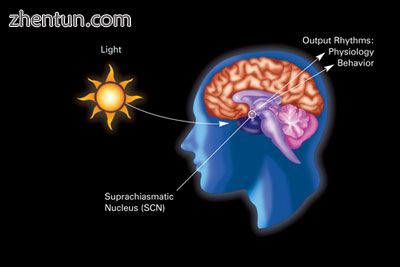
一种肌电图的变体显示光明和黑暗对人类SCN的昼夜节律和相关生理和行为的影响
SCN是直接从视网膜接收神经信号的许多细胞核之一。
其他一些是外侧膝状核(LGN),上丘,基底视神经系统和顶叶:
LGN将关于颜色,对比度,形状和运动的信息传递给视觉皮层,并将其自身信号传递给SCN。
上丘控制着眼睛的运动和方向。
基础光学系统也控制眼球运动。[11]
顶叶控制瞳孔的大小。
基因表达
SCN中的昼夜节律由个体SCN神经元中的基因表达循环产生。这个循环通过进化得到了很好的保存,实质上在来自许多显示出昼夜节律的不同生物的细胞中是相似的。
果蝇
在果蝇果蝇中,神经元中的细胞昼夜节律由两个互锁的反馈环控制。
在第一个循环中,bHLH转录因子时钟(CLK)和循环(CYC)驱动其自身阻遏物期(PER)和永恒(TIM)的转录。然后PER和TIM蛋白质在细胞质中积累,在夜间转移到细胞核中,并关闭它们自己的转录,从而建立24小时的转录和转移振荡。
在第二个循环中,转录因子vrille(VRI)和Pdp1由CLK / CYC启动。 PDP1对CLK转录起积极作用,对VRI起消极作用。
这些基因编码各种转录因子,触发其他蛋白质的表达。称为CLK和CYC的时钟和周期产物属于含有PAS的转录因子基本螺旋 - 环 - 螺旋(bHLH)家族的亚家族,并形成异二聚体。该异二聚体(CLK-CYC)启动PER和TIM的转录,其蛋白质产物二聚化,然后通过破坏CLK-CYC介导的转录来抑制它们自身的表达。这种负反馈机制为时钟基因的表达提供了24小时的节奏。怀疑许多基因通过其启动子中的“E-box元件”与昼夜节律控制相关联,因为CLK-CYC及其同源物与这些元件结合。
24小时的节奏可以通过蛋白质隐花色素(CRY)通过光重置,其参与果蝇的昼夜节律光感受。 CRY以与光有关的方式与TIM相关联,导致TIM的破坏。如果没有TIM稳定,PER最终会在白天被破坏。结果,CLK-CYC的抑制减少,整个循环再次重新开始。
哺乳动物
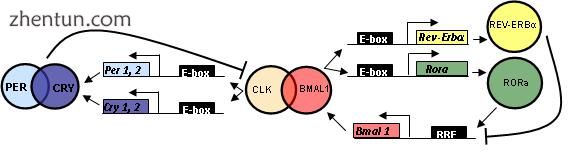
参与哺乳动物昼夜节律振荡器的振荡器基因和蛋白质
在哺乳动物中,生物钟基因的行为方式与苍蝇类似。
首先将CLOCK(昼夜节律运动输出周期kaput)克隆到小鼠中,并且BMAL1(脑和肌肉芳烃受体核转位蛋白(ARNT)样1)是果蝇CYC的主要同源物。
已经鉴定了PER(PER1,PER2和PER3)和两种CRY同源物(CRY1和CRY2)的三种同源物。
已在哺乳动物中鉴定出TIM;但是,它的功能仍未确定。 TIM中的突变导致无法对zeitgebers做出反应,这对于重置生物钟是至关重要的。[引证需要]
最近的研究表明,在SCN之外,时钟基因也可能具有其他重要作用,包括它们对可卡因滥用药物影响的影响。[12] [13]
电生理学
SCN中的神经元以24小时的节奏激发动作电位。在中午,射击率达到最大值,并且在夜间,它再次下降。基因表达周期(所谓的核心时钟)如何连接到神经发射仍然未知。
许多SCN神经元对通过视网膜的光刺激敏感,并且在啮齿动物的光脉冲(~30秒)期间持续发射动作电位。光响应可能与光对昼夜节律的影响有关。此外,褪黑激素的局部应用可以降低这些神经元的激发活性,表明SCN中存在的褪黑激素受体通过SCN介导相移作用。
另见
Chronobiology
Photosensitive ganglion cell
Sense of time
Retinohypothalamic tract
Shift work sleep disorder
Non-24-hour sleep–wake disorder
参考
Fahey, Jonathan (2009-10-15). "How Your Brain Tells Time". Out Of The Labs. Forbes.
Clodong, S; Dühring, U; Kronk, L; Wilde, A; Axmann, I; Herzel, H; Kollmann, M; Clodong S, Dühring U, Kronk L, Wilde A, Axmann I, Herzel H, Kollmann M (2007). "Functioning and robustness of a bacterial circadian clock". Molecular Systems Biology. 3 (1): 90. doi:10.1038/msb4100128. PMC 1847943. PMID 17353932.
Bernard, S; Gonze, D; Cajavec, B; Herzel, H; Kramer, A (2007). "Synchronization-Induced Rhythmicity of Circadian Oscillators in the Suprachiasmatic Nucleus". PLoS Computational Biology. 3 (4): e68. doi:10.1371/journal.pcbi.0030068. PMC 1851983. PMID 17432930.
https://www.scholars.northwester ... m-sleep-disorders-5
"Human Biological Clock Set Back an Hour". Harvard Gazette. 1999-07-15. Retrieved 2019-01-28.
Buhr Ethan D.; Seung-Hee Yoo; Takahashi Joseph S. (2010). "Temperature as a Universal Resetting Cue for Mammalian Circadian Oscillators". Science. 330 (6002): 379–385. doi:10.1126/science.1195262. PMC 3625727. PMID 20947768.
Magnone, M. C.; Jacobmeier, B.; Bertolucci, C.; Foà, A.; Albrecht, U. (2005). "Circadian expression of the clock gene Per2 is altered in the ruin lizard (Podarcis sicula) when temperature changes". Molecular Brain Research. 133: 281–285.
Tokizawa K.; Uchida Y.; Nagashima K. (2009). "Thermoregulation in the cold changes depending on the time of day and feeding condition: physiological and anatomical analyses of involved circadian mechanisms". Neuroscience. 164: 1377–1386. doi:10.1016/j.neuroscience.2009.08.040. PMID 19703527.
Casini G., Petrini P., Foa' A., Bagnoli P., Pattern (1993). "Podarcis sicula Rafinesque". J. Hirnforsch. 34: 361–374.
Abraham U.; Albrecht U.; Gwinner E.; Brandstatter R. (2002). "Spatial and temporal variation of passer Per2 gene expression in two distinct cell groups of the suprachiasmatic hypothalamus in the house sparrow(Passer domesticus)". Eur. J. Neurosci. 16: 429–436. doi:10.1046/j.1460-9568.2002.02102.x.
Giolli, Blanks, Lui, "The accessory optic system: basic organization with an update on connectivity, neurochemistry, and function", http://escholarship.org/uc/item/3v25z604
Yuferov V, Butelman E, Kreek M (2005). "Biological clock: biological clocks may modulate drug addiction". European Journal of Human Genetics. 13 (10): 1101–3. doi:10.1038/sj.ejhg.5201483. PMID 16094306.
Manev H, Uz T (2006). "Clock genes as a link between addiction and obesity". European Journal of Human Genetics. 14 (1): 5. doi:10.1038/sj.ejhg.5201524. PMID 16288309. |