系统性硬皮病,也称为弥漫性硬皮病或系统性硬化症,是结缔组织的自身免疫疾病。其特征在于由胶原蛋白的积聚和小动脉的损伤引起的皮肤增厚。硬皮病有两种形式:局限性和全身性。局部(非全身)形式仅影响面部,手部和脚部的皮肤。全身形式(有限的或弥漫性的皮肤)涉及这些,并且此外可以发展到内脏器官,包括肾脏,心脏,肺和胃肠道。预后取决于疾病的形式和内脏受累的程度。皮肤硬皮病有限的患者10年生存率为75%; 10至20年后发生肺动脉高压不到10%。弥漫性皮肤硬皮病患者的10年生存率为55%。死亡最常由肺,心脏和肾脏受累引起。癌症的风险也略有增加。[1]
通过有效治疗肾衰竭,存活率大大提高。疗法包括免疫抑制药物,在某些情况下还包括糖皮质激素[2]。
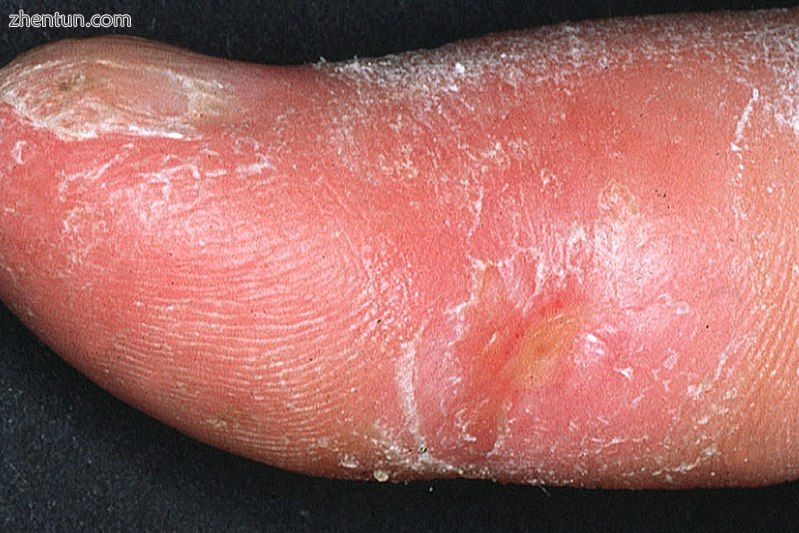
系统性硬化症患者拇指交感神经性坏死的临床表现。
目录
1 症状和体征
1.1 皮肤症状
1.2 其他器官
2 原因
3 病理生理学
4 诊断
5 治疗
5.1 外用/对症
5.2 肾脏疾病
5.3 肺部疾病
6 流行病学
7 社会与文化
7.1 支持小组
8 研究
9 参考
体征和症状
CREST综合征(钙质沉着症,雷诺现象,食管功能障碍,硬化和毛细血管扩张)与有限的硬皮病相关。 其他症状包括:
皮肤症状
在皮肤中,系统性硬化导致硬化和瘢痕形成。皮肤可能看起来紧绷,偏红或鳞片状。血管也可能更明显。在大面积受影响的地方,脂肪和肌肉的浪费可能会削弱四肢并影响外观。患者报告大面积皮肤严重和反复发痒。这些症状的严重程度在患者中差异很大:一些患有仅仅有限的皮肤区域(例如手指)的硬皮病,并且很少涉及下面的组织,而另一些则具有渐进的皮肤受累[3]。数字性溃疡 - 特别是指尖上的伤口和不太常见的指关节 - 并不罕见。[4]
其他器官
弥漫性硬皮病可引起肌肉骨骼,肺部,胃肠道,肾脏和其他并发症。[5]皮肤受累较多的患者更可能有内部组织和器官受累。大多数患者(超过80%)有血管症状和雷诺现象,导致手部和脚部因寒冷而变色。雷诺通常会影响手指和脚趾。系统性硬皮病和雷诺氏可引起手指或脚趾上的疼痛性溃疡,称为数字溃疡。钙质沉着症(皮肤下块状钙沉积)在全身性硬皮病中也很常见,常见于肘部,膝盖或其他关节附近。[引证需要]
肌肉骨骼
硬皮病患者首先出现的关节症状通常是非特异性关节疼痛,可导致关节炎,或引起肌腱或肌肉不适。[5]关节活动性,特别是手的小关节,可能受到钙质沉着或皮肤增厚的限制。[6]患者可能会因疾病或其治疗方法出现肌肉无力或肌病。[7]
肺
在肺功能检查中弥漫性硬皮病患者几乎普遍见到肺功能受损; [8]然而,它并不一定会引起症状,如呼吸短促。 一些患者可发展为肺动脉高压,或肺动脉压力升高。 这可能是进行性的,并可导致右侧心力衰竭。 最早的表现可能是肺功能测试的扩散能力降低。
更晚期疾病的其他肺部并发症包括吸入性肺炎,肺出血和气胸[5]。
消化道
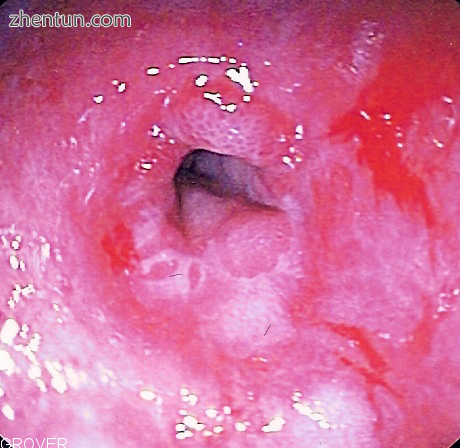
消化道狭窄的内窥镜图像,或由于慢性胃食管反流引起的与胃交界处附近的食道变窄。这是硬皮病中吞咽困难或吞咽困难的最常见原因。
弥漫性硬皮病可影响胃肠道的任何部位。[9]食管中最常见的表现是反流性食管炎,可能因食道狭窄或食管良性狭窄而复杂化[10]。最好先用质子泵抑制剂进行酸抑制[11],但在狭窄的情况下可能需要探针扩张。[9]
硬皮病可降低胃肠道任何部位的运动性。[9]最常见的运动能力降低的原因是食道和食管下括约肌,导致吞咽困难和胸痛。随着硬皮病的发展,由于进行性纤维化(瘢痕形成),由于运动性降低的异常导致的食管受累可能恶化。如果不进行治疗,胃中的酸会回到食道,导致食道炎和GERD。多次从酸性损伤到下食道的进一步瘢痕导致纤维化变窄的发展,也称为可以通过扩张和Barrett食管治疗的狭窄。
十二指肠:在患有神经肌肉疾病,特别是进行性系统性硬化症和内脏肌病的患者中,经常涉及十二指肠。可能存在扩张,这在第二,第三和第四部分中通常更为明显。扩张的十二指肠可以缓慢地排空,并且严重扩张的失张力器官可以产生肿块效应。
小肠也可能参与其中,导致胆汁盐,脂肪,碳水化合物,蛋白质和维生素的细菌过度生长和吸收不良。可能涉及结肠,并可引起假性梗阻或缺血性结肠炎。[5]
较常见的并发症包括囊肿囊肿,或肠壁气袋,结肠和食道宽口憩室以及肝纤维化。患有严重胃肠道受累的患者可能会严重营养不良。[10]
硬皮病还可能与胃窦血管扩张症(GAVE)有关,也称为西瓜胃。 这是非典型血管通常以胃的幽门周围的径向对称模式增殖的病症。 GAVE可能是硬皮病患者上消化道出血或缺铁性贫血的原因[10]。
肾脏
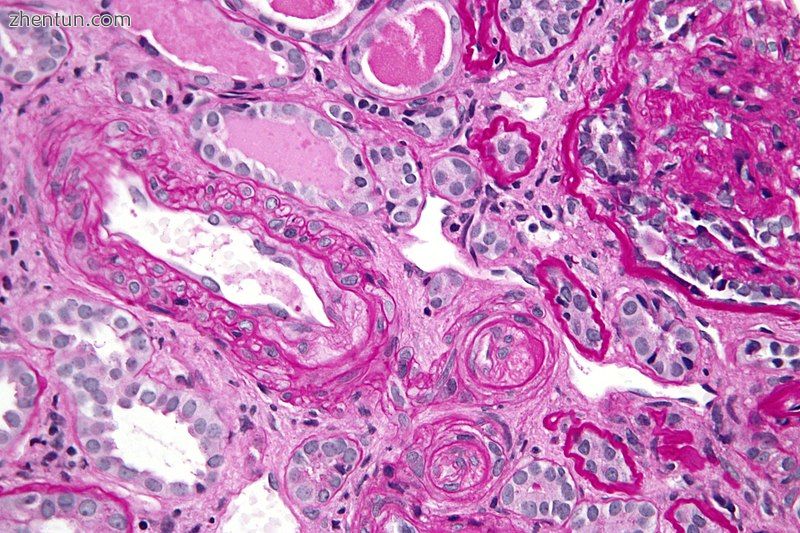
显微照片显示血栓性微血管病变,在硬皮病肾脏危象中见到的组织形态学发现。肾活检。 PAS染色。
硬皮病中的肾脏受累被认为是不良的预后因素,并且常常是导致死亡的原因。[12]
涉及肾脏的硬皮病最重要的临床并发症是硬皮病肾脏危象。硬皮病肾脏危象的症状是恶性高血压(高血压伴有急性器官损害的证据),高血氨症(高肾素水平),氮质血症(血液中积聚废物的肾衰竭)和微血管病性溶血性贫血(红细胞破坏) )[13]除高血压外,血尿(尿液中的血液)和蛋白尿(尿液中的蛋白质丢失)可能是指示性的。[14]
在过去的硬皮病中,肾脏危象几乎是致命的。[15]尽管使用ACE抑制剂可显着改善预后[16] [17],但预后常常受到保护,因为大量患者难以治疗并发生肾功能衰竭。所有弥漫性皮肤硬皮病患者中约有7-9%在其疾病过程中的某些时候出现肾脏危象[18] [19]。皮肤快速受累的患者肾脏并发症的风险最高[20]。它在弥漫性皮肤硬皮病中最常见,并且通常与针对RNA聚合酶的抗体相关(在59%的病例中)。许多人进行透析,尽管这可以在三年内在大约三分之一的情况下停止。更高的年龄和(自相矛盾的)在出现时血压降低使得更有可能需要透析。[21]
硬皮病肾脏危象的治疗包括ACE抑制剂。目前不建议预防性使用ACE抑制剂,因为最近的数据表明,在肾脏危象发生之前用这些药物治疗的患者的预后较差。[22] [不可靠的医疗来源?]已知移植的肾脏受到硬皮病的影响患有早发性肾病的患者(在硬皮病诊断的一年内)被认为具有最高的复发风险。[23]
原因
硬皮病和系统性硬化症没有明显的明显原因。遗传易感性似乎有限:遗传一致性很小;然而,自身免疫性疾病常常存在家族性倾向。 COL1A2和TGF-β1的多态性可能影响疾病的严重程度和发展。有限的证据表明巨细胞病毒(CMV)是免疫反应的原始表位,以及细小病毒B19。[24]有机溶剂和其他化学试剂与硬皮病有关。[25]
自身免疫现象背后的可疑机制之一是微嵌合体的存在,即在母体​​血液中循环的胎儿细胞,引发对被认为是异物的免疫反应。[26] [25]
慢性肾功能衰竭患者可能出现明显的硬皮病和系统性硬化症。这种形式,肾源性纤维化皮肤病或肾源性系统性纤维化,[27] [28] [29] [30]与暴露于含钆的放射性对比剂有关。[31]
博莱霉素[32](化疗药物)和可能的紫杉烷化疗[33]可能会导致硬皮病,职业性接触溶剂与系统性硬化症的风险增加有关。[34]
病理生理学
胶原蛋白的过量产生被认为是由自身免疫功能障碍引起的,其中免疫系统开始攻击染色体的动粒。这将导致附近基因的遗传功能失常。 T细胞在皮肤中积聚;这些被认为是分泌细胞因子和刺激胶原蛋白沉积的其他蛋白质。特别是对成纤维细胞的刺激似乎对疾病过程至关重要,研究已经集中在产生这种效应的潜在因素上。[25]
成纤维细胞
该过程中的重要参与者是转化生长因子(TGFβ)。该蛋白质似乎过量产生,并且成纤维细胞(可能响应于其他刺激)也过度表达该介质的受体。细胞内途径(由SMAD2 / SMAD3,SMAD4和抑制剂SMAD7组成)负责第二信使系统,其诱导负责胶原沉积的蛋白质和酶的转录。 Sp1是在此背景下最密切研究的转录因子。除TGFβ外,结缔组织生长因子(CTGF)也有可能发挥作用。[25]实际上,常见的CTGF基因多态性在系统性硬化症中以增加的速率存在[35]。
内皮损伤是硬皮病发展的早期异常,这似乎也是由于成纤维细胞的胶原蛋白积聚,尽管细胞因子,血小板粘附和II型超敏反应的直接改变也同样受到牵连。已经记录了内皮素增加和血管舒张减少[25]。
Jimenez&Derk [25]描述了关于硬皮病发展的三种理论:
异常主要是由于物理因素造成的,所有其他变化都是次要或反应直接的侮辱。
最初的事件是导致微嵌合体的胎儿母体细胞转移,具有导致疾病实际发展的第二个总结原因(例如环境)。
物理原因导致易感细胞的表型改变(例如由于遗传构成),然后实现改变细胞行为的DNA变化。
诊断
1980年,美国风湿病学会就硬皮病的诊断标准达成一致。[36]
诊断是临床怀疑,存在自身抗体(特别是抗着丝粒和抗scl70 /抗拓扑异构酶抗体),偶尔通过活组织检查。在抗体中,90%具有可检测的抗核抗体。抗着丝粒抗体在有限形式(80-90%)中比在弥漫形式(10%)中更常见,并且抗scl70在弥漫形式(30-40%)和非洲裔美国患者中更常见(谁更容易受到系统性的影响。)[25]
其他病症可通过引起皮肤硬化来模拟系统性硬化。诊断暗示另一种疾病的原因包括没有雷诺现象,手上皮肤缺乏,内脏器官受累缺乏,以及正常的抗核抗体检测结果。[37]
治疗
硬皮病无法治愈,但有一些症状可以治疗,包括软化皮肤和减少炎症的药物。一些患者可能因受热而受益。[38]考虑到疾病症状和进展的复杂性,根据患者的教育水平定制的患者教育的整体护理是有用的。[39]
专题/症状
对硬皮病皮肤改变的局部治疗不会改变病程,但可以改善疼痛和溃疡。一系列NSAIDs(非甾体类抗炎药)可用于缓解疼痛症状,如萘普生。[引证需要]类固醇如泼尼松的益处有限。 Raynaud现象的发作有时会对硝苯地平或其他钙通道阻滞剂;严重的数字溃疡可能对前列环素类似物伊洛前列素有反应,而双内皮素受体拮抗剂波生坦可能对雷诺现象有益。[40]皮肤紧张可以用甲氨蝶呤和环孢素全身治疗。[40]并用青霉胺处理皮肤厚度。
肾脏疾病
硬皮病肾脏危象,硬皮病患者发生急性肾功能衰竭和恶性高血压(极高血压伴有器官损害的证据),可有效地用ACE抑制剂类药物治疗。 ACE抑制剂的益处甚至延伸到那些必须开始透析以治疗其肾脏疾病的人,并且可以提供足够的益处以允许停止肾脏替代疗法。[40]
肺部疾病
活动性肺泡炎通常用环磷酰胺脉冲治疗,通常与小剂量的类固醇一起治疗。这种干预的好处是适度的。[41] [42]
肺动脉高压可以用依前列醇,曲前列环素,波生坦和可能的气雾化伊洛前列素治疗[40]。
流行病学
地球图标。
本文中的示例和观点可能并不代表该主题的全球视图。您可以根据需要改进本文,在谈话页面上讨论问题或创建新文章。 (2008年5月)(了解如何以及何时删除此模板消息)
系统性硬皮病是一种罕见疾病[43],美国每10万人中每年发病率为1至2。峰值起始的间隔从30岁[44]到35岁[45]开始,到50岁[44]到55岁结束。[45]
在美国,系统性硬皮病的患病率约为50,000,[45]不同的研究给出了不同的估计值,通常在40,000到165,000之间。[46]
系统性硬化症的年发病率为百万分之19,患病率为每10万人19-75,女性:男性比例为3:1(育龄中晚期为8:1)。非裔美国人的发病率是其两倍。俄克拉荷马州的Choctaw美洲原住民在世界上的患病率最高(每10万人中有469人)。
这种疾病有一些遗传性的关联。它也可能是由对病毒(分子模仿)或毒素的免疫反应引起的。[2]
社会与文化
支持小组
青少年硬皮病网络是一个致力于为患有青少年硬皮病的父母及其子女提供情感支持和教育信息的组织,支持儿科研究,以确定青少年硬皮病的病因和治疗方法,并提高公众意识。[47]
在美国,硬皮病研究基金会致力于提高对疾病的认识,并帮助那些受影响的人。[48]硬皮病研究基金会赞助对这种疾病的研究。[49]喜剧演员兼电视节目主持人Bob Saget是SRF的董事会成员,执导了1996年ABC电视电影“希望”,由Dana Delany主演,描绘了一位受硬皮病致命影响的年轻女子;这部电影是基于萨格的妹妹盖伊的经历。[50]
Scleroderma Society是一家英国慈善机构,成立于1982年,为患有硬皮病的人及其家人提供支持。[51] [52]
研究
鉴于治疗硬皮病的困难,通常试图用较小的证据基础来控制疾病。这些包括抗胸腺细胞球蛋白和mycophenolate mofetil;一些报道报道了皮肤症状的改善以及延迟全身性疾病的进展,但它们都没有经过大规模的临床试验。[40]
自体造血干细胞移植(HSCT)基于这样的假设:当免疫系统的白细胞攻击身体时,会发生自身免疫性疾病,如系统性硬化症。在这种治疗中,来自患者血液的干细胞被提取并储存以保存它们。用环磷酰胺和针对白细胞的兔抗体破坏患者的白细胞。然后将储存的血液返回到患者的血液中,以重建健康的血液和免疫系统,该系统不会攻击身体。 2014年发表了一项有关156例患者的自体干细胞移植国际硬皮病(ASTIS)试验的3期试验结果.HSCT本身具有较高的治疗死亡率,因此在第一年,治疗组患者的生存率低于安慰剂组,但在10年末,治疗组的生存率显着提高。作者得出结论,HSCT可能是有效的,如果仅限于足够健康以便在HSCT中存活的患者。因此,HSCT应该在疾病进展的早期给予,然后才能造成损害。心脏病患者和吸烟者不太可能存活。[53] [54]另一项试验,干细胞移植与环磷酰胺(SCOT)试验正在进行中。[55]
参考
Onishi A, Sugiyama D, Kumagai S, Morinobu A (July 2013). "Cancer incidence in systemic sclerosis: meta-analysis of population-based cohort studies". Arthritis Rheum. 65 (7): 1913–21. doi:10.1002/art.37969. PMID 23576072.
Longo, Dan L.; Kasper, Dennis L; Fauci, Anthony; Hauser, Stephen L. et al., eds. (July 2011) [2005]. Harrison's Principles of Internal Medicine (16th ed.). New York: McGraw-Hill. ISBN 978-0071748896.
Hinchcliff M, Varga J (October 2008). "Systemic sclerosis/scleroderma: a treatable multisystem disease". Am Fam Physician. 78 (8): 961–8. PMID 18953973.
Abraham, S; Steen, V (2015). "Optimal management of digital ulcers in systemic sclerosis". Therapeutics and Clinical Risk Management. 11: 939–47. doi:10.2147/TCRM.S82561. PMC 4474386. PMID 26109864.
Klippel, John H. Primer On the Rheumatic Diseases 11ED. Atlanta, GA: Arthritis Foundation. ISBN 978-1-912423-16-3.
Valentini G, Black C (2002). "Systemic sclerosis". Best Practice & Research. Clinical Rheumatology. 16 (5): 807–16. doi:10.1053/berh.2002.0258. PMID 12473275.
Olsen NJ, King LE, Park JH (1996). "Muscle abnormalities in scleroderma". Rheum. Dis. Clin. North Am. 22 (4): 783–96. doi:10.1016/S0889-857X(05)70301-X. PMID 8923596.
Steen VD (2005). "The lung in systemic sclerosis". Journal of Clinical Rheumatology. 11 (1): 40–6. doi:10.1097/01.rhu.0000152147.38706.db. PMID 16357695.
Sallam H, McNearney TA, Chen JD (2006). "Systematic review: pathophysiology and management of gastrointestinal dysmotility in systemic sclerosis (scleroderma)". Aliment. Pharmacol. Ther. 23 (6): 691–712. doi:10.1111/j.1365-2036.2006.02804.x. PMID 16556171.
Rose S, Young MA, Reynolds JC (1998). "Gastrointestinal manifestations of scleroderma". Gastroenterol. Clin. North Am. 27 (3): 563–94. doi:10.1016/S0889-8553(05)70021-2. PMID 9891698.
Hendel L, Hage E, Hendel J, Stentoft P (1992). "Omeprazole in the long-term treatment of severe gastro-oesophageal reflux disease in patients with systemic sclerosis". Aliment. Pharmacol. Ther. 6 (5): 565–77. doi:10.1111/j.1365-2036.1992.tb00571.x. PMID 1420748.
Ruangjutipopan S, Kasitanon N, Louthrenoo W, Sukitawut W, Wichainun R (2002). "Causes of death and poor survival prognostic factors in thai patients with systemic sclerosis". Journal of the Medical Association of Thailand. 85 (11): 1204–9. PMID 12546318.
Steen VD, Mayes MD, Merkel PA (2003). "Assessment of kidney involvement". Clin. Exp. Rheumatol. 21 (3 Suppl 29): S29–31. PMID 12889219.
Steen VD (1994). "Renal involvement in systemic sclerosis". Clin. Dermatol. 12 (2): 253–8. doi:10.1016/S0738-081X(94)90329-8. PMID 8076263.
Steen VD (2003). "Scleroderma renal crisis". Rheum. Dis. Clin. North Am. 29 (2): 315–33. doi:10.1016/S0889-857X(03)00016-4. PMID 12841297.
Rhew EY, Barr WG (2004). "Scleroderma renal crisis: new insights and developments". Current Rheumatology Reports. 6 (2): 129–36. doi:10.1007/s11926-004-0057-5. PMID 15016343.
Steen VD, Medsger TA (2000). "Long-term outcomes of scleroderma renal crisis" (PDF). Ann. Intern. Med. 133 (8): 600–3. CiteSeerX 10.1.1.494.6389. doi:10.7326/0003-4819-133-8-200010170-00010. PMID 11033587. Archived from the original (PDF) on 19 June 2015.
Turk, Matthew; Pope, Janet E. (July 2016). "The Frequency of Scleroderma Renal Crisis over Time: A Metaanalysis". The Journal of Rheumatology. 43 (7): 1350–1355. doi:10.3899/jrheum.151353. ISSN 0315-162X. PMID 27134252.
Denton C, Lapadula G, Mouthon L, Müller-Ladner U (2009). "Renal complications and scleroderma renal crisis". Rheumatology. 48: 32–35. doi:10.1093/rheumatology/ken483. PMID 19487221.
Jimenez S, Koenig AS. Scleroderma. eMedicine.com. Accessed: May 22, 2006.
Penn H, Howie AJ, Kingdon EJ, et al. (August 2007). "Scleroderma renal crisis: patient characteristics and long-term outcomes". QJM. 100 (8): 485–94. doi:10.1093/qjmed/hcm052. PMID 17601770.
Hudson, M; Baron, M; Tatibouet, S; Furst, DE; Khanna, D; International Scleroderma Renal Crisis Study, Investigators (April 2014). "Exposure to ACE inhibitors prior to the onset of scleroderma renal crisis-results from the International Scleroderma Renal Crisis Survey". Seminars in Arthritis and Rheumatism. 43 (5): 666–72. doi:10.1016/j.semarthrit.2013.09.008. PMID 24176729.
Pham PT, Pham PC, Danovitch GM, et al. (October 2005). "Predictors and risk factors for recurrent scleroderma renal crisis in the kidney allograft: case report and review of the literature". Am. J. Transplant. 5 (10): 2565–9. doi:10.1111/j.1600-6143.2005.01035.x. PMID 16162209.
Ferri C, Zakrzewska K, Longombardo G, Giuggioli D, Storino FA, Pasero G, Azzi A (1999). "Parvovirus B19 infection of bone marrow in systemic sclerosis patients". Clin. Exp. Rheumatol. 17 (6): 718–20. PMID 10609071.
Jimenez SA, Derk CT (2004). "Following the molecular pathways toward an understanding of the pathogenesis of systemic sclerosis". Ann. Intern. Med. 140 (1): 37–50. doi:10.7326/0003-4819-140-2-200401200-00013. PMID 14706971.
Bianchi DW (2000). "Fetomaternal cell trafficking: a new cause of disease?". Am. J. Med. Genet. 91 (1): 22–8. CiteSeerX 10.1.1.605.5548. doi:10.1002/(SICI)1096-8628(20000306)91:1<22::AID-AJMG4>3.0.CO;2-3. PMID 10751084.
Abdel-Kader K, Patel PR, Kallen AJ, Sinkowitz-Cochran RL, Bolton WK, Unruh ML (March 2010). "Nephrogenic Systemic Fibrosis: A Survey of Nephrologists' Perceptions and Practices". Clin J Am Soc Nephrol. 5 (6): 964–71. doi:10.2215/CJN.00140110. PMC 2879309. PMID 20299369.
"[Nephrogenic systemic fibrosis or kidney failure--how great is the risk?]". Rofo (in German). 182 (2): 114–5. February 2010. PMID 20120045.
Panos A, Milas F, Kalakonas S, Myers PO (2010). "Cardiac autotransplantation for aortic and mitral valve replacement in a patient with nephrogenic systemic fibrosis" (PDF). Hellenic J Cardiol. 51 (1): 64–6. PMID 20118047.
Fine DM, Perazella MA (January 2010). "Nephrogenic systemic fibrosis: what the hospitalist needs to know". J Hosp Med. 5 (1): 46–50. doi:10.1002/jhm.493. PMID 20063400.
Boyd AS, Zic JA, Abraham JL (2007). "Gadolinium deposition in nephrogenic fibrosing dermopathy". J. Am. Acad. Dermatol. 56 (1): 27–30. doi:10.1016/j.jaad.2006.10.048. PMID 17109993.
Sharma SK, Handa R, Sood R, et al. (2004). "Bleomycin-induced scleroderma". The Journal of the Association of Physicians of India. 52: 76–7. PMID 15633728.
Farrant PB, Mortimer PS, Gore M (2004). "Scleroderma and the taxanes. Is there really a link?". Clin. Exp. Dermatol. 29 (4): 360–2. doi:10.1111/j.1365-2230.2004.01519.x. PMID 15245529.
Kettaneh A, Al Moufti O, Tiev KP, et al. (2007). "Occupational exposure to solvents and gender-related risk of systemic sclerosis: a metaanalysis of case-control studies". J. Rheumatol. 34 (1): 97–103. PMID 17117485.
Fonseca C, Lindahl GE, Ponticos M, et al. (September 2007). "A polymorphism in the CTGF promoter region associated with systemic sclerosis". N. Engl. J. Med. 357 (12): 1210–20. doi:10.1056/NEJMoa067655. PMID 17881752.
Masi AT (1980). "Preliminary criteria for the classification of systemic sclerosis (scleroderma). Subcommittee for scleroderma criteria of the American Rheumatism Association Diagnostic and Therapeutic Criteria Committee". Arthritis Rheum. 23 (5): 581–90. doi:10.1002/art.1780230510. PMID 7378088. Available online at "1980 Criteria for the Classification of Systemic Sclerosis". Retrieved 2007-08-05.
Moenning R, Grau RG (March 30, 2009). "Skin hardening, but is it systemic sclerosis?". The Journal of Musculoskeletal Medicine.
Oliver GF, Winkelmann RK (1989). "The current treatment of scleroderma". Drugs. 37 (1): 87–96. doi:10.2165/00003495-198937010-00006. PMID 2651089.
Philip J. Clements; Daniel E. Furst. Systemic Sclerosis, 2nd ed., Chapt. 23 (PDF).
Zandman-Goddard G, Tweezer-Zaks N, Shoenfeld Y (2005). "New therapeutic strategies for systemic sclerosis--a critical analysis of the literature". Clin. Dev. Immunol. 12 (3): 165–73. doi:10.1080/17402520500233437. PMC 2275417. PMID 16295521.
Tashkin DP, Elashoff R, Clements PJ, et al. (June 2006). "Cyclophosphamide versus placebo in scleroderma lung disease". N. Engl. J. Med. 354 (25): 2655–66. doi:10.1056/NEJMoa055120. PMID 16790698.
Hoyles RK, Ellis RW, Wellsbury J, et al. (December 2006). "A multicenter, prospective, randomized, double-blind, placebo-controlled trial of corticosteroids and intravenous cyclophosphamide followed by oral azathioprine for the treatment of pulmonary fibrosis in scleroderma". Arthritis Rheum. 54 (12): 3962–70. doi:10.1002/art.22204. PMID 17133610. Archived from the original on 2012-12-16.
WrongDiagnosis > Diseases » Scleroderma » Prevalence Retrieved on Dec 13, 2009
Systemic sclerosis (scleroderma) and pregnancy By Bonnie L Bermas, MD. Retrieved on Dec 13, 2009
University of maryland Medical Center > Medical Reference > Patient Education > Scleroderma - Risk Factors Harvey Simon, MD, Reviewed last on: 3/17/2009
CureResearch > Prevalence and Incidence of Scleroderma Last revision: June 13, 2003
"Juvenile Scleroderma Network". Retrieved 2008-05-11.
"Scleroderma Foundation". Retrieved 2008-05-11.
"Scleroderma Research Foundation". Retrieved 2008-05-11..
For Hope on IMDb
"Scleroderma Society".
"NHS Choices Scleroderma". Retrieved 26 September 2015.
Dinesh Khanna D, Georges GE, Couriel DR (June 25, 2014). "Autologous Hematopoietic Stem Cell Therapy in Severe Systemic Sclerosis: Ready for Clinical Practice?". JAMA. 311 (24): 2485–2487. doi:10.1001/jama.2014.6369. PMC 4926767. PMID 25058081.
van Laar JM, Farge Sont JK, ET AL., for the EBMT/EULAR Scleroderma Study Group (June 25, 2014). "Autologous Hematopoietic Stem Cell Transplantation vs Intravenous Pulse Cyclophosphamide in Diffuse Cutaneous Systemic Sclerosis: A Randomized Clinical Trial". JAMA. 311 (24): 2490–2498. doi:10.1001/jama.2014.6368. PMID 25058083.
Stem Cell Transplant vs. Cyclophosphamide (SCOT), NCT00114530 |