脊髓性肌萎缩症(SMA)是一种罕见的神经肌肉疾病,其特征在于下运动神经元的丧失和进行性肌肉萎缩,通常导致早期死亡。
这种疾病是由SMN1基因的遗传缺陷引起的,SMN1基因编码SMN,SMN是一种在所有真核细胞(即具有细胞核的细胞,包括人类细胞)中广泛表达的蛋白质,是运动神经元存活所必需的。较低水平的蛋白质导致脊髓前角中神经元细胞功能的丧失以及随后的系统范围的骨骼肌萎缩。
脊髓性肌萎缩表现出不同程度的严重程度,这些都具有共同的进行性肌肉萎缩和行动障碍。最接近躯干和呼吸肌的近端肌肉,手臂和腿部肌肉首先受到影响。其他身体系统也可能受到影响,特别是在疾病的早发型中。 SMA是婴儿死亡的最常见遗传原因。
脊髓性肌萎缩是一种遗传性疾病,以常染色体隐性方式传播。 2016年12月,nusinersen(作为Spinraza销售)成为第一种用于治疗SMA的药物,而其他几种化合物仍处于临床试验阶段。[1]
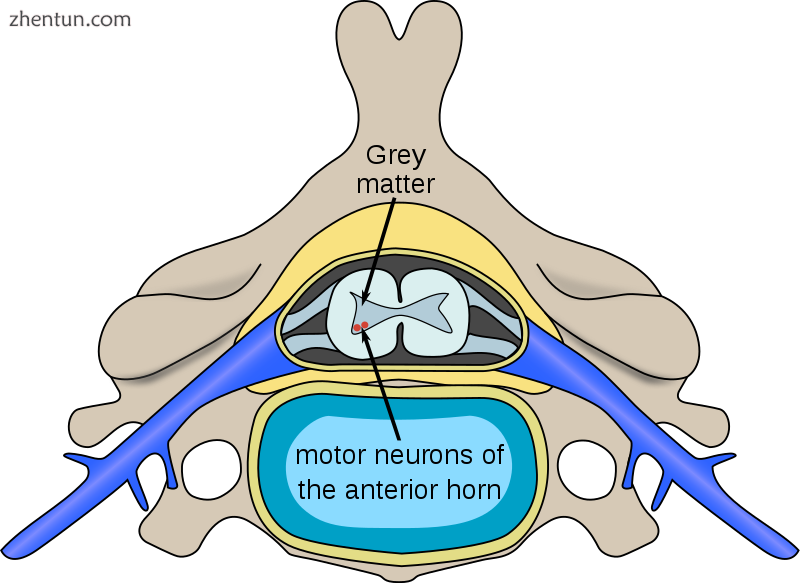
神经元的位置受脊髓脊髓性肌萎缩的影响
目录
1 分类
2 症状和体征
3 原因
4 诊断
4.1 植入前检测
4.2 产前检查
4.3 载波测试
4.4 常规筛查
5 管理
5.1 呼吸道护理
5.2 营养
5.3 骨科
5.4 流动性支持
5.5 心脏病
5.6 心理健康
5.7 药物治疗
6 预后
7 研究方向
7.1 SMN1基因置换
7.2 SMN2可选拼接调制
7.3 SMN2基因激活
7.4 SMN稳定
7.5 神经保护
7.6 肌肉恢复
7.7 干细胞
7.8 注册管理机构
8 参考
分类
SMA表现出广泛的严重程度,通过成人影响婴儿。 根据症状发作的年龄或运动发育的最高里程碑,疾病谱分为3-5种类型。
最常用的分类如下:

最严重形式的SMA I型有时被称为SMA 0型(或严重的婴儿型SMA),并且在出生时非常虚弱的婴儿中被诊断出即使在强烈的呼吸支持下它们也能存活几周。不应将SMA 0型与SMARD1相混淆,SMARD1可能具有非常相似的症状和病程但具有与SMA不同的遗传原因。
SMA患者的运动发育通常使用经过验证的功能量表进行评估 - SMA1中的CHOP INTEND(费城儿童医院神经肌肉疾病测试);在SMA类型2和3中,电机功能测量标尺或Hammersmith功能电机标尺[2] [3] [4] [5]的一些变体之一。
同名标签Werdnig-Hoffmann病(有时用单个n拼写错误)是指Johann Hoffmann和Guido Werdnig对儿童SMA的最早临床描述。同名的Kugelberg-Welander病是在Erik Klas Hendrik Ku​​gelberg(1913-1983)和Lisa Welander(1909-2001)之后,他们将SMA与肌肉萎缩症区别开来。[6]很少使用Dubowitz病(不要与Dubowitz综合症混淆)是以英国神经病学家Victor Dubowitz的名字命名的,他撰写了几篇关于中间SMA表型的研究。
体征和症状
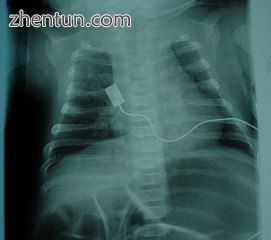
由于肋间肌萎缩和使用腹部肌肉呼吸,X射线显示钟形躯干。 钟形躯干并非特定于SMA患者
症状取决于SMA类型,疾病的阶段以及个体因素。 下面的症状和体征在严重的SMA 0 / I型中最常见:[7] [需要医疗引用]
无反射,特别是在四肢
整体肌肉无力,肌肉张力差,跛行或翻倒倾向
难以实现发展的里程碑,难以坐/站立/行走
在小孩子中:坐着时采用蛙腿位置(臀部外展,膝盖弯曲)
呼吸肌力量减弱:咳嗽微弱,哭闹(婴儿),肺部或喉咙分泌物积聚,呼吸窘迫
严重SMA型的钟形躯干(仅使用腹部肌肉进行呼吸)
舌头的颤动(抽搐)
吸吮或吞咽困难,喂养不良
原因
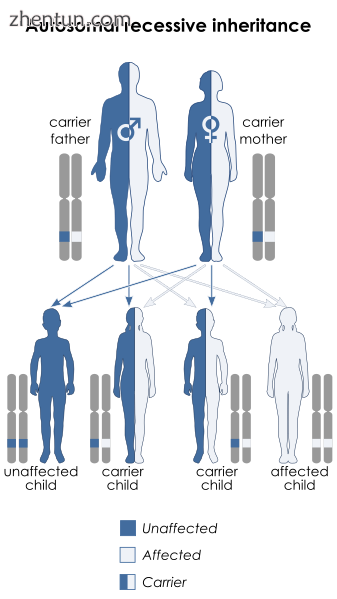
脊髓性肌萎缩具有常染色体隐性遗传模式。
脊髓性肌萎缩与SMN1基因的基因突变有关[8]。
人染色体5在位置5q13含有两个几乎相同的基因:端粒拷贝SMN1和着丝粒拷贝SMN2。在健康个体中,SMN1基因编码运动神经元蛋白(SMN)的存活,正如其名称所述,其在运动神经元的存活中起关键作用。另一方面,SMN2基因 - 由于单个核苷酸(840.C→T)的变异 - 在内含子6与外显子8的连接处经历可变剪接,仅有10-20%的SMN2转录物完全编码运动神经元蛋白(SMN-fl)的功能性存活和80-90%的转录物导致截短的蛋白质化合物(SMNΔ7)在细胞中迅速降解。[引证需要]
在受SMA影响的个体中,SMN1基因突变的方式使其无法正确编码SMN蛋白 - 由于在外显子7处发生缺失或其他点突变(经常导致SMN1的功能转换)顺序进入SMN2)。然而,几乎所有人都至少有一个SMN2基因的功能性拷贝(其中大多数具有2-4个)仍然编码少量SMN蛋白 - 约为正常水平的10-20% - 允许一些神经元存活。然而,从长远来看,SMN蛋白质的可用性降低导致脊髓前角和大脑中的运动神经元细胞逐渐死亡。依赖于这些运动神经元进行神经输入的肌肉现在已经减少了神经支配(也称为去神经支配),因此减少了来自中枢神经系统(CNS)的输入。通过运动神经元减少的脉冲传递导致失神经肌肉的收缩活动减少。因此,失神经肌肉会逐渐萎缩(废弃)。[引证需要]
下肢肌肉通常首先受到影响,其次是上肢,脊柱和颈部肌肉,更严重的是肺部和咀嚼肌。近端肌肉总是受到影响的程度比远端更大。[9]
SMA症状的严重程度与剩余SMN2基因弥补SMN1功能丧失的程度有很大关系。这部分与染色体上存在的SMN2基因拷贝数有关。虽然健康个体携带两个SMN2基因拷贝,但患有SMA的人可以具有1到4个(或更多)的任何东西,SMN2拷贝数越多,疾病严重程度越轻。因此,大多数SMA I型婴儿有一个或两个SMN2拷贝; SMA II和III的人通常至少有三个SMN2拷贝;患有SMA IV的人通常至少有四个人。然而,症状严重程度与SMN2拷贝数之间的相关性并不是绝对的,并且似乎存在影响疾病表型的其他因素。[10]
脊髓性肌萎缩以常染色体隐性遗传模式遗传,这意味着缺陷基因位于常染色体上。缺陷基因的两个拷贝 - 每个父母一个 - 需要继承这种疾病:父母可能是携带者而不是个人受影响。 SMA似乎在大约2-4%的病例中重新出现(即没有任何遗传原因)。
脊髓性肌萎缩影响所有种族的个体,不像其他众所周知的常染色体隐性遗传疾病,如镰状细胞病和囊性纤维化,其在种族群体中的发生率存在显着差异。所有类型和所有种族群体的SMA总体流行率在10,000个人中为1;基因频率约为1:100,因此,约有50人中有一人是携带者。[11] [12]作为携带者,没有已知的健康后果。只有当一个孩子受到SMA影响或SMN1基因测序时,一个人才可以学习携带者身份。
受影响的兄弟姐妹通常具有非常相似的SMA形式。然而,确实存在兄弟姐妹中不同SMA类型的发生 - 虽然很少见,但这些病例可能是由于SMN基因的额外从头缺失,不涉及NAIP基因,或SMN2拷贝数的差异。
诊断
SMA谱中最严重的表现可以通过胎儿运动减少或缺失而在妊娠晚期的母亲身上发现。症状是至关重要的(包括呼吸窘迫和喂养不良),这通常会在数周内导致死亡,与SMA(成人发病)最轻微的表型形成对比,在几十年后可能出现肌肉无力并且进展到使用轮椅但是生活期望值没有变化。[1]
促进诊断性基因检测的SMA谱更常见的临床表现:
进展性双侧肌肉无力(通常上臂和腿比手和脚更多)之前是无症状期(除了最严重的0型)[1]
在呼吸时呼吸和腹部突出时胸壁变平。
与缺乏反应相关的张力减退。
虽然上述症状指向SMA,但只能通过基因检测确认SMN1基因外显子7的双等位基因缺失,这是95%以上病例的原因。[7]基因检测通常使用血液样本进行,MLPA是更常用的基因检测技术之一,因为它也可以确定SMN2基因拷贝的数量。[7]
植入前检测
植入前遗传学诊断可用于在体外受精过程中筛选受SMA影响的胚胎。
产前检查
通过绒毛膜绒毛取样,无细胞胎儿DNA分析和其他方法,可以对SMA进行产前检测。
载波测试
那些有可能成为SMN1缺失携带者并因此有受到SMA影响的后代风险的人可以使用血液或唾液样本进行载体分析。美国妇产科学院建议所有考虑怀孕的人都要接受检查,看看他们是否是一名携带者。[13]
常规筛查
SMA的常规产前或新生儿筛查是有争议的,因为成本和疾病的严重程度。一些研究人员得出的结论是,SMA的人口筛查不具有成本效益,截至2009年,美国每例病例的成本为500万美元。[14]其他人得出结论认为,SMA符合筛选计划的标准,应向所有夫妇提供相关检测。[15]新生儿筛查的主要论点是,在SMA I型中,有一个关键时期可以开始治疗,以减少肌肉功能的丧失和营养方面的主动治疗。[7]
管理
具有SMA的个体的临床管理根据严重性/类型而变化。对具有相同类型SMA的个体患者的管理可以变化。[需要医学引证]在最严重的形式(类型0/1)中,个体具有需要及时干预的最大肌肉无力。尽管最不严重的形式(4型/成人发病),个人可能直到生命后期(数十年)才寻求护理的某些方面。虽然每种类型的SMA和个体的类型可能不同,但个人护理的具体方面可能不同。
呼吸道护理
呼吸系统是最常见的受影响系统,并发症是SMA类型0/1和2的主要死亡原因.SMA 3型可能有类似的呼吸问题,但更为罕见。[9]由于缺乏神经刺激而导致肋间肌减弱所引起的并发症。隔膜受肋间肌的影响较小。[9]一旦减弱,肌肉就不能完全恢复相同的功能,以帮助呼吸和咳嗽以及其他功能。因此,呼吸更加困难并且存在不能获得足够氧气/浅呼吸和气道分泌物清除不足的风险。当肌肉更放松时,这些问题更常发生在睡着时。咽部的吞咽肌肉可能会受到影响,导致误吸加上咳嗽机制不良会增加感染/肺炎的可能性。[16]动员和清除分泌物涉及手动或机械胸部理疗和体位引流,以及手动或机械咳嗽辅助装置。为了协助呼吸,经常使用无创通气(BiPAP),有时可以在更严重的情况下进行气管造口术; [17]尽管气管造口术可以防止言语发展,但两种通气方法都能将生存时间延长到相当的程度。[18]
营养
SMA类型越严重,就越有可能出现营养相关的健康问题。健康问题可能包括喂食困难,下巴张开,咀嚼和吞咽。有这种困难的个体可能会增加过度营养不足,茁壮成长和渴望的风险。其他营养问题,特别是非走动的个体(更严重的SMA类型),包括不能快速通过胃的食物,胃反流,便秘,呕吐和腹胀[19] 其中,它可能有必要在SMA I型和II型更严重的人进行输卵管或胃造口术[19] [20] [21]此外,SMA引起的代谢异常会损害肌肉中脂肪酸的β-氧化,并可能导致有机酸血症和随之而来的肌肉损伤,尤其是在禁食时。[22] [23]有人建议患有SMA的人,特别是那些患有更严重疾病的人,减少脂肪的摄入,避免长时间禁食(即比健康人吃得更频繁)[24]以及选择较软的食物以避免误吸。[ 16]在急性疾病期间,特别是在儿童中,营养问题可能首先出现或可能加剧现有问题(例如:误吸)以及引起其他健康问题,如电解质和血糖紊乱。[25]
骨科
与SMA肌肉较弱相关的骨骼问题包括关节紧张,活动范围有限,髋关节脱位,脊柱畸形,骨质减少,骨折和疼痛的风险增加[9]。通常稳定关节的弱肌肉,例如脊柱导致脊柱后凸和/或脊柱侧凸和关节挛缩的发展。[9]脊柱融合有时在患有SMA I / II的人中进行,一旦他们达到8-10岁,以减轻肺部变形脊柱的压力。此外,不动的个体,移动设备上的姿势和姿势以及运动范围和骨骼强化对于预防并发症也很重要。[25]患有SMA的人也可能从各种形式的物理疗法,职业疗法和物理疗法中受益匪浅。
流动性支持
矫形器可用于支撑身体并帮助行走。例如,诸如AFO(踝足矫形器)之类的矫形器用于稳定足部并辅助步态,TLSO(胸腰椎骶骨矫形器)用于稳定躯干。辅助技术可以帮助管理运动和日常活动,并大大提高生活质量。
心脏病
虽然心脏不是常规问题,但已经提出了SMA与某些心脏病之间的联系。[26] [27] [28] [29]
精神健康
SMA儿童的行为与一般人群没有差别;他们的认知发展可能会稍快一点,他们智力的某些方面也高于平均水平。[30] [31] [32]尽管他们有残疾,受SMA影响的人们仍然对生活给予高度满意。[33]
SMA中的姑息治疗已经在脊髓性肌萎缩症护理标准的共识声明中得到了标准化[9],该声明已被推荐用于全球的标准采用。
药物治疗
Nusinersen是唯一被批准用于治疗脊髓性肌萎缩症的药物。它使用鞘内注射直接给予中枢神经系统。[34]它于2017年6月由欧洲委员会以集中程序批准。[35]
预测
由于缺乏药物治疗,SMA患者会随着时间的推移而恶化。最近,严重SMA患者的生存率增加,具有积极和主动的支持性呼吸和营养支持。[36]
大多数被诊断患有0型SMA且未达到4岁的儿童,反复呼吸系统疾病是导致死亡的主要原因。[37]经过适当的护理,较温和的SMA I型病例(约占所有SMA1病例的10%)活到成年期。[38] SMA I型的长期存活率尚未得到充分证实;然而,最近呼吸支持的进展似乎降低了死亡率。[39]
在SMA II型中,疾病进展较慢,预期寿命低于健康人群。 20岁以前的死亡很常见,尽管许多SMA患者活着成为父母和祖父母。如果遵循标准治疗,SMA III型的预期寿命正常或接近正常。 IV型,成人发作的SMA通常仅表示行动障碍,不影响预期寿命。
在所有SMA类型中,物理疗法已被证明可以延缓疾病的进展。
研究方向
由于在1995年确定了SMA的潜在遗传原因,[40]已经提出并研究了几种治疗方法,主要集中在提高运动神经元中SMN蛋白的可用性。[41]主要研究方向如下:
SMN1基因替代
SMA中的基因治疗旨在通过使用病毒载体将特制的核苷酸序列(SMN1转基因)插入细胞核来恢复SMN1基因功能; scAAV-9和scAAV-10是正在研究的主要病毒载体。
只有一个项目已达到临床阶段:
AVXS-101-由Avexis(诺华公司)开发的专有生物制剂,其使用自身互补的腺相关病毒9型(scAAV-9)作为载体来递送SMN1转基因。它是静脉注射和鞘内注射制剂,前者适用于幼儿,后者适用于老年人。 2015 - 2017年进行的I期临床试验显示,与疾病的自然病程相比,治疗婴儿的静脉注射制剂有显着改善。[42]截至2019年3月,Avexis已经在欧盟,日本和美国申请了静脉注射制剂的上市许可,而且许多国家正在对这两种配方进行AVXS-101的进一步试验。[43]
在巴黎的研究所[44]和牛津大学也开展了开发SMA基因治疗的工作。在2018年,Biogen也宣布开发一种治疗SMA的基因治疗产品。[45]
SMN2替代拼接调制
该方法旨在修改SMN2基因的可变剪接,迫使其编码更高百分比的全长SMN蛋白。有时它也被称为基因转换,因为它试图将SMN2基因在功能上转化为SMN1基因。
以下剪接调节剂已达到临床阶段发展:
Branaplam(LMI070,NVS-SM1)是一种专利的小分子实验药物,由诺华公司口服给药。截至2017年10月,该化合物仍处于SMA 1型婴儿的II期临床试验中,而其他患者类别的试验正在开发中。[46]
Risdiplam(RG7916,RO7034067)是一种专利的小分子药物,由PTC Therapeutics与Hoffmann-La Roche和SMA Foundation合作开发。截至2018年9月,risdiplam已进入II期/ III期临床试验,涉及广泛的脊髓性肌萎缩,其早期结果令人鼓舞。
在已停产的临床阶段分子中,RG3039,也称为Quinazoline495,是由Repligen开发的专有喹唑啉衍生物,于2014年3月授权给辉瑞公司,该公司仅在完成I期试验后不久停产。 PTK-SMA1是由Paratek Pharmaceutical开发的四环素组的专有小分子剪接调节剂,即将于2010年进入临床开发,但从未发生过。 RG7800是一种类似于RG7916的分子,由Hoffmann-La Roche开发并于2015年在SMA患者身上进行试验,由于长期动物毒性,其发展被无限期搁置。
基础研究还发现了其他在体外修饰SMN2剪接的化合物,如原钒酸钠[47]和阿克拉霉素[48]。 Morpholino型反义寡核苷酸与nusinersen具有相同的细胞靶标,仍然是研究的主题,包括伦敦大学学院[49]和牛津大学。[50]
SMN2基因激活
该方法旨在增加SMN2基因的表达(活性),从而增加可用的全长SMN蛋白的量。
口服沙丁胺醇(沙丁胺醇)是一种流行的哮喘药物,在体外SMA中显示出治疗潜力[51]和涉及2型和3型SMA患者的三项小规模临床试验,[52] [53] [54]除了提供呼吸益处。
一些化合物最初显示出前景,但未能在临床试验中证明有效:
丁酸盐(丁酸钠和苯基丁酸钠)在体外研究中有一定的前景[55] [56] [57],但有症状的人的临床试验并没有证实它们的疗效。[58]另一项症状前1-2型婴儿的临床试验于2015年完成,但未公布结果。[59]
丙戊酸(VPA)在20世纪90年代和2000年代在实验基础上用于SMA,因为体外研究表明它具有中等效力。[60] [61]然而,当进行大型临床试验时,它在可达到的浓度下没有效果。[62] [63] [64]还有人提出,它可能对SMA患者的一部分有效,但其作用可能被其他人的脂肪酸转位抑制。[65]其他人认为它可能实际上加剧了SMA症状。[66]由于长期使用导致严重副作用的风险,目前尚未使用。 2019年的一项荟萃​​分析表明,即使没有提高功能评分,VPA也可能带来好处。[67]
羟基脲(羟基脲)在小鼠模型中显示有效[68],随后由丹麦Novo Nordisk商业研究,但在随后的临床试验中证明对SMA患者没有影响。[69]
在体外增加SMN2活性但未达到临床阶段的化合物包括生长激素,各种组蛋白去乙酰化酶抑制剂,[70]苯甲酰胺M344,[71]异羟肟酸(CBHA,SBHA,恩替司他,panobinostat,[72]曲古抑菌素A ,[73] [74] vorinostat [75]),催乳素[76]以及天然多酚化合物如白藜芦醇和姜黄素。[77] [78]塞来昔布是一种p38途径激活剂,有时在单一动物研究的基础上被SMA患者标记出来[79],但这种用途并没有得到临床阶段研究的支持。
SMN稳定
SMN稳定化旨在稳定SMNΔ7蛋白,这是由SMN2基因编码的短寿命缺陷蛋白,因此能够维持神经元细胞。[80]
没有化​​合物被用于临床阶段。在两项研究中,氨基糖苷类药物显示出增加SMN蛋白质可用性的能力。[81] [82] Indoprofen在体外提供了一些承诺。[83]
神经保护
神经保护药物旨在即使用低水平的SMN蛋白质也能够使运动神经元存活。
Olesoxime是一种专利的神经保护化合物,由法国公司Trophos开发,后来由Hoffmann-La Roche收购,在涉及2型和3型SMA的II期临床试验中显示出稳定作用。其发展于2018年停止与Spinraza的竞争以及来自开放标签扩展试验的数据差于预期。[84]
对于没有显示疗效的临床研究化合物,促甲状腺激素释放激素(TRH)在开放标签的非对照临床试验[85] [86] [87]中有一定的前景,但在随后的双盲安慰剂中无效 - 对照试验。[88]利鲁唑是一种在肌萎缩侧索硬化症中具有轻微临床益处的药物,建议在SMA中进行类似的试验,[89] [90]然而,在SMA 2型和3型[91]的2008-2010试验由于缺乏而提前停止结果令人满意。[92]
在体外研究中具有一定神经保护作用但从未进行过体内研究的化合物包括β-内酰胺类抗生素(如头孢曲松)[93] [94]和卵泡抑素[95]。
肌肉恢复
该方法旨在通过靶向肌肉组织而不是神经元来抵抗SMA的影响。
CK-2127107(CK-107)是由Cytokinetics与Astellas合作开发的骨骼肌钙蛋白激活剂。该药物旨在增加肌肉反应性,尽管神经信号降低。截至2016年10月,该分子正在青少年和成人中进行II期临床试验,其中SMA类型为2,3和4. [96]
干细胞
截至2016年,SMA干细胞治疗尚未取得重大突破。在2005年开始,美国公司California Stem Cell在SMA社区的资助下开展了一项开发基于干细胞的SMA治疗产品的实验计划。该计划于2010年停止,无法进入临床阶段,公司不久后就不复存在了。
在2013 - 2014年,意大利少数SMA1儿童在耐力骗局后接受法院规定的干细胞注射,但据报道该治疗无效。[97] [98]
虽然干细胞从未成为任何公认的SMA治疗方法的一部分,但许多私营公司(通常位于监管不严的国家)利用媒体炒作和市场干细胞注射作为治疗各种疾病的“治疗方法”。 ,包括SMA。 医学上的共识是,这些手术在承担重大风险的同时不提供临床益处,因此建议患有SMA的人反对他们。[99] [100]
登记
欧盟SMA患者可以通过将他们的详细信息输入由TREAT-NMD管理的注册管理机构参与临床研究。[101]
另见
Floppy baby syndrome
Motor neuron disease
Spinal muscular atrophies
参考
Ottesen, Eric W. (2017-01-01). "ISS-N1 makes the first FDA-approved drug for spinal muscular atrophy". Translational Neuroscience. 8 (1): 1–6. doi:10.1515/tnsci-2017-0001. PMC 5382937. PMID 28400976.
Main, M.; Kairon, H.; Mercuri, E.; Muntoni, F. (2003). "The Hammersmith Functional Motor Scale for Children with Spinal Muscular Atrophy: A Scale to Test Ability and Monitor Progress in Children with Limited Ambulation". European Journal of Paediatric Neurology. 7 (4): 155–9. doi:10.1016/S1090-3798(03)00060-6. PMID 12865054.
Krosschell, K. J.; Maczulski, J. A.; Crawford, T. O.; Scott, C.; Swoboda, K. J. (2006). "A modified Hammersmith functional motor scale for use in multi-center research on spinal muscular atrophy". Neuromuscular Disorders. 16 (7): 417–426. doi:10.1016/j.nmd.2006.03.015. PMC 3260054. PMID 16750368.
O'Hagen, J. M.; Glanzman, A. M.; McDermott, M. P.; Ryan, P. A.; Flickinger, J.; Quigley, J.; Riley, S.; Sanborn, E.; Irvine, C.; Martens, W. B.; Annis, C.; Tawil, R.; Oskoui, M.; Darras, B. T.; Finkel, R. S.; De Vivo, D. C. (2007). "An expanded version of the Hammersmith Functional Motor Scale for SMA II and III patients". Neuromuscular Disorders. 17 (9–10): 693–7. doi:10.1016/j.nmd.2007.05.009. PMID 17658255.
Glanzman, A. M.; O'Hagen, J. M.; McDermott, M. P.; Martens, W. B.; Flickinger, J.; Riley, S.; Quigley, J.; Montes, J.; Dunaway, S.; Deng, L.; Chung, W. K.; Tawil, R.; Darras, B. T.; De Vivo, D. C.; Kaufmann, P.; Finkel, R. S.; Pediatric Neuromuscular Clinical Research Network for Spinal Muscular Atrophy (PNCR) (2011). "Validation of the Expanded Hammersmith Functional Motor Scale in Spinal Muscular Atrophy Type II and III". Journal of Child Neurology. 26 (12): 1499–1507. doi:10.1177/0883073811420294. PMID 21940700.
Dubowitz, V. (2009). "Ramblings in the history of spinal muscular atrophy". Neuromuscular Disorders. 19 (1): 69–73. doi:10.1016/j.nmd.2008.10.004. PMID 18951794.
Oskoui, Darras, DeVivo (2017). "Chapter 1". Spinal Muscular Atrophy: Disease Mechanisms. Elsevier. ISBN 978-0-12-803685-3.
Brzustowicz, L. M.; Lehner, T.; Castilla, L. H.; Penchaszadeh, G. K.; Wilhelmsen, K. C.; Daniels, R.; Davies, K. E.; Leppert, M.; Ziter, F.; Wood, D.; Dubowitz, V.; Zerres, K.; Hausmanowa-Petrusewicz, I.; Ott, J.; Munsat, T. L.; Gilliam, T. C. (1990). "Genetic mapping of chronic childhood-onset spinal muscular atrophy to chromosome 5q11.2–13.3". Nature. 344 (6266): 540–1. Bibcode:1990Natur.344..540B. doi:10.1038/344540a0. PMID 2320125.
Wang, Ching (Summer 2007). "Consensus Statement for Standard of Care in Spinal Muscular Atrophy". Journal of Child Neurology. 22 (8): 1027–49. doi:10.1177/0883073807305788. PMID 17761659.
Jędrzejowska, M.; Milewski, M.; Zimowski, J.; Borkowska, J.; Kostera-Pruszczyk, A.; Sielska, D.; Jurek, M.; Hausmanowa-Petrusewicz, I. (2009). "Phenotype modifiers of spinal muscular atrophy: The number of SMN2 gene copies, deletion in the NAIP gene and probably gender influence the course of the disease". Acta Biochimica Polonica. 56 (1): 103–8. PMID 19287802.
Su, Y. N.; Hung, C. C.; Lin, S. Y.; Chen, F. Y.; Chern, J. P. S.; Tsai, C.; Chang, T. S.; Yang, C. C.; Li, H.; Ho, H. N.; Lee, C. N. (2011). Schrijver, Iris, ed. "Carrier Screening for Spinal Muscular Atrophy (SMA) in 107,611 Pregnant Women during the Period 2005–2009: A Prospective Population-Based Cohort Study". PLoS ONE. 6 (2): e17067. Bibcode:2011PLoSO...617067S. doi:10.1371/journal.pone.0017067. PMC 3045421. PMID 21364876.
Sugarman, E. A.; Nagan, N.; Zhu, H.; Akmaev, V. R.; Zhou, Z.; Rohlfs, E. M.; Flynn, K.; Hendrickson, B. C.; Scholl, T.; Sirko-Osadsa, D. A.; Allitto, B. A. (2011). "Pan-ethnic carrier screening and prenatal diagnosis for spinal muscular atrophy: Clinical laboratory analysis of >72 400 specimens". European Journal of Human Genetics. 20 (1): 27–32. doi:10.1038/ejhg.2011.134. PMC 3234503. PMID 21811307.
"Carrier Screening in the Age of Genomic Medicine – ACOG". www.acog.org. Retrieved 24 February 2017.
Little, S. E.; Janakiraman, V.; Kaimal, A.; Musci, T.; Ecker, J.; Caughey, A. B. (2010). "The cost-effectiveness of prenatal screening for spinal muscular atrophy". American Journal of Obstetrics and Gynecology. 202 (3): 253.e1–7. doi:10.1016/j.ajog.2010.01.032. PMID 20207244.
Prior, T. W.; Professional Practice Guidelines Committee (2008). "Carrier screening for spinal muscular atrophy". Genetics in Medicine. 10 (11): 840–2. doi:10.1097/GIM.0b013e318188d069. PMC 3110347. PMID 18941424.
Bodamer, olaf (November 2017). "Spinal Muscular Atrophy". uptodate.com. Retrieved December 1, 2017.
Bach, J. R.; Niranjan, V.; Weaver, B. (2000). "Spinal Muscular Atrophy Type 1: A Noninvasive Respiratory Management Approach". Chest. 117 (4): 1100–5. doi:10.1378/chest.117.4.1100. PMID 10767247.
Bach, J. R.; Saltstein, K.; Sinquee, D.; Weaver, B.; Komaroff, E. (2007). "Long-Term Survival in Werdnig–Hoffmann Disease". American Journal of Physical Medicine & Rehabilitation. 86 (5): 339–45 quiz 346–8, 379. doi:10.1097/PHM.0b013e31804a8505. PMID 17449977.
Messina, S.; Pane, M.; De Rose, P.; Vasta, I.; Sorleti, D.; Aloysius, A.; Sciarra, F.; Mangiola, F.; Kinali, M.; Bertini, E.; Mercuri, E. (2008). "Feeding problems and malnutrition in spinal muscular atrophy type II". Neuromuscular Disorders. 18 (5): 389–393. doi:10.1016/j.nmd.2008.02.008. PMID 18420410.
Chen, Y. S.; Shih, H. H.; Chen, T. H.; Kuo, C. H.; Jong, Y. J. (2011). "Prevalence and Risk Factors for Feeding and Swallowing Difficulties in Spinal Muscular Atrophy Types II and III". The Journal of Pediatrics. 160 (3): 447–451.e1. doi:10.1016/j.jpeds.2011.08.016. PMID 21924737.
Tilton, A.; Miller, M.; Khoshoo, V. (1998). "Nutrition and swallowing in pediatric neuromuscular patients". Seminars in Pediatric Neurology. 5 (2): 106–115. doi:10.1016/S1071-9091(98)80026-0. PMID 9661244.
Tein, I.; Sloane, A. E.; Donner, E. J.; Lehotay, D. C.; Millington, D. S.; Kelley, R. I. (1995). "Fatty acid oxidation abnormalities in childhood-onset spinal muscular atrophy: Primary or secondary defect(s)?". Pediatric Neurology. 12 (1): 21–30. doi:10.1016/0887-8994(94)00100-G. PMID 7748356.
Crawford, T. O.; Sladky, J. T.; Hurko, O.; Besner-Johnston, A.; Kelley, R. I. (1999). "Abnormal fatty acid metabolism in childhood spinal muscular atrophy". Annals of Neurology. 45 (3): 337–343. doi:10.1002/1531-8249(199903)45:3<337::AID-ANA9>3.0.CO;2-U. PMID 10072048.
Leighton, S. (2003). "Nutrition issues associated with spinal muscular atrophy". Nutrition & Dietetics. 60 (2): 92–96.
Apkon, Susan (Summer 2017). "SMA CARE SERIES – Musculoskeletal System" (PDF). www.curesma.org.
Rudnik-Schoneborn, S.; Heller, R.; Berg, C.; Betzler, C.; Grimm, T.; Eggermann, T.; Eggermann, K.; Wirth, R.; Wirth, B.; Zerres, K. (2008). "Congenital heart disease is a feature of severe infantile spinal muscular atrophy". Journal of Medical Genetics. 45 (10): 635–8. doi:10.1136/jmg.2008.057950. PMID 18662980.
Heier, C. R.; Satta, R.; Lutz, C.; Didonato, C. J. (2010). "Arrhythmia and cardiac defects are a feature of spinal muscular atrophy model mice". Human Molecular Genetics. 19 (20): 3906–18. doi:10.1093/hmg/ddq330. PMC 2947406. PMID 20693262.
Shababi, M.; Habibi, J.; Yang, H. T.; Vale, S. M.; Sewell, W. A.; Lorson, C. L. (2010). "Cardiac defects contribute to the pathology of spinal muscular atrophy models". Human Molecular Genetics. 19 (20): 4059–71. doi:10.1093/hmg/ddq329. PMID 20696672.
Bevan, A. K.; Hutchinson, K. R.; Foust, K. D.; Braun, L.; McGovern, V. L.; Schmelzer, L.; Ward, J. G.; Petruska, J. C.; Lucchesi, P. A.; Burghes, A. H. M.; Kaspar, B. K. (2010). "Early heart failure in the SMNΔ7 model of spinal muscular atrophy and correction by postnatal scAAV9-SMN delivery". Human Molecular Genetics. 19 (20): 3895–3905. doi:10.1093/hmg/ddq300. PMC 2947399. PMID 20639395.
Von Gontard, A.; Zerres, K.; Backes, M.; Laufersweiler-Plass, C.; Wendland, C.; Melchers, P.; Lehmkuhl, G.; Rudnik-Schöneborn, S. (2002). "Intelligence and cognitive function in children and adolescents with spinal muscular atrophy". Neuromuscular Disorders. 12 (2): 130–6. doi:10.1016/S0960-8966(01)00274-7. PMID 11738354.
Billard, C.; Gillet, P.; Signoret, J. L.; Uicaut, E.; Bertrand, P.; Fardeau, M.; Barthez-Carpentier, M. A.; Santini, J. J. (1992). "Cognitive functions in duchenne muscular dystrophy: A reappraisal and comparison with spinal muscular atrophy". Neuromuscular Disorders. 2 (5–6): 371–8. doi:10.1016/S0960-8966(06)80008-8. PMID 1300185.
Laufersweiler-Plass, C.; Rudnik-Schöneborn, S.; Zerres, K.; Backes, M.; Lehmkuhl, G.; Von Gontard, A. (2002). "Behavioural problems in children and adolescents with spinal muscular atrophy and their siblings". Developmental Medicine & Child Neurology. 45 (1): 44–9. doi:10.1017/S0012162203000082. PMID 12549754.
De Oliveira, C. M.; Araújo, A. P. D. Q. C. (2011). "Self-reported quality of life has no correlation with functional status in children and adolescents with spinal muscular atrophy". European Journal of Paediatric Neurology. 15 (1): 36–39. doi:10.1016/j.ejpn.2010.07.003. PMID 20800519.
Grant, Charley (2016-12-27). "Surprise Drug Approval Is Holiday Gift for Biogen". Wall Street Journal. ISSN 0099-9660. Retrieved 2016-12-27.
"SPINRAZA® (Nusinersen) Approved in the European Union as First Treatment for Spinal Muscular Atrophy". AFP. 2017-06-01. Retrieved 2017-06-01.
Darras, Finkel (2017). Spinal Muscular Atrophy. United Kingdom, United States: Elsevier. p. 417. ISBN 978-0-12-803685-3.
Yuan, N.; Wang, C. H.; Trela, A.; Albanese, C. T. (2007). "Laparoscopic Nissen Fundoplication During Gastrostomy Tube Placement and Noninvasive Ventilation May Improve Survival in Type I and Severe Type II Spinal Muscular Atrophy". Journal of Child Neurology. 22 (6): 727–731. doi:10.1177/0883073807304009. PMID 17641258.
Bach, J. R. (2007). "Medical Considerations of Long-Term Survival of Werdnig–Hoffmann Disease". American Journal of Physical Medicine & Rehabilitation. 86 (5): 349–55. doi:10.1097/PHM.0b013e31804b1d66. PMID 17449979.
Oskoui, M; Levy, G; Garland, C. J.; Gray, J. M.; O'Hagen, J; De Vivo, D. C.; Kaufmann, P (2007). "The changing natural history of spinal muscular atrophy type 1". Neurology. 69 (20): 1931–6. doi:10.1212/01.wnl.0000290830.40544.b9. PMID 17998484.
Lefebvre, Suzie; Bürglen, Lydie; Reboullet, Sophie; Clermont, Olivier; Burlet, Philippe; Viollet, Louis; Benichou, Bernard; Cruaud, Corinne; Millasseau, Philippe (1995). "Identification and characterization of a spinal muscular atrophy-determining gene". Cell. 80 (1): 155–165. doi:10.1016/0092-8674(95)90460-3. PMID 7813012.
d’Ydewalle, Constantin; Sumner, Charlotte J. (2015-01-29). "Spinal Muscular Atrophy Therapeutics: Where do we Stand?". Neurotherapeutics. 12 (2): 303–316. doi:10.1007/s13311-015-0337-y. PMC 4404440. PMID 25631888.
"AveXis Reports Data from Ongoing Phase 1 Trial of AVXS-101 in Spinal Muscular Atrophy Type 1".
"AveXis Announces Single-Arm Design for European Pivotal Study of AVXS-101 in SMA Type 1 Patients". Avexis. 2017-02-06.
Benkhelifa-Ziyyat, Sofia; Besse, Aurore; Roda, Marianne; Duque, Sandra; Astord, Stéphanie; Carcenac, Romain; Marais, Thibaut; Barkats, Martine (2013). "Intramuscular scAAV9-SMN Injection Mediates Widespread Gene Delivery to the Spinal Cord and Decreases Disease Severity in SMA Mice". Molecular Therapy. 21 (2): 282–290. doi:10.1038/mt.2012.261. PMC 3594018. PMID 23295949.
"Biogen Releases Community Statement on Spinraza Access and New Data | Cure SMA". www.curesma.org. Retrieved 2018-09-11.
"Novartis Releases Update on LMI070 (Branaplam) Clinical Trial". CureSMA. Retrieved 2017-10-07.
Zhang, M. L.; Lorson, C. L.; Androphy, E. J.; Zhou, J. (2001). "An in vivo reporter system for measuring increased inclusion of exon 7 in SMN2 mRNA: Potential therapy of SMA". Gene Therapy. 8 (20): 1532–8. doi:10.1038/sj.gt.3301550. PMID 11704813.
Andreassi, C.; Jarecki, J.; Zhou, J.; Coovert, D. D.; Monani, U. R.; Chen, X.; Whitney, M.; Pollok, B.; Zhang, M.; Androphy, E.; Burghes, A. H. (2001). "Aclarubicin treatment restores SMN levels to cells derived from type I spinal muscular atrophy patients". Human Molecular Genetics. 10 (24): 2841–9. doi:10.1093/hmg/10.24.2841. PMID 11734549.
Zhou, Haiyan; Meng, Jinhong; Marrosu, Elena; Janghra, Narinder; Morgan, Jennifer; Muntoni, Francesco (2015). "Repeated low doses of morpholino antisense oligomer: An intermediate mouse model of spinal muscular atrophy to explore the window of therapeutic response". Human Molecular Genetics. 24 (22): 6265–77, 6265. doi:10.1093/hmg/ddv329. PMC 4614699. PMID 26264577.
Hammond, Suzan M.; Hazell, Gareth; Shabanpoor, Fazel; Saleh, Amer F.; Bowerman, Melissa; Sleigh, James N.; Meijboom, Katharina E.; Zhou, Haiyan; Muntoni, Francesco (2016-09-27). "Systemic peptide-mediated oligonucleotide therapy improves long-term survival in spinal muscular atrophy". Proceedings of the National Academy of Sciences. 113 (39): 10962–7. doi:10.1073/pnas.1605731113. PMC 5047168. PMID 27621445.
Angelozzi, C.; Borgo, F.; Tiziano, F. D.; Martella, A.; Neri, G.; Brahe, C. (2007). "Salbutamol increases SMN mRNA and protein levels in spinal muscular atrophy cells". Journal of Medical Genetics. 45 (1): 29–31. doi:10.1136/jmg.2007.051177. PMID 17932121.
Pane, M.; Staccioli, S.; Messina, S.; d'Amico, A.; Pelliccioni, M.; Mazzone, E. S.; Cuttini, M.; Alfieri, P.; Battini, R.; Main, M.; Muntoni, F.; Bertini, E.; Villanova, M.; Mercuri, E. (2008). "Daily salbutamol in young patients with SMA type II". Neuromuscular Disorders. 18 (7): 536–540. doi:10.1016/j.nmd.2008.05.004. PMID 18579379.
Tiziano, F. D.; Lomastro, R.; Pinto, A. M.; Messina, S.; d'Amico, A.; Fiori, S.; Angelozzi, C.; Pane, M.; Mercuri, E.; Bertini, E.; Neri, G.; Brahe, C. (2010). "Salbutamol increases survival motor neuron (SMN) transcript levels in leucocytes of spinal muscular atrophy (SMA) patients: Relevance for clinical trial design". Journal of Medical Genetics. 47 (12): 856–8. doi:10.1136/jmg.2010.080366. PMID 20837492.
Morandi, L. (2013). "P.6.4 Salbutamol tolerability and efficacy in adult type III SMA patients: Results of a multicentric, molecular and clinical, double-blind, placebo-controlled study". Neuromuscular Disorders. 23 (9–10): 771. doi:10.1016/j.nmd.2013.06.475.
Chang, J. -G.; Hsieh-Li, H. -M.; Jong, Y. -J.; Wang, N. M.; Tsai, C. -H.; Li, H. (2001). "Treatment of spinal muscular atrophy by sodium butyrate". Proceedings of the National Academy of Sciences. 98 (17): 9808–13. Bibcode:2001PNAS...98.9808C. doi:10.1073/pnas.171105098. PMC 55534. PMID 11504946.
Andreassi, C.; Angelozzi, C.; Tiziano, F. D.; Vitali, T.; De Vincenzi, E.; Boninsegna, A.; Villanova, M.; Bertini, E.; Pini, A.; Neri, G.; Brahe, C. (2003). "Phenylbutyrate increases SMN expression in vitro: Relevance for treatment of spinal muscular atrophy". European Journal of Human Genetics. 12 (1): 59–65. doi:10.1038/sj.ejhg.5201102. PMID 14560316.
Brahe, C.; Vitali, T.; Tiziano, F. D.; Angelozzi, C.; Pinto, A. M.; Borgo, F.; Moscato, U.; Bertini, E.; Mercuri, E.; Neri, G. (2004). "Phenylbutyrate increases SMN gene expression in spinal muscular atrophy patients". European Journal of Human Genetics. 13 (2): 256–9. doi:10.1038/sj.ejhg.5201320. PMID 15523494.
Mercuri, E.; Bertini, E.; Messina, S.; Solari, A.; d'Amico, A.; Angelozzi, C.; Battini, R.; Berardinelli, A.; Boffi, P.; Bruno, C.; Cini, C.; Colitto, F.; Kinali, M.; Minetti, C.; Mongini, T.; Morandi, L.; Neri, G.; Orcesi, S.; Pane, M.; Pelliccioni, M.; Pini, A.; Tiziano, F. D.; Villanova, M.; Vita, G.; Brahe, C. (2007). "Randomized, double-blind, placebo-controlled trial of phenylbutyrate in spinal muscular atrophy". Neurology. 68 (1): 51–55. doi:10.1212/01.wnl.0000249142.82285.d6. PMID 17082463.
"Study to Evaluate Sodium Phenylbutyrate in Pre-symptomatic Infants With Spinal Muscular Atrophy (STOPSMA)". Retrieved 28 December 2011.
Brichta, L.; Hofmann, Y.; Hahnen, E.; Siebzehnrubl, F. A.; Raschke, H.; Blumcke, I.; Eyupoglu, I. Y.; Wirth, B. (2003). "Valproic acid increases the SMN2 protein level: A well-known drug as a potential therapy for spinal muscular atrophy". Human Molecular Genetics. 12 (19): 2481–9. doi:10.1093/hmg/ddg256. PMID 12915451.
Tsai, L. K.; Tsai, M. S.; Ting, C. H.; Li, H. (2008). "Multiple therapeutic effects of valproic acid in spinal muscular atrophy model mice". Journal of Molecular Medicine. 86 (11): 1243–54. doi:10.1007/s00109-008-0388-1. PMID 18649067.
Swoboda, K. J.; Scott, C. B.; Crawford, T. O.; Simard, L. R.; Reyna, S. P.; Krosschell, K. J.; Acsadi, G.; Elsheik, B.; Schroth, M. K.; d'Anjou, G.; Lasalle, B.; Prior, T. W.; Sorenson, S. L.; MacZulski, J. A.; Bromberg, M. B.; Chan, G. M.; Kissel, J. T.; Project Cure Spinal Muscular Atrophy Investigators Network (2010). Boutron, Isabelle, ed. "SMA CARNI-VAL Trial Part I: Double-Blind, Randomized, Placebo-Controlled Trial of L-Carnitine and Valproic Acid in Spinal Muscular Atrophy". PLoS ONE. 5 (8): e12140. Bibcode:2010PLoSO...512140S. doi:10.1371/journal.pone.0012140. PMC 2924376. PMID 20808854.
Kissel, J. T.; Scott, C. B.; Reyna, S. P.; Crawford, T. O.; Simard, L. R.; Krosschell, K. J.; Acsadi, G.; Elsheik, B.; Schroth, M. K.; d'Anjou, G.; Lasalle, B.; Prior, T. W.; Sorenson, S.; MacZulski, J. A.; Bromberg, M. B.; Chan, G. M.; Swoboda, K. J.; Project Cure Spinal Muscular Atrophy Investigators' Network (2011). Feany, Mel B., ed. "SMA CARNI-VAL TRIAL PART II: A Prospective, Single-Armed Trial of L-Carnitine and Valproic Acid in Ambulatory Children with Spinal Muscular Atrophy". PLoS ONE. 6 (7): e21296. Bibcode:2011PLoSO...621296K. doi:10.1371/journal.pone.0021296. PMC 3130730. PMID 21754985.
Darbar, I. A.; Plaggert, P. G.; Resende, M. B. D.; Zanoteli, E.; Reed, U. C. (2011). "Evaluation of muscle strength and motor abilities in children with type II and III spinal muscle atrophy treated with valproic acid". BMC Neurology. 11: 36. doi:10.1186/1471-2377-11-36. PMC 3078847. PMID 21435220.
Garbes, L.; Heesen, L.; Holker, I.; Bauer, T.; Schreml, J.; Zimmermann, K.; Thoenes, M.; Walter, M.; Dimos, J.; Peitz, M.; Brustle, O.; Heller, R.; Wirth, B. (2012). "VPA response in SMA is suppressed by the fatty acid translocase CD36". Human Molecular Genetics. 22 (2): 398–407. doi:10.1093/hmg/dds437. PMID 23077215.
Rak, K.; Lechner, B. D.; Schneider, C.; Drexl, H.; Sendtner, M.; Jablonka, S. (2009). "Valproic acid blocks excitability in SMA type I mouse motor neurons". Neurobiology of Disease. 36 (3): 477–487. doi:10.1016/j.nbd.2009.08.014. PMID 19733665.
Elshafay, Abdelrahman; Hieu, Truong Hong; Doheim, Mohamed Fahmy; Kassem, Mahmoud Attia Mohamed; ELdoadoa, Mohammed Fathi; Holloway, Sarah Keturah; Abo-elghar, Heba; Hirayama, Kenji; Huy, Nguyen Tien (2019-02-22). "Efficacy and Safety of Valproic Acid for Spinal Muscular Atrophy: A Systematic Review and Meta-Analysis". CNS Drugs. doi:10.1007/s40263-019-00606-6. ISSN 1172-7047.
Grzeschik, S. M.; Ganta, M.; Prior, T. W.; Heavlin, W. D.; Wang, C. H. (2010). "Hydroxyurea enhances SMN2 gene expression in spinal muscular atrophy cells". Annals of Neurology. 58 (2): 194–202. doi:10.1002/ana.20548. PMID 16049920.
Chen, T. – H.; Chang, J. – G.; Yang, Y. – H.; Mai, H. – H.; Liang, W. – C.; Wu, Y. – C.; Wang, H. – Y.; Huang, Y. – B.; Wu, S. – M.; Chen, Y. – C.; Yang, S. – N.; Jong, Y. – J. (2010). "Randomized, double-blind, placebo-controlled trial of hydroxyurea in spinal muscular atrophy". Neurology. 75 (24): 2190–7. doi:10.1212/WNL.0b013e3182020332. PMID 21172842.
Evans, M. C.; Cherry, J. J.; Androphy, E. J. (2011). "Differential regulation of the SMN2 gene by individual HDAC proteins". Biochemical and Biophysical Research Communications. 414 (1): 25–30. doi:10.1016/j.bbrc.2011.09.011. PMID 21925145.
Riessland, M.; Brichta, L.; Hahnen, E.; Wirth, B. (2006). "The benzamide M344, a novel histone deacetylase inhibitor, significantly increases SMN2 RNA/protein levels in spinal muscular atrophy cells". Human Genetics. 120 (1): 101–110. doi:10.1007/s00439-006-0186-1. PMID 16724231.
Garbes, L.; Riessland, M.; Hölker, I.; Heller, R.; Hauke, J.; Tränkle, C.; Coras, R.; Blümcke, I.; Hahnen, E.; Wirth, B. (2009). "LBH589 induces up to 10-fold SMN protein levels by several independent mechanisms and is effective even in cells from SMA patients non-responsive to valproate". Human Molecular Genetics. 18 (19): 3645–58. doi:10.1093/hmg/ddp313. PMID 19584083.
Narver, H. L.; Kong, L.; Burnett, B. G.; Choe, D. W.; Bosch-Marcé, M.; Taye, A. A.; Eckhaus, M. A.; Sumner, C. J. (2008). "Sustained improvement of spinal muscular atrophy mice treated with trichostatin a plus nutrition". Annals of Neurology. 64 (4): 465–470. doi:10.1002/ana.21449. PMID 18661558.
Avila, A. M.; Burnett, B. G.; Taye, A. A.; Gabanella, F.; Knight, M. A.; Hartenstein, P.; Cizman, Z.; Di Prospero, N. A.; Pellizzoni, L.; Fischbeck, K. H.; Sumner, C. J. (2007). "Trichostatin a increases SMN expression and survival in a mouse model of spinal muscular atrophy". Journal of Clinical Investigation. 117 (3): 659–671. doi:10.1172/JCI29562. PMC 1797603. PMID 17318264.
Riessland, M.; Ackermann, B.; Förster, A.; Jakubik, M.; Hauke, J.; Garbes, L.; Fritzsche, I.; Mende, Y.; Blumcke, I.; Hahnen, E.; Wirth, B. (2010). "SAHA ameliorates the SMA phenotype in two mouse models for spinal muscular atrophy". Human Molecular Genetics. 19 (8): 1492–1506. doi:10.1093/hmg/ddq023. PMID 20097677.
Farooq, F.; Molina, F. A. A.; Hadwen, J.; MacKenzie, D.; Witherspoon, L.; Osmond, M.; Holcik, M.; MacKenzie, A. (2011). "Prolactin increases SMN expression and survival in a mouse model of severe spinal muscular atrophy via the STAT5 pathway". Journal of Clinical Investigation. 121 (8): 3042–50. doi:10.1172/JCI46276. PMC 3148738. PMID 21785216.
Sakla, M. S.; Lorson, C. L. (2007). "Induction of full-length survival motor neuron by polyphenol botanical compounds". Human Genetics. 122 (6): 635–643. doi:10.1007/s00439-007-0441-0. PMID 17962980.
Dayangaç-Erden, D.; Bora, G.; Ayhan, P.; Kocaefe, Ç.; Dalkara, S.; Yelekçi, K.; Demir, A. S.; Erdem-Yurter, H. (2009). "Histone Deacetylase Inhibition Activity and Molecular Docking of (E)-Resveratrol: Its Therapeutic Potential in Spinal Muscular Atrophy". Chemical Biology & Drug Design. 73 (3): 355–364. CiteSeerX 10.1.1.515.8424. doi:10.1111/j.1747-0285.2009.00781.x. PMID 19207472.
Farooq, F.; Abadia-Molina, F.; MacKenzie, D.; Hadwen, J.; Shamim, F.; O'Reilly, S.; Holcik, M.; MacKenzie, A. (2013). "Celecoxib increases SMN and survival in a severe spinal muscular atrophy mouse model via p38 pathway activation". Human Molecular Genetics. 22 (17): 3415–24. doi:10.1093/hmg/ddt191. PMID 23656793.
Burnett, B. G.; Munoz, E.; Tandon, A.; Kwon, D. Y.; Sumner, C. J.; Fischbeck, K. H. (2008). "Regulation of SMN Protein Stability". Molecular and Cellular Biology. 29 (5): 1107–15. doi:10.1128/MCB.01262-08. PMC 2643817. PMID 19103745.
Mattis, V. B.; Rai, R.; Wang, J.; Chang, C. W. T.; Coady, T.; Lorson, C. L. (2006). "Novel aminoglycosides increase SMN levels in spinal muscular atrophy fibroblasts". Human Genetics. 120 (4): 589–601. doi:10.1007/s00439-006-0245-7. PMID 16951947.
Mattis, V. B.; Fosso, M. Y.; Chang, C. W.; Lorson, C. L. (2009). "Subcutaneous administration of TC007 reduces disease severity in an animal model of SMA". BMC Neuroscience. 10: 142. doi:10.1186/1471-2202-10-142. PMC 2789732. PMID 19948047.
Lunn, M. R.; Root, D. E.; Martino, A. M.; Flaherty, S. P.; Kelley, B. P.; Coovert, D. D.; Burghes, A. H.; Thi Man, N.; Morris, G. E.; Zhou, J.; Androphy, E. J.; Sumner, C. J.; Stockwell, B. R. (2004). "Indoprofen Upregulates the Survival Motor Neuron Protein through a Cyclooxygenase-Independent Mechanism". Chemistry & Biology. 11 (11): 1489–93. doi:10.1016/j.chembiol.2004.08.024. PMC 3160629. PMID 15555999.
Taylor, Nick P. (2018-06-01). "Roche scraps |