肺泡蛋白沉积症(PAP)是一种罕见的肺病,其特征在于肺泡内表面活性物质衍生的脂蛋白化合物的异常积聚。 累积的物质干扰正常的气体交换和肺部的扩张,最终导致呼吸困难和易患肺部感染。 PAP的原因可分为原发性和继发性原因,但最常见的原因是原发性自身免疫疾病。
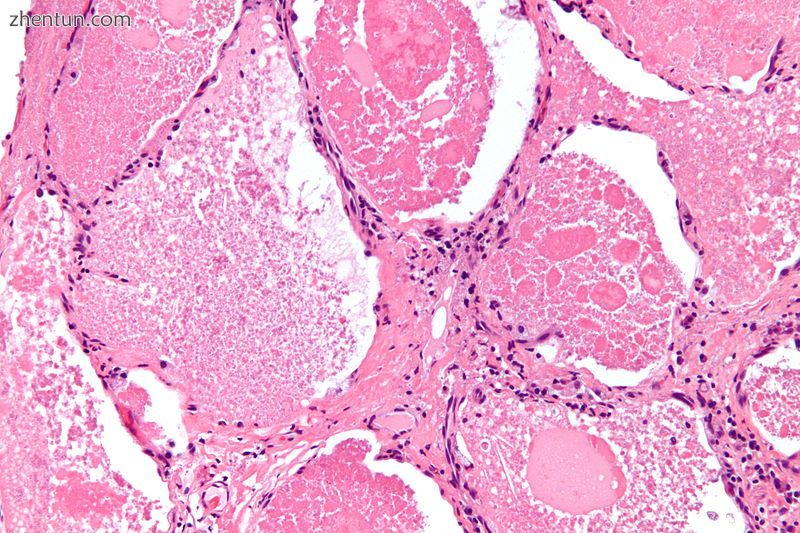
肺泡蛋白沉积症的显微照片,显示特征性空域充满局灶性密集球体,称为颤动或致密体。 H&E染色。
目录
1 症状和体征
2 原因
3 遗传学
4 诊断
5 治疗
6 流行病学
7 历史记录
8 研究
8.1 患者登记
9 参考
体征和症状
PAP的症状和体征包括呼吸短促,[1]咳嗽,低烧和体重减轻。
PAP的临床过程是不可预测的。 认识到自发缓解,并且一些患者具有稳定的症状。 由于PAP或任何潜在的相关疾病的进展,可能发生死亡。 患有PAP的个体更容易感染肺部感染,例如细菌性肺炎,鸟分枝杆菌 - 细胞内感染或真菌感染。
原因
PAP中脂蛋白化合物的异常积累是由于表面活性剂调节和清除受损。这通常与肺泡巨噬细胞功能受损有关。[2]
在成人中,PAP的最常见原因是粒细胞 - 巨噬细胞集落刺激因子(GM-CSF)的自身免疫,这是肺泡巨噬细胞发育的关键因素。降低GM-CSF的生物利用度导致肺泡巨噬细胞发育和功能不良,导致表面活性物质和相关产物的积累。[2]
PAP的次要原因是其中脂蛋白质化合物的累积继发于另一种疾病过程的那些原因。这已经在某些癌症(例如骨髓性白血病),肺部感染或环境暴露于灰尘或化学物质的环境中得到认可。
虽然最初没有理解PAP的原因,但是通过偶然观察老鼠为实验研究而缺乏血液生长因子(称为粒细胞 - 巨噬细胞集落刺激因子)(GM- CSF)发展出类似人类PAP的异常表面活性物质积累的肺综合征[3]。
这一发现的影响仍在探索中,但2007年2月报告了重大进展。该报告的研究人员讨论了PAP患者中抗GM-CSF自身抗体的存在,并将这些自身抗体输入小鼠中复制了该综合征。 [4]。
在两个亲本GATA2基因之一中的家族性或散发性失活突变产生称为GATA2缺陷的常染色体显性遗传病。 GATA2基因产生GATA2转录因子,其对于血液形成,淋巴形成和其他组织形成细胞的胚胎发育,维持和功能至关重要。具有单个GATA2失活突变的个体存在多种疾病,包括肺泡蛋白沉积症。基于GATA2突变的肺泡蛋白沉积症与正常水平的GM-CSF相关,并且通常在成功接受造血干细胞移植的患者中得到改善或避免[5] [6]。
遗传学
已显示CSF2受体α异常导致遗传性肺泡蛋白沉积症。 该基因位于5q31区域的5号染色体上。 该基因产物也称为粒细胞巨噬细胞集落刺激因子受体。[7]
诊断
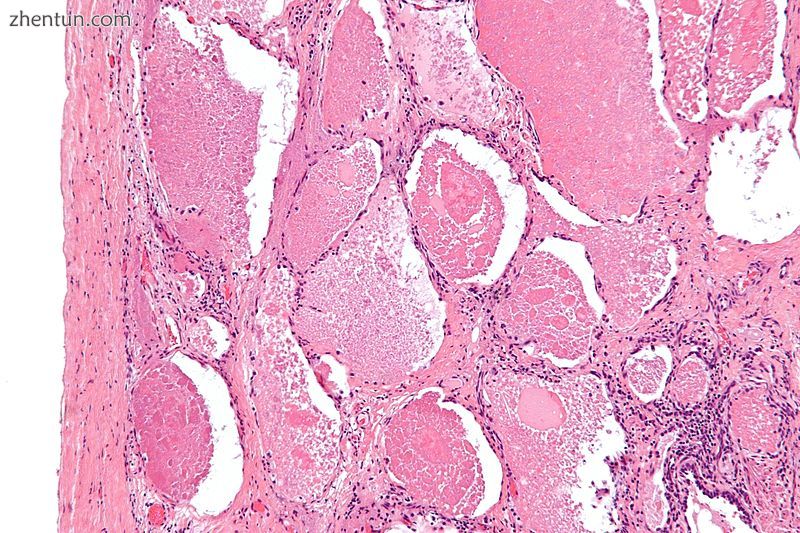
肺泡蛋白沉积症的中间放大显微照片。 H&E染色。
PAP的诊断是使用人的症状,胸部成像和肺部清洗/组织的显微镜评估的组合来进行的。血清抗GM-CSF抗体的额外检测有助于确认。[8]
尽管症状和影像学表现都是陈规定型的并且描述得很好,但它们是非特异性的,与许多其他条件无法区分。例如,胸部X光可能显示肺泡混浊,而CT可能显示“疯狂铺路”肺部模式,这两种情况在许多其他情况下更常见。[9]因此,诊断主要取决于病理学发现。
用于组织病理学分析的肺洗液或组织最常使用支气管肺泡灌洗和/或肺活检获得[10]。特征活检结果显示肺泡(有时是末端细支气管)充满无定形嗜酸性物质,其在PAS染色和PAS淀粉酶染色上染色强阳性。周围的肺泡和肺间质保持相对正常。[11]样品的电子显微镜虽然通常不是由于不切实际而进行,但显示出代表表面活性剂的层状体[12]。具有相似组织形态学发现的另一种诊断是Pneumocystis jirovicii肺炎。[12]
肺洗涤特征性地产生“乳状”组合物的流体。在显微镜下,样品在细颗粒或无定形PAS阳性材料的背景上显示20-50微米的PAS阳性小球。通常有少量巨噬细胞和炎症细胞(尽管这是可变的)。[11] [12]
治疗
PAP的标准治疗方法是全肺灌洗,[13] [14]其中肺充满无菌液体,随后除去液体和异常表面活性物质。 这通常有效地改善PAP症状,通常持续很长一段时间。
自从上面提到的小鼠发现以来,也尝试使用GM-CSF注射,并取得了不同的成功。
肺移植可以在难治性病例中进行。
流行病学
这种疾病在男性和吸烟者中更为常见。
在最近一项来自日本的流行病学研究中,[15]自身免疫性PAP的发病率和患病率高于此前报道,与吸烟,职业接触或其他疾病无关。
在儿童PAP发生之前,已经观察到内源性类脂肺炎和非特异性间质性肺炎。[16]
历史
PAP首先由医生Samuel Rosen,Benjamin Castleman和Averill Liebow于1958年[17]描述[18]。在他们于当年6月7日在新英格兰医学杂志上发表的病例系列中,他们描述了27例患者的病理证据表明,酸性希夫酸阳性物质充满了肺泡。随后认为这种富含脂质的物质是表面活性剂。
据报道,巴尔的摩退伍军人管理医院的Jose Ramirez-Rivera博士于1960年报道了使用治疗性支气管肺泡灌洗治疗PAP,他将重复的“节段性浸水”描述为物理去除积聚的肺泡材料的手段。 20]
研究
PAP是稀有肺病联盟(RLDC)目前正在研究的罕见肺病之一。 RLDC是罕见疾病临床研究网络(RDCRN)的一部分,该网络是国家推进转化科学中心(NCATS)的罕见疾病研究办公室(ORDR)的一项倡议。 RLDC致力于通过美国国立卫生研究院,患者组织和临床研究人员之间的合作,为罕见肺病患者开发新的诊断和治疗方法。
患者登记
鼓励PAP患者,家属和护理人员加入NIH Rare Lung Diseases Consortium Contact Registry。这是一个受隐私保护的网站,为有关罕见肺病的最新科学新闻,试验和治疗感兴趣的个人提供最新信息。
参考:
Shah PL, Hansell D, Lawson PR, Reid KB, Morgan C (January 2000). "Pulmonary alveolar proteinosis: clinical aspects and current concepts on pathogenesis". Thorax. 55 (1): 67–77. doi:10.1136/thorax.55.1.67. PMC 1745595. PMID 10607805.
Kumar, Anupam; Abdelmalak, Basem; Inoue, Yoshikazu; Culver, Daniel A (2018). "Pulmonary alveolar proteinosis in adults: pathophysiology and clinical approach". The Lancet Respiratory Medicine. 6 (7): 554–565. doi:10.1016/s2213-2600(18)30043-2. PMID 29397349.
Stanley E, Lieschke GJ, Grail D, et al. (June 1994). "Granulocyte/macrophage colony-stimulating factor-deficient mice show no major perturbation of hematopoiesis but develop a characteristic pulmonary pathology". Proc. Natl. Acad. Sci. U.S.A. 91 (12): 5592–6. doi:10.1073/pnas.91.12.5592. PMC 44042. PMID 8202532.
Uchida K, Beck D, Yamamoto T, Berclaz P, Abe S, Staudt M, Carey B, Filippi M, Wert S, Denson L, Puchalski J, Hauck D, Trapnell B (2007). "GM-CSF autoantibodies and neutrophil dysfunction in pulmonary alveolar proteinosis". N Engl J Med. 356 (6): 567–79. doi:10.1056/NEJMoa062505. PMID 17287477.
Crispino JD, Horwitz MS (April 2017). "GATA factor mutations in hematologic disease". Blood. 129 (15): 2103–2110. doi:10.1182/blood-2016-09-687889. PMC 5391620. PMID 28179280.
Hirabayashi S, Wlodarski MW, Kozyra E, Niemeyer CM (August 2017). "Heterogeneity of GATA2-related myeloid neoplasms". International Journal of Hematology. 106 (2): 175–182. doi:10.1007/s12185-017-2285-2. PMID 28643018.
Whitsett, JA; Wert, SE; Weaver, TE (2015). "Diseases of pulmonary surfactant homeostasis". Annual Review of Pathology. 10: 371–93. doi:10.1146/annurev-pathol-012513-104644. PMC 4316199. PMID 25621661.
Uchida K, Nakata K, Carey B, Chalk C, Suzuki T, Sakagami T, Koch DE, Stevens C, Inoue Y, Yamada Y, Trapnell BC (Jan 15, 2014). "Standardized serum GM-CSF autoantibody testing for the routine clinical diagnosis of autoimmune pulmonary alveolar proteinosis". J Immunol Methods. 402 (1–2): 57–70. doi:10.1016/j.jim.2013.11.011. PMID 24275678.
Holbert, J. M.; Costello, P.; Li, W.; Hoffman, R. M.; Rogers, R. M. (May 2001). "CT features of pulmonary alveolar proteinosis". AJR. American Journal of Roentgenology. 176 (5): 1287–1294. doi:10.2214/ajr.176.5.1761287. ISSN 0361-803X. PMID 11312196.
Monisha Das, MD & Gary A. Salzman, MD (February 2010). "Pulmonary Alveolar Proteinosis: An Overview for Internists and Hospital Physicians". Hospital Practice. 38 (1): 43–49. doi:10.3810/hp.2010.02.277. PMID 20469623.
Mikami, T.; Yamamoto, Y.; Yokoyama, M.; Okayasu, I. (December 1997). "Pulmonary alveolar proteinosis: diagnosis using routinely processed smears of bronchoalveolar lavage fluid". Journal of Clinical Pathology. 50 (12): 981–984. doi:10.1136/jcp.50.12.981. ISSN 0021-9746. PMC 500376. PMID 9516877.
Maygarden, S. J.; Iacocca, M. V.; Funkhouser, W. K.; Novotny, D. B. (June 2001). "Pulmonary alveolar proteinosis: a spectrum of cytologic, histochemical, and ultrastructural findings in bronchoalveolar lavage fluid". Diagnostic Cytopathology. 24 (6): 389–395. doi:10.1002/dc.1086. ISSN 8755-1039. PMID 11391819.
Ceruti M, Rodi G, Stella GM, et al. (2007). "Successful whole lung lavage in pulmonary alveolar proteinosis secondary to lysinuric protein intolerance: a case report". Orphanet J Rare Dis. 2: 14. doi:10.1186/1750-1172-2-14. PMC 1845139. PMID 17386098.
Menard KJ (April 2005). "Whole lung lavage in the treatment of pulmonary alveolar proteinosis". J. Perianesth. Nurs. 20 (2): 114–26. doi:10.1016/j.jopan.2005.01.005. PMID 15806528.
Inoue Y, Trapnell BC, Tazawa R, et al. (April 2008). "Characteristics of a Large Cohort of Patients with Autoimmune Pulmonary Alveolar Proteinosis in Japan". Am. J. Respir. Crit. Care Med. 177 (7): 752–62. doi:10.1164/rccm.200708-1271OC. PMC 2720118. PMID 18202348.
Antoon JW, Hernandez ML, Roehrs PA, Noah TL, Leigh MW, Byerley JS (2014). "Endogenous lipoid pneumonia preceding diagnosis of pulmonary alveolar proteinosis". Clin Respir J. 10 (2): 246–9. doi:10.1111/crj.12197. PMID 25103284.
Seymour JF, Presneill JJ (July 2002). "Pulmonary alveolar proteinosis: progress in the first 44 years". Am. J. Respir. Crit. Care Med. 166 (2): 215–35. doi:10.1164/rccm.2109105. PMID 12119235.
Rosen SH, Castleman B, Liebow AA (1958). "Pulmonary alveolar proteinosis". N. Engl. J. Med. 258 (23): 1123–1142. doi:10.1056/NEJM195806052582301. PMID 13552931.
Ramirez-Rivera J, Nyka W, McLaughlin J (1963). "Pulmonary Alveolar Proteinosis: Diagnostic Technics and Observations". New England Journal of Medicine. 268 (4): 165–71. doi:10.1056/NEJM196301242680401. PMID 13990655.
Ramirez-Rivera J, Schultz RB, Dutton RE (1963). "Pulmonary Alveolar Proteinosis: A New Technique and Rational for Treatment". Archives of Internal Medicine. 112 (3): 419–31. doi:10.1001/archinte.1963.03860030173021. |