成骨不全症(OI),也称为脆性骨病,是一组主要影响骨骼的遗传性疾病。[1] [6]它导致骨骼容易破裂。[1]严重程度可能是轻微至严重。[1]其他症状可能包括眼白的蓝色,高度短,关节松动,听力丧失,呼吸问题和牙齿问题。[1] [4]并发症可能包括颈动脉夹层和主动脉夹层。[7] [8] [9]
由于缺乏I型胶原蛋白,潜在的机制通常是结缔组织的问题。[1]由于COL1A1或COL1A2基因突变,这种情况在90%以上发生[1]。这些遗传问题通常以常染色体显性遗传方式从一个人的父母遗传,或通过新的突变发生。[1]有八种类型,其中I型最不严重,II型最严重。[1]诊断通常基于症状,可通过胶原蛋白或DNA检测确认。[4]
没有治愈方法。[4]通过锻炼和避免吸烟来维持健康的生活方式可以帮助预防骨折。[5]治疗可能包括骨折,疼痛药物,物理治疗,牙套或轮椅和手术治疗。[5]可以采取一种将金属棒穿过长骨的手术来强化它们。[5]初步证据支持使用双膦酸盐类药物。[10] [11]
OI影响了大约15,000人中的一人。[1]结果取决于疾病的类型。[4]然而,大多数人都有很好的结果。[4]自古以来就已经描述过这种情况。[12]术语“成骨不全症”于1895年开始使用,意味着不完美的骨形成。[1] [12]
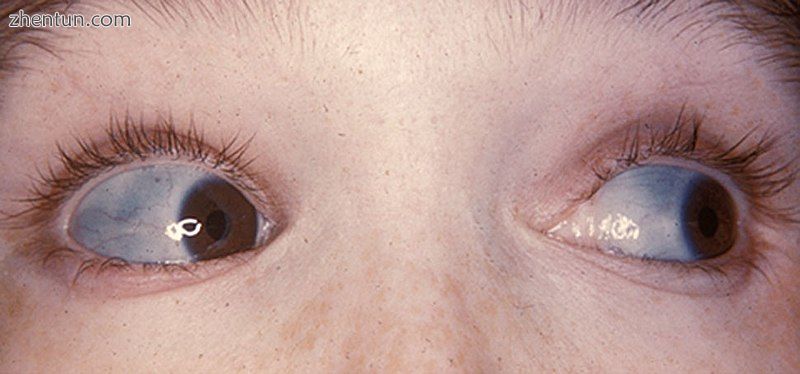
成骨不全的人的经典蓝色巩膜
目录
1 症状和体征
1.1 结缔组织
1.2 听力
1.3 神经
1.4 胃肠道
2 遗传学
2.1 I型
2.2 II型
2.3 III型
2.4 IV型
2.5 V型
2.6 VI型
2.7 VII型
2.8 VIII型
2.9 XI型
2.10 XII型
2.11XIII型
2.12 XIV型
2.13 XV型
2.14 XVI型
2.15 XVII型
2.16 其他基因
3 病理生理学
4 诊断
4.1 基因检测
4.2 鉴别诊断
5 治疗
5.1 双膦酸盐
5.2 手术
5.3 理疗
5.4 物理辅助
5.5 牙齿
6 历史
7 流行病学
8 社会和文化
8.1 澳大利亚
8.2 加拿大
9 其他动物
10 参考
体征和症状
结缔组织
OI导致非常薄的血管,也可能导致人容易受伤。肌肉的减弱将导致骨骼畸形和生长问题。在许多情况下,成骨不全可能具有未鉴定的突变,并导致更严重的OI类型,如V型和VI型。[13] V型是骨量减少和骨骼脆弱性的增加。然后,类型VI是指某人骨骼健康,但在至少六个月的衰老后,他们开始发生骨折。对于VI型,该基因是SERPINF1基因的突变,可导致常染色体隐性遗传模式。[14]
听力
听力丧失与骨质生成有关,导致小骨和内耳骨内的最终畸形。大约50%的成年人口已经受到影响,并且会比未受影响的人群更早地失去听力。[15]畸形的严重程度可以从轻微到深远。成骨术发生在生命的第二个或第三个十年。[16]
神经
Ol通常是正常的,但是具有亚型Ol的人随着时间的推移发展出基底印象(BI)。 Basilar Impression是一种向上移位的椎骨,最终软化了颅底的骨骼。[17]患有严重III型的人面临更大的风险。对于婴儿,他们看到头围更大。[18]
胃肠道
它存在于儿童和成人身上,导致脊柱,臀部和骨盆畸形,导致儿童偶尔发生便秘[19]。与胃肠有
遗传学
成骨不全症是一种导致骨折和胶原缺陷增加的遗传性疾病。发生这种疾病的主要原因是COL1A1和COL1A2基因突变的结果,这些基因负责产生1型胶原蛋白。[21]大约90%的OI患者是COL1A1和COL1A2基因突变的杂合子[22]。有几个因素是OI疾病的主要形式的结果。这些因素包括;细胞内应激,异常组织矿化,细胞与细胞之间的异常相互作用,细胞 - 基质相互作用异常,细胞基质结构受损,非胶原蛋白与胶原蛋白之间的紊乱[23]。之前的研究表明,OI是一种常染色体显性疾病,基因组中几乎没有其他变异。[24]然而,在过去的几年中,已经确定了这种疾病的常染色体隐性形式。[25]隐性形式的OI严重与胶原蛋白伴侣的缺陷有关,这些缺陷负责产生前胶原蛋白和相关蛋白的组装。[26]在OI患者中缺陷的胶原蛋白伴侣的实例包括伴侣HSP47(Cole-Carpenter综合征)和FKBP65。[27]这些分子伴侣的突变导致胶原蛋白1蛋白质的不正确折叠模式,导致隐性形式的疾病。[27]有三种显着类型的OI是胶原蛋白脯氨酰3-羟基化复合物(组分CRTAP,P3H1和CyPB)突变的结果。[27]这些成分负责修饰胶原蛋白a1(l)Pro986。[27]其他基因如SP7,SERPINF1,TMEM38B和BMP1的突变也可导致不规则形成的蛋白质和酶,导致成骨不全的隐性形式。[27]现在有与基因突变引起的其他蛋白质缺陷的联系,这些突变的功能范围从结构蛋白到酶蛋白。[24]蛋白质如色素上皮衍生因子(PEDF)和骨限制性干扰素诱导的跨膜蛋白(BRIL)之间的联系是V型和VI型成骨不全的原因。[28]这些蛋白质的缺陷导致骨矿化缺陷,这有助于形成骨质疏松症的脆性骨骼症状。[28]此外,COL1A1和COL1A2基因的突变可导致胶原蛋白中存在的细胞外基质信号传导的信号中断,从而导致疾病症状恶化。[29]最近发现了IFITM5基因的非翻译5'区域中的单点突变,并直接与OI型V相关联。[30]编码IFITM5基因上的胶原蛋白的区域中的另一个单点突变也被发现存在于具有比仅V型更严重的OI版本的患者中[30]。在一些罕见病例中,成骨不全也被视为X连锁相关遗传疾病,但仍然是一种主要的杂合性显性疾病[31]
I型
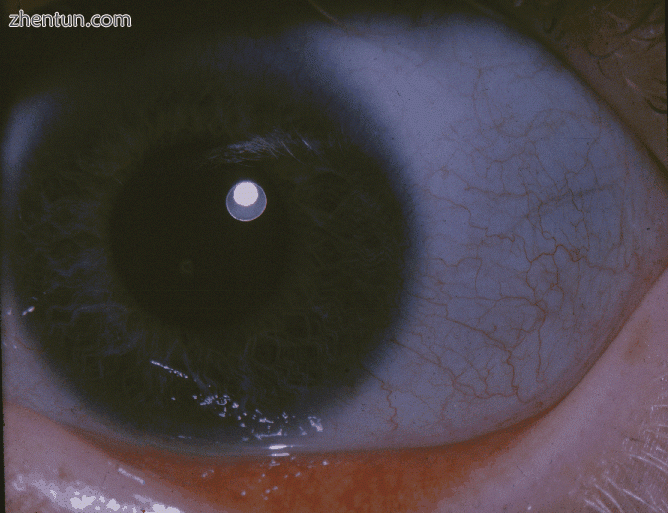
成骨不全的蓝色巩膜
胶原蛋白质量正常,但产量不足。
骨头容易骨折
轻微的脊柱弯曲
松散的关节
肌肉张力差
巩膜变色(眼睛的白色),通常给它们呈蓝灰色。 巩膜的蓝灰色是由于下面的脉络膜静脉显示出来的。 这是由于巩膜比正常更薄,因为缺陷的I型胶原蛋白形成不正确。
一些儿童早期丧失听力[34]
眼睛轻微突出
IA和IB定义为通过牙本质发生不完全的存在/存在来区分(以乳白色牙齿为特征;在IA中不存在,存在于IB中)。 与普通人群相比,预期寿命略有下降,因为可能发生致命性骨折和II I型相关并发症,如颅底凹陷。[需要引证]
II型
胶原蛋白质量或数量不足。
大多数病例由于呼吸衰竭或脑内出血而在出生后的第一年内死亡
由于肺部发育不全导致严重的呼吸系统疾病
严重的骨骼畸形和小身材
II型可以进一步细分为A,B和C组,其区别在于长骨和肋骨的射线照相评估。 IIA型表现出宽而短的长骨,带有宽而串珠的肋骨。 IIB型显示宽而短的长骨,具有很少或没有珠状的薄肋骨。 IIC型显示细长的骨骼,细长的肋骨。
III型
胶原蛋白形成不当,制成足够的胶原蛋白但是有缺陷。
骨骼容易骨折,有时甚至在出生前就会骨折
骨骼畸形,通常很严重
呼吸问题可能
身材矮小,脊柱弯曲,有时还有桶形肋骨
三角脸[35]
松散的关节(双关节)
手臂和腿部肌肉张力差
巩膜变色(眼睛的“白色”为蓝色)
早期失去听力可能
III型在其他分类中被区分为“进行性变形”类型,其中新生儿在出生时表现出轻微症状并且在整个生命中出现上述症状。 Lifespans可能是正常的,尽管有严重的身体障碍。
IV型
胶原蛋白量足够,但质量不够高
骨骼容易骨折,特别是在青春期之前
身材矮小,脊柱弯曲,桶形肋骨
骨骼畸形轻微至中度
早期失去听力
与I型相似,IV型可进一步细分为IVA和IVB型,其特征在于缺乏(IVA)或存在(IVB)牙本质发育不全。
V型
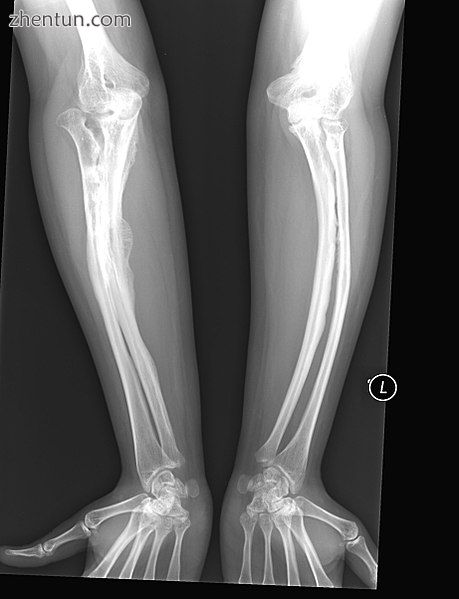
OI V型成人
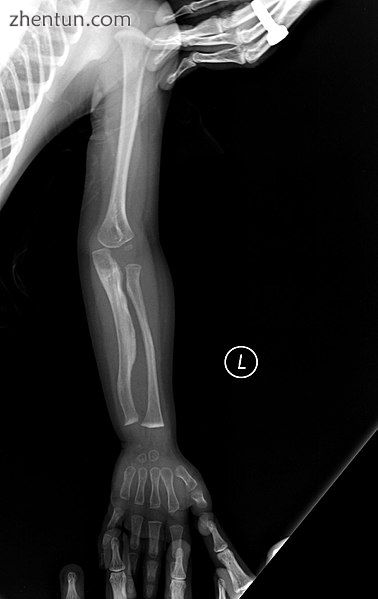
OI V型儿童
具有与IV型相同的临床特征,其在组织学上通过“网状”骨外观来区分。进一步的特征在于“V三联体”由a)与生长板相邻的不透射线带组成,b)骨折部位的肥厚性愈伤组织,和c)放射性尺骨间骨膜的钙化[36]。
OI V型导致两个前臂骨之间的膜钙化,使得难以转动手腕。另一个症状是骨折部位异常大量的修复组织(增生性愈伤组织)。这种情况的其他特征包括桡骨头脱位,长骨弯曲和混合性听力损失。
至少有一些此类病例是由IFITM5基因突变引起的。[33]
VI型
具有与IV型相同的临床特征,其在组织学上通过“鱼鳞”骨外观来区分。最近发现VI型是由SERPINF1基因的功能丧失突变引起的。 SERPINF1是serpin家族的成员,也被称为色素上皮衍生因子(PEDF),是哺乳动物中最强大的内源性抗血管生成因子。
VII型
2006年,发现了一种名为“VII型”的隐性形式(表型严重致死)。到目前为止,它似乎仅限于魁北克的原住民。[37] CRTAP基因的突变导致了这种类型。[38]
VIII型
由LEPRE1基因突变引起的OI被归类为VIII型。[38]
XI型
由染色体17q21上的FKBP10突变引起的OI。[39]突变导致三聚原胶原分子的分泌减少。这些突变也可引起与OI相似的常染色体隐性Bruck综合征。
XII型
由SP7中的移码突变引起的OI。这种突变导致骨骼畸形,骨折和牙齿萌出延迟。[40]
XIII型
由骨形态发生蛋白1(BMP1)基因突变引起的OI [41] [42]这种突变导致复发性骨折,高骨量和过度伸展的关节。[43]
XIV型
由TMEM38B基因突变引起的OI。这种突变导致复发性骨折和骨质减少。
XV型
由染色体12q13上的WNT1基因中的纯合或复合杂合突变引起的OI。它是常染色体隐性遗传。[44] [43]
XVI型
由CREB3L1基因突变引起的OI。这种突变导致肋骨和长骨复发性骨折的产前发作,脱矿质,颅骨骨化减少和蓝色巩膜。对于OI XVI杂合的家庭成员可能有复发性骨折,骨质减少和蓝色巩膜。[44]
XVII型
其他基因
据报道,具有隐性成骨不全的家族在染色体9上的TMEM38B基因中具有突变。[45]该基因编码TRIC-B,TRIC-B是TRIC的组分,TRIC是参与细胞内储存的钙释放的单价阳离子特异性通道。
很可能还有其他与该疾病相关的基因尚未被报道。
病理生理学
患有OI的人天生就有缺陷的结缔组织,或者没有生产能力,通常是因为I型胶原蛋白缺乏。[46]这种缺陷起因于胶原三螺旋结构中甘氨酸的氨基酸取代为较大的氨基酸。较大的氨基酸侧链产生空间位阻,在胶原复合物中产生凸起,进而影响分子纳米力学和分子之间的相互作用,这两者都受到损害。[47]结果,身体可能通过水解不适当的胶原结构而作出反应。如果身体没有破坏不正确的胶原蛋白,胶原纤维和羟基磷灰石晶体之间形成骨骼的关系会发生变化,导致脆性。[48]另一个建议的疾病机制是胶原纤维内的应力状态在突变位置发生改变,其中局部较大的剪切力导致即使在中等负荷下原纤维快速失效,因为在健康的胶原原纤维中发现的均匀应力状态丧失了[47]。 ]这些最近的研究表明,OI必须被理解为一种多尺度现象,其涉及组织的遗传,纳米,微观和宏观水平的机制。大多数患有OI的人从父母那里收到它,但在35%的情况下,它是个体(从头或“零星”)突变。
诊断
诊断通常基于医学成像,包括普通X光和症状。医学影像学的迹象包括所有极端和脊柱的异常。[49]可以通过DNA或胶原蛋白测试来确认OI诊断,但是在许多情况下,创伤小并且存在其他临床特征(例如蓝色巩膜)的骨折的发生足以用于诊断。可以进行皮肤活组织检查以确定I型胶原的结构和数量。 DNA测试可以确认诊断,但是,它不能排除它,因为并非所有导致OI的突变都是已知和/或测试的。 OI II型通常在怀孕期间通过超声诊断,其中可能存在多个骨折和其他特征。相对于对照,OI皮质骨显示增加的孔隙度,管道直径和微型计算机断层扫描中的连通性。[50]通过使用体外基因检测技术,通常可以在出生前检测到严重类型的OI。[51]
基因检测
为了确定是否存在成骨不全症,可以进行COL1A1,COL1A2和IFITM5基因的基因测序。[52] [53]还建议怀疑孩子患有OI的父母进行复制和删除测试。[52]由重复和缺失引起的移码突变的存在通常是疾病中严重程度增加的原因。[52]
鉴别诊断
OI的一个重要鉴别诊断是虐待儿童,因为两者都可能在不同的愈合阶段出现多处骨折。区分它们可能是困难的,尤其是当不存在OI的其他特征时。其他鉴别诊断包括佝偻病,骨软化症和其他罕见的骨骼综合征。
治疗
没有治愈方法。[4]通过锻炼和避免吸烟来维持健康的生活方式可以帮助预防骨折。治疗可能包括护理骨折,止痛药,理疗,牙箍或轮椅以及手术。可以采取一种将金属棒穿过长骨的手术来强化它们。[5]
使用适当的抗生素和防腐剂治疗骨感染。
双膦酸盐
1998年,一项临床试验证明了静脉注射帕米膦酸盐的有效性,这是一种双膦酸盐,以前曾在成人中用于治疗骨质疏松症。在严重的OI中,帕米膦酸盐减轻了骨痛,预防了新的椎骨骨折,重新塑造了先前骨折的椎体,并减少了长骨骨折的数量。[54]
虽然口服双膦酸盐更方便和更便宜,但它们也不被吸收,并且静脉注射双膦酸盐通常更有效,尽管这正在研究中。一些研究发现口服和静脉注射双膦酸盐,如口服阿仑膦酸盐和静脉注射帕米膦酸盐,相当于[55]。在一项对轻度OI患儿的试验中,口服利塞膦酸盐可增加骨矿物质密度,减少非椎骨骨折。然而,它并没有减少新的椎骨骨折。[56] [57] 2016年的一项Cochrane评价得出结论,尽管双膦酸盐似乎可以改善骨矿物质密度,但不确定这是否会导致骨折减少或成骨不全患者的生活质量改善。[11]
双膦酸盐对成人的OI效果较差[58]。
手术
金属棒可以手术插入长骨中以提高强度,这是由芝加哥Shriners医院儿童医院的Harold A. Sofield医学博士开发的一种手术。在20世纪40年代后期,芝加哥Shriners医院的办公室主任Sofield在那里与大量的OI儿童一起工作,并尝试了各种方法来加强这些儿童的骨骼。[59] 1959年,Sofield与医学博士Edward A. Miller一起撰写了一篇开创性的文章,描述了当时看似激进的解决方案:将不锈钢棒放入长骨的髓内管中以稳定和加强它们。他的治疗证明在康复和预防骨折方面非常有用;它被全世界采用,仍然是OI骨科治疗的基础。
可以进行脊柱融合以纠正脊柱侧凸,尽管固有的骨脆性使得这种手术在OI患者中更复杂。如果施加在脊髓和脑干上的压力引起神经问题,则可以进行基底印模手术。
理疗
物理疗法用于以温和的方式加强肌肉和改善运动,同时最小化骨折的风险。这通常涉及水疗,轻度阻力练习以及使用支撑垫来改善姿势。鼓励个体在一天中定期更换姿势,以平衡所使用的肌肉和受压的骨骼。
通常建议锻炼。[60]
物理辅助
通过拐杖,动力轮椅,夹板,抓臂或家庭改装等自适应设备,许多患有OI的人可以保持很大程度的自主性。
牙
超过两分之一的OI患者也有牙本质发育不全症(DI) - 一种先天性牙本质形成障碍。[61]由于OI,牙齿治疗可能由于各种畸形,骨骼和牙齿而成为挑战。患有OI的儿童应在牙齿爆发后立即进行牙科检查,这可以最大限度地减少因牙本质异常导致的牙齿结构损失,并应定期监测牙齿以保护牙齿和口腔健康。[61]
许多OI患者接受双膦酸盐治疗,当患者服用BP时,牙科手术有几种并发症,即双膦酸盐相关的颌骨坏死(BRONJ)。
历史
这些条件或类型多年来和不同国家都有其他各种名称。一些最常见的替代方案是Ekman-Lobstein综合征,Vrolik综合征和口语玻璃骨病。成骨不全的名称至少可以追溯到1895年[62],并且是20世纪至今的常用医学术语。目前的四种类型系统始于1979年的Sillence。[63]一个较旧的系统认为不太严重的类型“成骨不全性tarda”,而更严重的形式被认为是“成骨不全先天性”。[64]由于这个术语在类型之间没有很好地区分,并且所有形式的成骨都是先天性的,这种命名惯例有因为失宠了。
这种情况在公元前1000年的古埃及木乃伊中被发现。挪威国王Ivar the Boneless也可能有这种情况。最早的研究始于1788年,由瑞典人Olof Jakob Ekman开始。他在博士论文中描述了这种情况,并提到了它可以追溯到1678年的情况。1831年,埃德蒙·阿克斯曼在自己和两个兄弟中描述了它。 Jean Lobstein于1833年在成年人中处理过它.Willem Vrolik在19世纪50年代确实研究过这种情况。 1897年Martin Benno Schmidt提出了成人和新生儿形式相同的观点。[65]
流行病学
在美国,成骨不全症的发病率估计为每2万活产一个。[66]在美国,估计有2万到5万人受到OI的影响。
不同群体的频率大致相同,但由于未知原因,津巴布韦的Shona和Ndebele似乎比其他群体在III型和I型中的比例更高。[67]在尼日利亚和南非人群中也发现了类似的模式。[引证需要]在这些不同的案例中,所有四种类型的OI总数与其他任何种族大致相同。
社会与文化
另请参见:成骨不全症患者名单
澳大利亚
澳大利亚OI协会成立于1977年。目的是提供有关疾病的信息,支持研究,并向公众宣传患有骨质疏松症的患者。该基金会每两年举行一次会议,讨论教育活动并支持Wishbone Day。[68]
加拿大
加拿大成骨不全症协会成立于1983年,是一个国际非营利组织,帮助受OI影响的人提供协助生活。他们提供情感支持,培养和支持加拿大医学研究所涉及的所有类型的OI的原因。该组织还为公众保存和更新医学研究和这种疾病的发现库。[69]
其他动物
在狗中,OI是一种常染色体隐性疾病,这意味着具有两份等位基因的狗会受到影响。[70] Beagles,Standard Wirehaired Dachshunds,Golden Retrievers,Poodles,Bedlington Terrier,Norwegian Elkhounds,以及标准和微型光滑头发的腊肠犬都被认为是OI的可能携带者,以及老鼠和一些鱼类。[70]在金毛猎犬中,它是由COL1A1和Beagles(COL1A2)中的突变引起的。已发现SERPINH1基因中的单独突变会导致腊肠犬的病情[71]。许多品种组织和兽医提供OI测试来判断狗是否是OI的携带者。对OI杂合的狗只应该与非携带者交配。绝不应该繁殖纯合子携带者,除非是非携带者。[72]
OI的动物模型对于其人类对应物的诊断,治疗和可能的治愈是至关重要的。用于动物的实验性治疗和疗法在成功治疗人类OI中起着重要作用。[73]尽管狗,小鼠,鱼和人类在遗传上并不相同,但一些动物模型已被官方认可为代表人类不同类型的OI。对动物治疗的研究与人类治疗OI的成功并行。[73]
参考
"osteogenesis imperfecta". Genetics Home Reference. 11 October 2016. Archived from the original on 18 October 2016. Retrieved 15 October 2016.
William, Berger (2006). Andrews' Diseases of the Skin: Clinical Dermatology (10th ed.). Saunders. p. 517. ISBN 978-0721629216.
"Brittle Bone Disorder". 1996. Retrieved 6 November 2018.
"Osteogenesis Imperfecta Overview". NIAMS. June 2015. Archived from the original on 18 October 2016. Retrieved 15 October 2016.
"What Is Osteogenesis Imperfecta? Fast Facts: An Easy-to-Read Series of Publications for the Public". NIAMS. November 2014. Archived from the original on 18 October 2016. Retrieved 15 October 2016.
"Osteogenesis imperfecta". rarediseases.info.nih.gov. Retrieved 2018-04-17.
Grond-Ginsbach, C; Debette, S; Pezzini, A (2005). Genetic approaches in the study of risk factors for cervical artery dissection. Frontiers of Neurology and Neuroscience. 20. pp. 30–43. doi:10.1159/000088133. ISBN 978-3-8055-7986-5. PMID 17290109.
Grond-Ginsbach, C; Debette, S (March 2009). "The association of connective tissue disorders with cervical artery dissections". Current Molecular Medicine. 9 (2): 210–4. doi:10.2174/156652409787581547. PMID 19275629.
McNeeley, MF; Dontchos, BN; Laflamme, MA; Hubka, M; Sadro, CT (December 2012). "Aortic dissection in osteogenesis imperfecta: case report and review of the literature". Emergency Radiology. 19 (6): 553–6. doi:10.1007/s10140-012-1044-1. PMID 22527359.
Harrington, J; Sochett, E; Howard, A (December 2014). "Update on the evaluation and treatment of osteogenesis imperfecta". Pediatric Clinics of North America. 61 (6): 1243–57. doi:10.1016/j.pcl.2014.08.010. PMID 25439022.
Dwan, K; Phillipi, CA; Steiner, RD; Basel, D (19 October 2016). "Bisphosphonate therapy for osteogenesis imperfecta". The Cochrane Database of Systematic Reviews. 10: CD005088. doi:10.1002/14651858.CD005088.pub4. PMID 27760454.
Kelly, Evelyn B. (2012). Encyclopedia of Human Genetics and Disease. ABC-CLIO. p. 613. ISBN 9780313387135. Archived from the original on 2017-11-05.
"Online Mendelian Inheritance in Man". 2012-03-28. Retrieved 2 November 2018.
Homan, E (2012-03-27). "Journal of Bone and Mineral". Journal of Bone and Mineral Research. 26 (12): 2798–2803. doi:10.1002/jbmr.487. PMC 3214246. PMID 21826736.
Vernick, David (2005-11-02). "OI Issues: Hearing Loss". Retrieved 4 November 2018.
Senn, A (2012). "Genetic Heterogeneity in Osteogenesis Imperfecta". Otology & Neurotology. 33 (9): 1562–1566. doi:10.1097/MAO.0b013e31826bf19b. PMC 3498599. PMID 22996160.
Dixon, Andrew (2005). "Basilar Investigation". Retrieved 5 November 2018.
Hoggard, N (2012-12-01). "Craniospinal Abnormalities and Neurologic Complications of Osteogenesis Imperfecta: Imaging Overview". Radiographics. 32 (7): 2101–12. doi:10.1148/rg.327125716. PMID 23150860.
Lee, JH (September 1995). "Gastrointestinal Problems". The Journal of Bone and Joint Surgery. American Volume. 77 (9): 1352–6. doi:10.2106/00004623-199509000-00010. PMID 7673285.
Dilsa, Mizrak (10 December 2014). "Osteogenesis Imperfecta, Pseudoachalasia, and Gastric Cancer". Retrieved 6 November 2018.
Palomo T, Vilaça T, Lazareto-castro M (1 December 2017). "Osteogenesis imperfecta: diagnosis and treatment". Current Opinion in Endocrinology, Diabetes and Obesity. 24 (6): 381–388. doi:10.1097/MED.0000000000000367. PMID 28863000.
Valadares FR, Carneiro TB, Santos PM, Oliveira AC, Zabel B (18 July 2014). "What is new in genetics and osteogenesis imperfecta classification?". J Pediatr (Rio J). 90 (6): 536–541. doi:10.1016/j.jped.2014.05.003. PMID 25046257.
Forlino A, Cabral WA, Barnes AM, Marini JC (14 June 2011). "New perspectives on osteogenesis imperfecta". Nat Rev Endocrinol. 7 (9): 540–557. doi:10.1038/nrendo.2011.81. PMC 3443407. PMID 21670757.
Forlino A, Marini JC (16 April 2016). "Osteogenesis imperfecta". Lancet. 387 (10028): 1657–1671. doi:10.1016/S0140-6736(15)00728-X. PMID 26542481.
Drögemüller C, Becker D, Brunner A, Haase B, Kircher P, Seeliger F, Fehr M, Baumann U, Lindblad-Toh K, Leeb T (2009). Barsh GS, ed. "A Missense Mutation in the SERPINH1 Gene in Dachshunds with Osteogenesis Imperfecta". PLoS Genetics. 5 (7): e1000579. doi:10.1371/journal.pgen.1000579. PMC 2708911. PMID 19629171.
Rohrbach M, Giunta C (12 July 2012). "Recessive osteogenesis imperfecta: clinical, radiological, and molecular findings". Am J Med Genet C Semin Med Genet. 160C(3) (3): 175–189. doi:10.1002/ajmg.c.31334. PMID 22791419.
Marini JC, Blissett AR (14 June 2014). "New genes in bone development: what's new in osteogenesis imperfecta". J Clin Endocrinol Metab. 98 (8): 3095–3103. doi:10.1210/jc.2013-1505. PMC 3733862. PMID 23771926.
Marini JC, Reich A, Smith SM (August 2014). "Osteogenesis imperfecta due to mutation in non-collagenous genes: lessons in the biology of bone formation". Current Opinion in Pediatrics. 26 (4): 500–507. doi:10.1097/MOP.0000000000000117. PMC 4183132. PMID 25007323.
Lim J, Grafe L, Alexander S, Lee B (15 February 2017). "Genetic causes and mechanisms of Osteogenesis Imperfecta". Bone. 102: 40–49. doi:10.1016/j.bone.2017.02.004. PMC 5607741. PMID 28232077.
Hanagata N (2 June 2015). "IFITM5 mutations and osteogenesis imperfecta". J Bone Miner Metab. 34 (2): 123–131. doi:10.1007/s00774-015-0667-1. PMID 26031935.
Marini JC, Forlino A, Bächinger HP, Bishop NJ, Byers PH, et al. (18 August 2018). "Osteogenesis imperfecta". Nat Rev Dis Primers. 3: 17052. doi:10.1038/nrdp.2017.52. PMID 28820180.
Steiner RD, Pepin MG, Byers PH, Pagon RA, Bird TD, Dolan CR, Stephens K, Adam MP (January 28, 2005). "Osteogenesis Imperfecta". University of Washington, Seattle. PMID 20301472. Archived from the original on 18 January 2017. Retrieved 26 March 2012. |chapter= ignored (help)
Shapiro JR, Lietman C, Grover M, Lu JT, Nagamani SC, Dawson BC, Baldridge DM, Bainbridge MN, Cohn DH, Blazo M, Roberts TT, Brennen FS, Wu Y, Gibbs RA, Melvin P, Campeau PM, Lee BH (2013). "Phenotypic variability of osteogenesis imperfecta type V caused by an IFITM5 mutation". J. Bone Miner. Res. 28 (7): 1523–30. doi:10.1002/jbmr.1891. PMC 3688672. PMID 23408678.
Fuller E, Lin V, Bell M, Bharatha A, Yeung R, Aviv RI, Symons SP (2011). "Case of the month #171: osteogenesis imperfecta of the temporal bone". Can Assoc Radiol J. 62 (4): 296–8. doi:10.1016/j.carj.2010.04.002. PMID 22018338.
Page 771 Archived 2013-06-08 at the Wayback Machine in: Chen, Harold (2006). Atlas of genetic diagnosis and counseling. Totowa, NJ: Humana Press. ISBN 978-1-58829-681-8.
Glorieux FH, Rauch F, Plotkin H, Ward L, Travers R, Roughley P, Lalic L, Glorieux DF, Fassier F, Bishop NJ (2000). "Type V osteogenesis imperfecta: a new form of brittle bone disease". J. Bone Miner. Res. 15 (9): 1650–8. doi:10.1359/jbmr.2000.15.9.1650. PMID 10976985.
"Recessive Form of OI Discovered by Foundation-funded Researcher" (PDF). Archived (PDF) from the original on 2007-08-12.
Genetics Home Reference Archived 2008-12-19 at the Wayback Machine: Genetic Conditions > Osteogenesis imperfecta (Reviewed November 2007)
"OMIM Entry - # 610968 - OSTEOGENESIS IMPERFECTA, TYPE XI; OI11". www.omim.org. Retrieved 2018-11-11.
Sam, JE; Dharmalingam, M (2017). "Osteogenesis Imperfecta". Indian Journal of Endocrinology and Metabolism. 21 (6): 903–908. doi:10.4103/ijem.IJEM_220_17. PMC 5729682. PMID 29285457.
"OMIM Entry # 616229 - OSTEOGENESIS IMPERFECTA, TYPE XVI; OI16". www.omim.org. Retrieved 2018-11-11.
Shapiro, Jay R. (2014), "Clinical and Genetic Classification of Osteogenesis Imperfecta and Epidemiology", Osteogenesis Imperfecta, Elsevier, pp. 15–22, doi:10.1016/b978-0-12-397165-4.00002-2, ISBN 9780123971654
Sam, JustinEasow; Dharmalingam, Mala (2017-11-01). "Osteogenesis Imperfecta". Indian Journal of Endocrinology and Metabolism. 21 (6): 903–908. doi:10.4103/ijem.IJEM_220_17. PMC 5729682. PMID 29285457.
"Springer Reference", SpringerReference, Springer-Verlag, 2011, doi:10.1007/springerreference_36173 |chapter= ignored (help)
Volodarsky M, Markus B, Cohen I, Staretz-Chacham O, Flusser H, Landau D, Shelef I, Langer Y, Birk OS (2013). "A deletion mutation in TMEM38B associated with autosomal recessive osteogenesis imperfecta". Hum Mutat. 34 (4): 582–6. doi:10.1002/humu.22274. PMID 23316006.
Rauch F, Glorieux FH (2004). "Osteogenesis imperfecta". Lancet. 363 (9418): 1377–85. doi:10.1016/S0140-6736(04)16051-0. PMID 15110498.
Gautieri A, Uzel S, Vesentini S, Redaelli A, Buehler MJ (2009). "Molecular and mesoscale disease mechanisms of Osteogenesis Imperfecta". Biophysical Journal. 97 (3): 857–865. doi:10.1016/j.bpj.2009.04.059. PMC 2718154. PMID 19651044.
"Osteogenesis Imperfecta Foundation: Fast Facts". Archived from the original on 2007-06-28. Retrieved 2007-07-05.
EL-Sobky, TA; Shawky, RM; Sakr, HM; Elsayed, SM; Elsayed, NS; Ragheb, SG; Gamal, R (15 November 2017). "A systematized approach to radiographic assessment of commonly seen genetic bone diseases in children: A pictorial review". J Musculoskelet Surg Res. 1 (2): 25. doi:10.4103/jmsr.jmsr_28_17.
3D micron-scale imaging of the cortical bone canal network in human osteogenesis imperfecta (OI) | Medical Imaging 2013: Biomedical Applications in Molecular, Structural, and ... Archived 2015-04-19 at the Wayback Machine
Westgren M, Götherström c (3 June 2015). "Stem cell transplantation before birth - a realistic option for treatment of osteogenesis imperfecta?". Prenat Diagn. 35 (9): 827–832. doi:10.1002/pd.4611. PMID 25962526.
Pepin MG, Byers PH (14 November 2015). "What every clinical geneticist should know about testing for osteogenesis imperfecta in suspected child abuse cases". Am J Med Genet C Semin Med Genet. 169 (4): 307–313. doi:10.1002/ajmg.c.31459. PMID 26566591.
"Is Osteogenesis Imperfecta Inherited?". 4 April 2014. Retrieved 7 November 2018.
Glorieux FH, Bishop NJ, Plotkin H, Chabot G, Lanoue G, Travers R (1998). "Cyclic administration of pamidronate in children with severe osteogenesis imperfecta". N. Engl. J. Med. 339 (14): 947–52. doi:10.1056/NEJM199810013391402. PMID 9753709.Free full text
DiMeglio LA, Peacock M (2006). "Two-year clinical trial of oral alendronate versus intravenous pamidronate in children with osteogenesis imperfecta". J. Bone Miner. Res. 21 (1): 132–40. doi:10.1359/JBMR.051006. PMID 16355282.
Bishop Nick (2013). "Risedronate in children with osteogenesis imperfecta: a randomised, double-blind, placebo-controlled trial". Lancet. 382 (9902): 1424–1432. doi:10.1016/S0140-6736(13)61091-0. PMID 23927913.
Ward Leanne M (2013). "Oral bisphosphonates for paediatric osteogenesis imperfecta?". Lancet. 382 (9902): 1388–1389. doi:10.1016/S0140-6736(13)61531-7. PMID 23927912.
Chevrel G, Schott AM, Fontanges E, Charrin JE, Lina-Granade G, Duboeuf F, Garnero P, Arlot M, Raynal C, Meunier PJ (2006). "Effects of oral alendronate on BMD in adult patients with osteogenesis imperfecta: a 3-year randomized placebo-controlled trial". J. Bone Miner. Res. 21 (2): 300–6. doi:10.1359/JBMR.051015. PMID 16418786.
"A Leader in the Treatment of Osteogensis Imperfecta (OI)". Archived from the original on 2007-09-28. Retrieved 2007-07-05.
"Osteogenesis Imperfecta Foundation | OIF.org". www.oif.org. Retrieved 2018-11-10.
Mina Biria, Fatemeh Mashhadi Abbas, Sedighe Mozaffar, and Rahil Ahmadi (2012). "Dentinogenesis imperfecta associated with osteogenesis imperfecta". Dent Res J (Isfahan). 9 (4): 489–494. PMC 3491340. PMID 23162594.
K. Buday, Beiträge zur Lehre von der Osteogenesis imperfecta (1895)
Sillence DO, Senn A, Danks DM (1979). "Genetic heterogeneity in osteogenesis imperfecta". J. Med. Genet. 16 (2): 101–16. doi:10.1136/jmg.16.2.101. PMC 1012733. PMID 458828.
"Osteogenesis Imperfecta Foundation: Glossary". Archived from the original on 2007-08-07. Retrieved 2007-07-05.
synd/1743 at Who Named It?
Genetics of Osteogenesis Imperfecta Archived 2010-12-30 at the Wayback Machine Author: Horacio Plotkin. Updated: Feb 29, 2016
Viljoen D, Beighton P (1987). "Osteogenesis imperfecta type III: an ancient mutation in Africa?". Am. J. Med. Genet. 27 (4): 907–12. doi:10.1002/ajmg.1320270417. PMID 3425600.
"The OI Society of Australia". 2006. Retrieved 6 November 2018.
Sandor, Max (2008). "Genetic and Rare Diseases Information Center (GARD)". Retrieved 6 November 2018.
"Osteogenesis Imperfecta in Dogs - Symptoms, Causes, Diagnosis, Treatment, Recovery, Management, Cost". WagWalking. Retrieved 2018-11-07.
Eckardt J, Kluth S, Dierks C, Philipp U, Distl O (2013). "Population screening for the mutation associated with osteogenesis imperfecta in dachshunds". Vet. Rec. 172 (14): 364. doi:10.1136/vr.101122. PMID 23315765.
"Osteogenesis Imperfecta - CAG - Center for Animal Genetics". CAG - Center for Animal Genetics. Retrieved 2018-11-07.
Carriero, Alessandra; Enderli, Tanya; Burtch, Stephanie; Templet, Jara (September 2016). "Animal models of osteogenesis imperfecta: applications in clinical research". Orthopedic Research and Reviews. 8: 41–55. doi:10.2147/ORR.S85198. ISSN 1179-1462. |