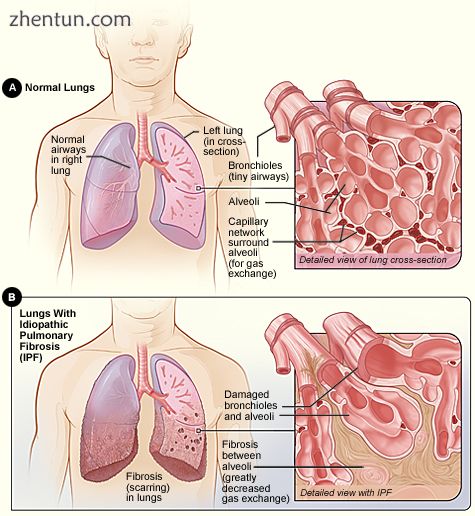
图A显示了肺部和气道在体内的位置。插图显示了肺部气道和气囊横截面的详细视图。
图B显示肺部纤维化(瘢痕形成)。插图显示了纤维化及其如何损害气道和气囊的详细视图。[1]
特发性肺纤维化(IPF)是一种慢性肺病,其特征是肺功能逐渐且不可逆转地下降[3] [4]。症状通常包括逐渐出现呼吸急促和干咳。[1]其他变化可能包括感觉疲倦和指甲杵。[1]并发症可能包括肺动脉高压,心力衰竭,肺炎或肺栓塞[1]。
原因不明。[2]风险因素包括吸烟,某些病毒感染和该病的家族史。[1]潜在的机制涉及肺部瘢痕。[1]诊断需要排除其他可能的原因,并可能通过CT扫描或肺活检来支持。[3]它是一种间质性肺病(ILD)。[3]
人们通常从肺康复和补充氧气中受益。[1]某些药物如吡非尼酮或nintedanib可能会减缓疾病的进展。[2]肺移植也可能是一种选择。[1]
全球约有500万人受到影响。[5]这种疾病最新发生在每年每10万人中约12人。[4]那些60多岁和70多岁的人最常受到影响。[4]男性比女性更容易受到影响。[4]诊断后的平均预期寿命约为四年。[1]
目录
1 症状和体征
2 原因
3 发病机制
4 诊断
4.1 鉴别诊断
4.2 分类
4.3 放射学
4.4 组织学
4.5 支气管肺泡灌洗
4.6 肺功能检查
5 治疗
5.1 氧疗
5.2 肺康复
5.3 药物治疗
5.4 肺移植
5.5 姑息治疗
5.6 跟进
5.7 急性发作
6 预后
7 流行病学
8 其他动物
9 研究
10 参考
体征和症状
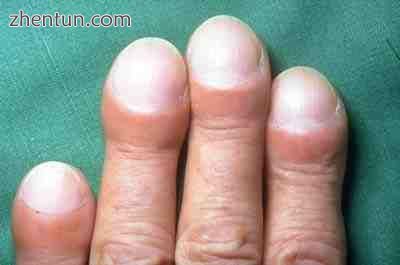
特发性肺纤维化手指的杵状指
在许多人中,症状在诊断前存在相当长的时间。[5] IPF最常见的临床特征包括:[3] [6] [7]
年龄超过50岁
劳累时干燥,非生产性咳嗽
进行性劳累性呼吸困难(运动时呼吸急促)
听诊时干燥的,吸气性的“维可牢尼龙搭扣”噼啪声(吸气期间肺部发出噼啪声,类似于魔术贴被慢慢撕开,用听诊器听到)。[3] [8] [9]
数字的杵状指,指尖或脚趾的毁容(见图)
肺功能检查结果异常,有限制证据和气体交换受损。
这些特征中的一些是由于慢性低氧血症(血液中缺氧),不是IPF特异性的,并且可能发生在其他肺部疾病中。所有原因不明的慢性劳力性呼吸困难患者均应考虑IPF,患者出现咳嗽,吸气性双侧痉挛或手指杵状指[3]。
评估肺部听诊的“维可牢尼龙搭扣”噼啪声是改善早期诊断IPF的实用方法。细小裂纹很容易被临床医生识别,是IPF的特征。[10]
如果在整个吸气时间内存在双侧细裂纹并且在几次深呼吸后持续存在,并且如果在≥60岁的受试者中间隔几周仍然存在几次,则应引起对IPF的怀疑并导致考虑HRCT胸部扫描比胸部X光检查更敏感。[9]由于裂缝不是针对IPF的,因此必须提示彻底的诊断过程。[3]
原因
IPF的原因尚不清楚,但某些环境因素和暴露已被证明会增加获得IPF的风险。[11]吸烟是IPF最受认可和最常被接受的风险因素,并且使IPF的风险增加约两倍。[11]其他环境和职业暴露,如暴露于金属粉尘,木屑,煤尘,二氧化硅,石尘,来自干草粉尘或霉菌孢子或其他农产品的生物粉尘,以及与农业/牲畜有关的职业也被证明会增加IPF的风险。[11]有证据表明,病毒感染可能与特发性肺纤维化和其他纤维化肺病有关。[12]
发病
IPF的病理生物学
尽管进行了广泛的调查,但IPF的原因仍然未知。[3] IPF中的纤维化与吸烟,环境因素(例如职业暴露于气体,烟雾,化学品或粉尘),其他医学病症(包括胃食管反流病(GERD))或遗传易感性(家族性IPF)有关。然而,所有患有IPF的人都没有这些,因此没有提供完全令人满意的疾病解释。[3] [13]
IPF被认为是异常伤口愈合过程的结果,包括/涉及肺间质中胶原(纤维化)的异常和过度沉积,伴有最小的相关炎症[14]。
据推测,IPF的初始或重复性损伤发生在肺细胞上,称为肺泡上皮细胞(AECs,肺细胞),其排列在大部分肺泡表面。[15]当I型AEC损坏或丢失时,认为II型AEC经历增殖以覆盖暴露的基底膜。在正常修复中,增生型II型AEC死亡并且剩余的细胞扩散并经历分化过程以成为I型AEC。在病理条件下和存在转化生长因子β(TGFβ)的情况下,成纤维细胞在这些损伤区域积聚并分化成分泌胶原蛋白和其他蛋白质的肌成纤维细胞。[15]在过去,人们认为炎症是引发肺组织瘢痕形成的第一个事件。然而,根据最新发现,成纤维细胞灶的发展先于炎症细胞的积累和随之而来的胶原沉积[16]。这种致病模型由IPF的临床特征间接支持,包括潜伏性发作,数年的进展,相对罕见的急性发作,以及对免疫抑制治疗无反应。[14] [17]靶向成纤维细胞活化或细胞外基质合成的许多疗法目前正在进行早期测试或正在考虑开发。
家族性IPF占IPF患者总数的不到5%,临床和组织学上与散发性IPF无法区分[3]。遗传关联包括肺表面活性蛋白A1,A2,C(SFTPA1,SFTPA2B)和粘蛋白(MUC5B)的突变[18]。 MUC5B变异的一个显着方面是其检测频率高,因为大约20%的具有北欧和西欧血统的个体以及19%的弗雷明汉心脏研究人群中发现了这种情况。[19]人类端粒酶基因的突变也与家族性肺纤维化和一些散发性IPF患者(例如TERT,TERC基因)有关。[18]最近,在IPF家族中已经描述了第三种端粒酶相关基因dyskerin(DKC1)的X连锁突变[20]。
诊断
早期诊断IPF是早期治疗的先决条件,并可能改善这种进展性和最终致命疾病的长期临床结果。[3]如果怀疑IPF,诊断可能具有挑战性,但是涉及肺病学家,放射科医师和间质性肺病病理学专家的多学科方法已被证明可以提高IPF诊断的准确性。[3] [21] [22]
由美国胸科学会(ATS)和欧洲呼吸学会(ERS)于2000年发表的关于特发性间质性肺炎的多学科共识声明提出了建立IPF诊断的具体主要和次要标准。[3]然而,2011年,ATS,ERS以及日本呼吸学会(JRS)和拉丁美洲胸腔协会(ALAT)发布了新的简化和更新的IPF诊断和管理标准。[3]目前,IPF的诊断需要:
排除已知的ILD原因,例如家庭和职业环境暴露,结缔组织疾病或药物暴露/毒性
在HRCT上存在典型的放射学UIP模式。
在正确的临床环境中,可以单独通过HRCT诊断IPF,从而无需进行外科肺活检[3] [6]。
鉴别诊断
在临床实践中认识到IPF可能具有挑战性,因为症状通常与更常见的疾病相似,例如哮喘,慢性阻塞性肺病(COPD)和充血性心力衰竭。临床医生面临的关键问题是,病史,症状(或体征),放射学和肺功能检查是否与IPF的诊断一致,或者检查结果是否由其他过程引起。长期以来人们已经认识到,与石棉接触有关的ILD患者,药物(如化学治疗剂或呋喃妥因),类风湿性关节炎和硬皮病/系统性硬化症可能难以与IPF区分开来。其他鉴别诊断考虑因素包括与混合性结缔组织病相关的间质性肺病,晚期结节病,慢性过敏性肺炎,肺郎格罕氏细胞组织细胞增生症和放射性肺损伤[3] [6]。
分类
![Classification of IIPs.[6].jpg Classification of IIPs.[6].jpg](data/attachment/forum/201902/25/081200pll3fcbfl2l3pfi3.jpg)
国际投资头寸的分类。[6]
特发性肺纤维化(IPF)属于200多种称为间质性肺病(ILD)的肺部疾病,其特征在于肺间质[6]肺气囊之间的组织。 IPF是特发性间质性肺炎(IIP)的一种特异性表现,其又是一种ILD,也称为弥漫性实质性肺病(DPLD)。
2002年美国胸科学会/欧洲呼吸学会(ATS / ERS)的IIP分类于2013年更新。[6]在这个新的分类中,特发性间质性肺炎(IIPs)主要有三类:主要的IIP,罕见的IIP和无法分类的IIP。主要的IIP分为慢性纤维化IPs(包括IPF和非特异性间质性肺炎[NSIP]);与吸烟有关的知识产权(即呼吸性细支气管炎 - 间质性肺病[RB-ILD]和脱屑性间质性肺炎[DIP]);和急性/亚急性IP(即隐源性组织性肺炎[COP]和急性间质性肺炎[AIP])。[6]
IIP的诊断需要排除已知的ILD原因。已知原因的ILD的实例包括过敏性肺炎,肺朗格汉氏细胞组织细胞增生症,石棉沉滞症和胶原血管疾病。然而,这些疾病不仅经常影响间质,还影响空域,外围气道和血管。[6]
放射科
胸部X射线可用于IPF患者的随访常规。不幸的是,平原胸部X射线无法诊断,但可能显示肺容量减少,通常在肺底附近有明显的网状间质标记。[3]
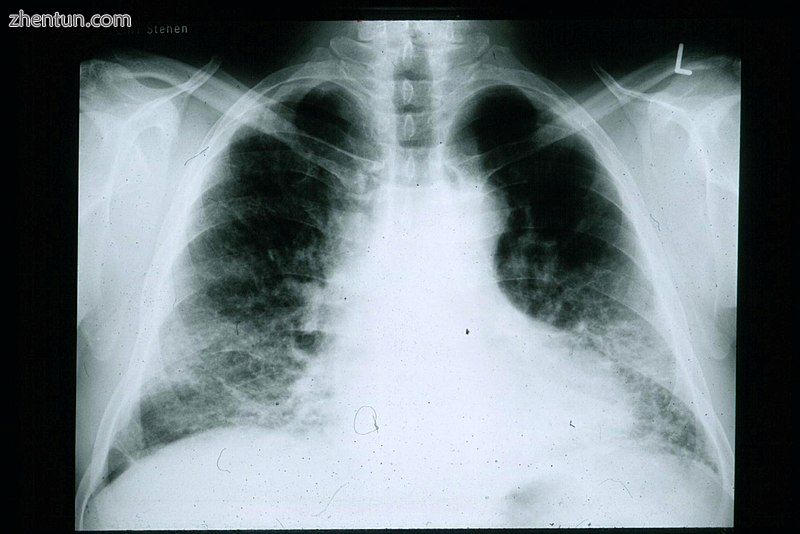
IPF患者的胸部X光片。注意小肺野和网状结节混浊的周边模式。
通过HRCT进行的放射学评估是IPF诊断途径中的一个关键点。使用常规计算机轴向断层扫描仪进行HRCT而不注射造影剂。评估片很薄,1-2毫米。
IPF胸部的典型HRCT显示两肺中的纤维化变化,对基部和外周有偏好。根据联合ATS / ERS ​​/ JRS / ALAT 2011指南,HRCT是IPF诊断途径的重要组成部分,可通过以下方式识别UIP:[3]
网状混浊,通常与牵拉性支气管扩张有关
蜂窝状表现为丛集囊状空间,通常具有相当的直径(3-10毫米),但偶尔也很大。通常是胸膜下并且具有明确的壁并且以至少两条线排列。通常,一行囊肿不足以定义蜂窝状
磨砂玻璃不透明是常见的,但不如网状结构粗糙
分布特征基础和外围虽然经常不整齐。
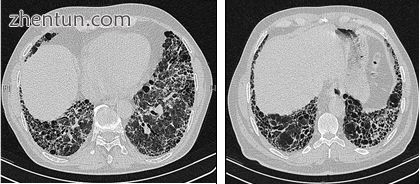
高分辨率计算机断层扫描扫描患有IPF的患者的胸部。主要特征是外围的,主要是基本的粗网状图案与蜂窝状
组织学
根据2011年更新的指南,在HRCT缺乏典型的UIP模式的情况下,需要进行外科肺活检以进行自信的诊断。[3]
用于诊断IPF的组织学标本必须至少在三个不同的地方进行,并且足够大以至于病理学家可以对潜在的肺结构进行评论。小的活组织检查,例如通过经支气管肺活检获得的活检(在支气管镜检查期间进行)通常不足以达到此目的。因此,通常需要通过胸廓切开术或胸腔镜手术获得较大的活组织检查。[3] [6]
来自IPF患者的肺组织通常表现出典型的组织病理学UIP模式,因此是IPF的病理对应物。[3] [23]尽管UIP的病理诊断通常对应于IPF的临床诊断,但UIP组织学模式也可见于其他疾病,以及已知来源的纤维化(例如风湿性疾病)。[1] [3] UIP有四个关键特征,包括“拼凑模式”中的间质纤维化,间质瘢痕形成,蜂窝变化和成纤维细胞灶。
成纤维细胞灶是肌成纤维细胞和瘢痕组织的密集集合,并且与蜂窝结合,是允许诊断UIP的主要病理学发现。
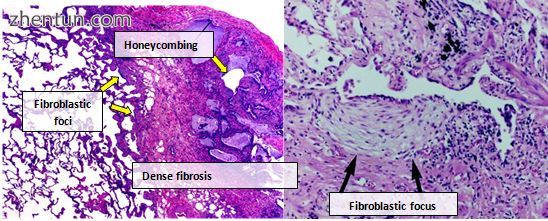
常见间质性肺炎的组织病理学表现的显微照片。高倍放大(右侧)显示成纤维细胞增殖的焦点,接近纤维化区域,在该区域内可以观察到轻微的,非特异性的慢性炎性细胞浸润。在胸膜下空间中,可以识别典型的蜂窝状方面。
支气管肺泡灌洗
支气管肺泡灌洗(BAL)是ILD中良好耐受的诊断程序。[7] BAL细胞学分析(差异细胞计数)应在治疗医师根据其机构的可用性和经验自行决定对IPF患者的评估中予以考虑。 BAL可能会揭示其他特异性诊断:恶性肿瘤,感染,嗜酸性粒细胞性肺炎,组织细胞增多症X或肺泡蛋白沉积症。在对疑似IPF患者的评估中,BAL最重要的应用是排除其他诊断。突出的淋巴细胞增多症(> 30%)通常允许排除IPF的诊断。[24]
肺功能检查
肺量计经典地显示肺活量(VC)降低,气流成比例减少,或观察肺活量增加气流。后一发现反映了与肺纤维化相关的肺硬度增加(肺顺应性降低),导致肺弹性后坐力增加[25]。
使用身体体积描记术或其他技术测量静态肺容量通常显示肺容量减少(限制)。这反映了在使纤维化肺膨胀时遇到的困难。
一氧化碳(DLCO)的扩散能力在IPF中总是降低,并且可能是轻度或早期疾病中的唯一异常。其损伤是IPF患者通过运动表现出氧饱和度下降倾向的基础,也可以使用6分钟步行试验(6MWT)进行评估。[3]
诸如“轻度”,“中度”和“严重”等术语有时用于分期疾病,通常基于静息肺功能测试测量。[3]然而,对于IPF患者的分期以及使用的最佳标准和价值,没有明确的共识。轻度至中度IPF的特点是以下功能标准:[26] [27] [28] [29]
强迫肺活量(FVC)≥50%
DLCO≥30%
6MWT距离≥150米。
治疗
IPF治疗的目标主要是减轻症状,阻止疾病进展,预防急性发作,并延长生存期。应在每位患者的早期开始预防性护理(例如接种疫苗)和基于症状的治疗。[30]
氧疗
在2011年的IPF指南中,氧疗或家用补充氧气成为强烈推荐用于静息时血氧水平显着低的患者。尽管尚未证实氧疗可改善IPF的生存率,但一些数据表明运动能力有所改善。[3] [31]
肺康复
对于IPF患者,疲劳和肌肉量减少是常见的并且是致残问题。肺康复可以缓解IPF的明显症状,并通过稳定和/或逆转疾病的肺外特征来改善功能状态。[32] [33]关于肺康复在特发性肺纤维化中所起作用的已发表研究数量很少,但大多数研究发现功能性运动耐量,生活质量和运动时呼吸困难都有显著的短期改善。[34]典型的康复计划包括运动训练,营养调节,职业治疗,教育和社会心理咨询。在疾病的晚期,IPF患者由于呼吸困难增加而倾向于停止身体活动。应尽可能不鼓励这样做。
药物
过去已经对IPF进行了多项治疗研究,包括干扰素γ-1β,[35]波生坦,[36]安立生坦,[37]和抗凝剂[38],但这些不再被认为是有效的治疗选择。这些早期研究中的许多研究都是基于IPF是一种炎症性疾病的假设。
吡非尼酮
Cochrane评价将吡非尼酮与安慰剂进行比较,发现疾病进展风险降低了30%。[39] FVC或VC也有所改善,即使FVC下降的轻微减缓只能在两项CAPACITY试验之一中证明。[26]第三项研究于2014年完成,发现肺功能和IPF疾病进展减少[28]。来自ASCEND研究的数据也与两项CAPACITY研究的数据合并,在预先指定的分析中显示吡非尼酮在一年的治疗中将死亡风险降低了近50%。[28]
N-乙酰半胱氨酸和三联疗法
N-乙酰半胱氨酸(NAC)是谷胱甘肽的前体,谷胱甘肽是一种抗氧化剂。已经假设用高剂量NAC治疗可以修复IPF患者肺组织中发生的氧化剂 - 抗氧化剂失衡。在180名患者(IFIGENIA)的第一次临床试验中,NAC在之前的研究中显示,与泼尼松和硫唑嘌呤(三联疗法)联合使用后,在12个月的随访中减少了VC和DLCO的下降[40]。
最近,美国国立卫生研究院(NIH)开展了一项大型随机对照试验(PANTHER-IPF),以评估IPF患者的三联疗法和NAC单药治疗。该研究发现泼尼松,硫唑嘌呤和NAC的组合增加了死亡和住院的风险[41],NIH在2012年宣布PANTHER-IPF研究的三联治疗组已提前终止[42]。
该研究还单独评估了NAC,该研究的这一部分的结果于2014年5月在新英格兰医学杂志上发表,得出的结论是“与安慰剂相比,乙酰半胱氨酸在保护患者FVC方面没有显着优势。伴有特发性肺纤维化,肺功能轻度至中度受损“。[43]
尼达尼布
Nintedanib是一种三重血管激酶抑制剂,靶向参与血管生成调节的受体酪氨酸激酶:成纤维细胞生长因子受体(FGFR),血小板衍生生长因子受体(PDGFR)和血管内皮生长因子受体(VEGFR),[44]也与纤维化和IPF的发病有关。在两项III期试验中,nintedanib在一年内使肺功能下降约50%[29]。它于2014年10月获得美国FDA批准[45],并于2015年1月在欧洲获得授权。[46]
肺移植
肺移植可能适合那些身体上有资格接受大型移植手术的患者。在IPF患者中,与留在等候名单上的患者相比,肺移植已被证明可使死亡风险降低75%。[47]自引入基于生存概率优先选择移植候选者的肺分配评分(LAS)以来,IPF已成为美国肺移植的最常见适应症[32]。
有症状的年龄小于65岁且体重指数(BMI)≤26kg/ m2的患者应转诊进行肺移植,但没有明确的数据来指导LTx的准确时间。尽管存在争议,但最新数据表明双侧肺移植优于IPF患者的单肺移植[48]。 IPF肺移植后的5年生存率估计在50%至56%之间[3] [49] [50]。
姑息治疗
姑息治疗的重点是减轻症状,改善患者的舒适度,而不是治疗疾病。这可能包括使用慢性阿片类药物治疗恶化的症状,以治疗严重的呼吸困难和咳嗽。此外,氧疗可用于缓解低氧血症患者的呼吸困难。
姑息治疗还包括减轻身体和精神上的痛苦以及对患者和护理人员的社会心理支持。[3]随着疾病进展,患者可能会经历恐惧,焦虑和抑郁,因此应考虑心理咨询。在最近一项关于门诊患有ILD的研究中,包括IPF,抑郁评分,功能状态(通过步行测试评估)以及肺功能,都是导致呼吸困难严重程度的原因。[51]
在特定严重呼吸困难的特定病例中,可考虑使用吗啡。它可以减少呼吸困难,焦虑和咳嗽,而不会显着降低血氧饱和度。[52]
跟进
IPF经常被误诊,至少在生理和/或影像学数据表明存在ILD导致延迟获得适当护理之前。[32]考虑到IPF是一种诊断后中位生存期为三年的疾病,因此对于怀疑或已知ILD的患者,应考虑早期转诊至具有特定专业知识的中心。在复杂的鉴别诊断的基础上,在诊断ILD方面经验丰富的肺病学家,放射科医师和病理学家之间的多学科讨论对于准确诊断至关重要。[3]
在确诊IPF后,根据症状和疾病阶段选择合适的治疗方案,应采取密切随访。由于疾病的变化程度很高,肺癌等并发症的发生率较高(IPF报告高达25%的患者)每3至6个月进行一次常规评估,包括肺活量测定(身体体积描记术),扩散能力测试,胸部X光,6MWT,评估呼吸困难,生活质量,氧气需求是强制性的。
此外,人们越来越多地意识到并发症和常见的伴随疾病常常与IPF相关,需要对合并症进行常规评估,其中大多数只是反映并发的老年疾病,以及药物与其相互作用和副作用。
急性发作
IPF急性加重(AE-IPF)定义为30天内不明原因的呼吸困难恶化或发展,HRCT异常的新放射性浸润常常叠加在符合UIP模式的背景上。 AE-IPF的年发病率在所有患者中的10%至15%之间。 AE-IPF的预后很差,死亡率从78%到96%不等。[53]需要排除AE-IPF的其他原因,如肺栓塞,充血性心力衰竭,气胸或感染。必须通过气管内吸出物或BAL排除肺部感染。
许多急性恶化的患者需要进行重症监护治疗,特别是当呼吸衰竭与血流动力学不稳定,严重的合并症或严重的低氧血症相关时[54]。然而,住院期间的死亡率很高。[53]只有在仔细权衡患者的长期预后并尽可能地考虑患者的意愿后,才应引入机械通气。然而,目前的指南不鼓励对继发于IPF的呼吸衰竭患者使用机械通气。[3]
预测
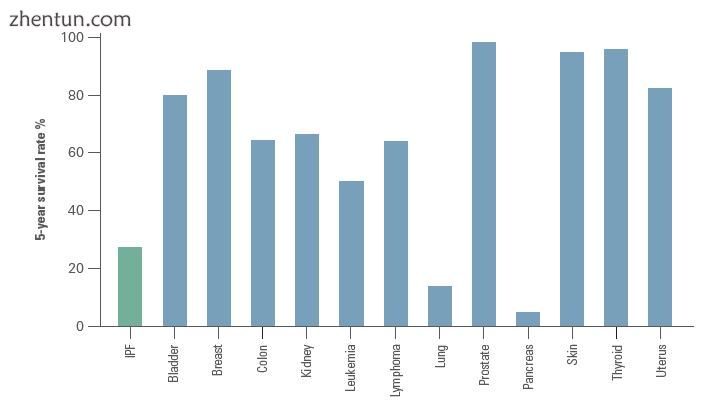
IPF和常见恶性肿瘤的5年生存率比较。改编自Bjoraker等人。 1998年[55]
IPF的临床过程可能无法预测。[3] [55] [56] IPF进展与诊断后2至5年的估计中位生存时间相关[1] [3] IPF的5年生存率在20-40%之间[56],死亡率高于多种恶性肿瘤,包括结肠癌,多发性骨髓瘤和膀胱癌[55] [56]。
最近提出了一种多维指数和分期系统来预测IPF的死亡率。[57]该指数的名称是GAP,基于性别[G],年龄[A]和两个肺生理学变量[P](FVC和DLCO,通常在临床实践中测量,以预测IPF的死亡率。最高阶段已发现GAP(III期)与1年时死亡风险的39%相关[57]。该模型也已在IPF和其他ILD中进行了评估,并在预测所有主要ILD亚型的死亡率方面表现出良好的表现。改良的ILD-GAP指数已被开发用于跨ILD亚型的应用,以提供疾病特异性生存估计。[58]在IPF患者中,5年总死亡率高,但轻度患者的全因死亡率年率中度肺损伤相对较低。这就是为什么肺功能改变(FVC)通常在IPF治疗的1年临床试验中测量而不是生存的原因。[59]
除了预测IPF患者进展速度有多快的临床和生理参数外,遗传和分子特征也与IPF死​​亡率相关。例如,已经显示在粘蛋白MUC5B基因多态性中具有特定基因型的IPF患者(见上文)经历FVC的较慢下降并且显着改善存活[60] [61]。即使从科学观点来看这些数据是有趣的,基于特定基因型的预后模型在临床常规中的应用仍然是不可能的。
流行病学
虽然很少见,但IPF是最常见的IIP形式。[6]根据美国医疗保健索赔数据分析,IPF的患病率估计在每10万人14.0至42.7之间,根据本分析中使用的病例定义而有所不同。[8] [23] IPF在男性中比在女性中更常见,并且通常在50岁以上的人中被诊断出来。[3]
IPF的发生率很难确定,因为统一的诊断标准尚未得到一致应用。[3] [8]美国最近的一项研究估计,每10万人的IPF发病率在6.8至16.3之间。在27个欧盟国家中,一系列消息来源估计每10万人口的发病率为4.6-7.4人,[62] [63]这表明每年约有30,000-35,000名新患者被诊断出患有IPF。[23] [64]
最近的一项单中心,回顾性观察性队列研究,包括2003年至2009年在奥胡斯大学医院(丹麦)诊断为ILD的事件患者,发现ILD每10万居民每年发病率为4.1。 IPF是最常见的诊断(28%),其次是结缔组织病相关的ILD(14%),过敏性肺炎(7%)和非特异性间质性肺炎(NSIP)(7%)。 IPF发病率为每10万居民每年1.3人。[65]
由于该疾病在欧洲各国的分布不均,需要通过欧洲范围的ILD和IPF登记处更新流行病学数据。
其他动物
IPF已经被狗和猫的几个品种所认可,[66]并且在西部高地白梗中得到了最好的表征。[67]患有这种疾病的兽医患者与人类患者有许多相同的临床症状,包括进行性运动不耐受,呼吸频率增加和最终的呼吸窘迫。[68]预后通常很差。
研究
目前正在研究IPF的II期临床试验中的许多药剂,包括单克隆抗体simtuzumab,tralokinumab,lebrikizumab和FG-3019,一种溶血磷脂酸受体拮抗剂(BMS-986020)。 STX-100的II期研究也在进行中。[69]这些分子针对几种已知在成纤维细胞的增殖,活化,分化或不适当存活中起作用的生长因子和细胞因子。
在小鼠中mir-29 microRNA前体研究产生了诱导的IPF的逆转。 MRG-201目前正在进行测试,截止到2016年,但尚未在IPF患者中进行测试,并且截至2016年1月,没有安排IPF使用的人体试验。[70]
IPF的干细胞疗法是一个研究领域。[71] [72]
参考:
"Idiopathic Pulmonary Fibrosis". NHLBI. Retrieved 21 January 2018.
Raghu, G; Rochwerg, B; Zhang, Y; Garcia, CA; Azuma, A; Behr, J; Brozek, JL; Collard, HR; Cunningham, W; Homma, S; Johkoh, T; Martinez, FJ; Myers, J; Protzko, SL; Richeldi, L; Rind, D; Selman, M; Theodore, A; Wells, AU; Hoogsteden, H; Schünemann, HJ; American Thoracic, Society.; European Respiratory, society.; Japanese Respiratory, Society.; Latin American Thoracic, Association. (15 July 2015). "An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline: Treatment of Idiopathic Pulmonary Fibrosis. An Update of the 2011 Clinical Practice Guideline". American Journal of Respiratory and Critical Care Medicine. 192 (2): e3–19. doi:10.1164/rccm.201506-1063ST. PMID 26177183.
Raghu G, Collard HR, Egan JJ, et al. (2011). "An official ATS/ERS/JRS/ALAT statement: Idiopathic pulmonary fibrosis: Evidence-based guidelines for diagnosis and management". Am. J. Respir. Crit. Care Med. 183 (6): 788–824. doi:10.1164/rccm.2009-040GL. PMC 5450933. PMID 21471066.
Ferri, Fred F. (2017). Ferri's Clinical Advisor 2018 E-Book: 5 Books in 1. Elsevier Health Sciences. p. 691. ISBN 9780323529570.
Meltzer EB, Noble PW (2008). "Idiopathic pulmonary fibrosis". Orphanet J Rare Dis. 3 (1): 8. doi:10.1186/1750-1172-3-8. PMC 2330030. PMID 18366757.
Travis WD, Costabel U, Hansell DM, King TE, Lynch DA, Nicholson AG, et al. (September 2013). "An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias". Am. J. Respir. Crit. Care Med. 188 (6): 733–48. doi:10.1164/rccm.201308-1483ST. PMC 5803655. PMID 24032382.
Flaherty KR, Mumford JA, Murray S, Kazerooni EA, Gross BH, Colby TV, Travis WD, Flint A, et al. (2007). "Prognostic implications of physiologic and radiographic changes in idiopathic interstitial pneumonia". Am J Respir Crit Care Med. 168 (5): 543–548. CiteSeerX 10.1.1.320.6411. doi:10.1164/rccm.200209-1112OC. PMID 12773329.
Raghu G, Weycker D, Edesberg J, Bradford WZ, Oster G (2006). "Incidence and prevalence of idiopathic pulmonary fibrosis". Am. J. Respir. Crit. Care Med. 174 (7): 810–816. doi:10.1164/rccm.200602-163oc. PMID 16809633.
Cottin V, Cordier JF (2012). "Velcro crackles: the key for early diagnosis of idiopathic pulmonary fibrosis". Eur Respir J. 40 (3): 519–521. doi:10.1183/09031936.00001612. PMID 22941541.
Baughman RP, Shipley RT, Loudon RG, Lower EE (1991). "Crackles in interstitial lung disease. Comparison of sarcoidosis and fibrosing alveolitis". Chest. 100 (1): 96–101. doi:10.1378/chest.100.1.96. PMID 2060395.
Olson AL, Swigris JJ (Mar 2012). "Idiopathic pulmonary fibrosis: diagnosis and epidemiology". Clinics in Chest Medicine. 33 (1): 41–50. doi:10.1016/j.ccm.2011.12.001. PMID 22365244.
Williams, KJ (March 2014). "Gammaherpesviruses and Pulmonary Fibrosis: Evidence From Humans, Horses, and Rodents". Veterinary Pathology. 51 (2): 372–384. doi:10.1177/0300985814521838. PMID 24569614.
García-Sancho C; Buendía-Roldán I; Fernández-Plata MR; Navarro C; Pérez-Padilla R; Vargas MH; Loyd JE; Selman M. Buendía-Roldán I; Fernández-Plata MR; et al. (2011). "Familial pulmonary fibrosis is the strongest risk factor for idiopathic pulmonary fibrosis". Respir Med. 105 (12): 1902–1990. doi:10.1016/j.rmed.2011.08.022. PMID 21917441.
Harari S, Caminati A (2010). "IPF: new insight on pathogenesis and treatment". Allergy. 65 (5): 537–553. doi:10.1111/j.1398-9995.2009.02305.x. PMID 20121758.
Loomis-King H, Flaherty KR, Moore BB (April 2013). "Pathogenesis, current treatments and future directions for idiopathic pulmonary fibrosis". Current Opinion in Pharmacology. 13 (3): 377–385. doi:10.1016/j.coph.2013.03.015. PMC 3686907. PMID 23602652.
Pardo A, Selman M (2002). "Idiopathic pulmonary fibrosis: new insights in its pathogenesis". Int J Biochem Cell Biol. 34 (12): 1534–1538. doi:10.1016/s1357-2725(02)00091-2.
Selman M, King TE, Pardo A (2001). "Idiopathic pulmonary fibrosis: prevailing and evolving hypotheses about its pathogenesis and implications for therapy". Annals of Internal Medicine. 134 (2): 136–151. doi:10.7326/0003-4819-134-2-200101160-00015. PMID 11177318.
"OMIM Entry - # 178500 - PULMONARY FIBROSIS, IDIOPATHIC; IPF". Omim.org. Retrieved 7 June 2018.
Mathai S, et al. (2014). "Genetic susceptibility and pulmonary fibrosis". Curr Opin Pulm Med. 20 (5): 429–435. doi:10.1097/MCP.0000000000000074. PMC 4337021. PMID 25022318.
Kropski JA, Mitchell DB, Markin C, et al. (Feb 6, 2014). "A novel dyskerin (DKC1) mutation is associated with familial interstitial pneumonia". Chest. 146 (1): e1–7. doi:10.1378/chest.13-2224. PMC 4077414. PMID 24504062.
Flaherty KR, King TE, Raghu G, Lynch JP, Colby TV, Travis WD, Gross BH, Kazerooni EA, et al. (2004). "Idiopathic interstitial pneumonia: what is the effect of a multidisciplinary approach to diagnosis?". Am J Respir Crit Care Med. 170 (8): 904–910. doi:10.1164/rccm.200402-147OC. PMID 15256390.
Flaherty KR, Andrei AC, King TE Jr, Raghu G, Colby TV, Wells A, Bassily N, Brown K, et al. (2007). "Idiopathic interstitial pneumonia: do community and academic physicians agree on diagnosis?". Am J Respir Crit Care Med. 175 (10): 1054–1060. doi:10.1164/rccm.200606-833OC. PMC 1899268. PMID 17255566.
Pulmonary Fibrosis Foundation. "Prevalence and Incidence". Pulmonaryfibrosis.org. Retrieved 2013-04-11
Ohshimo S, Bonella F, Cui A, Beume M, Kohno N, Guzman J, Costabel U (2009). "Significance of bronchoalveolar lavage for the diagnosis of idiopathic pulmonary fibrosis". Am J Respir Crit Care Med. 179 (11): 1043–1047. doi:10.1164/rccm.200808-1313oc. PMID 19246718.
Pellegrino R, Viegi G, Brusasco V, Crapo RO, Burgos F, Casaburi R, Coates A, van der Grinten CP, et al. (2005). "Interpretative strategies for lung function tests". Eur Respir J. 26 (5): 948–968. doi:10.1183/09031936.05.00035205. PMID 16264058.
Noble PW, Albera C, Bradford WZ, Costabel U, Glassberg MK, Kardatzke D, King TE, Lancaster L, et al. (2011). "Pirfenidone in patients with idiopathic pulmonary fibrosis (CAPACITY): two randomised trials". Lancet. 377 (9779): 1760–1769. doi:10.1016/S0140-6736(11)60405-4. PMID 21571362.
Martinez FJ, Safrin S, Weycker D, Starko KM, Bradford WZ, King TE, Flaherty KR, Schwartz DA, Noble PW, Raghu G, Brown KK (June 2005). "The clinical course of patients with idiopathic pulmonary fibrosis". Ann. Intern. Med. 142 (12 Pt 1): 963–7. doi:10.7326/0003-4819-142-12_part_1-200506210-00005. PMID 15968010.
King TE, Bradford WZ, Castro-Bernardini S, Fagan EA, Glaspole I, Glassberg MK, et al. (May 2014). "A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis". N. Engl. J. Med. 370 (22): 2083–92. doi:10.1056/NEJMoa1402582. PMID 24836312.
Richeldi L, du Bois RM, Raghu G, Azuma A, Brown KK, Costabel U, et al. (May 2014). "Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis". N. Engl. J. Med. 370 (22): 2071–82. doi:10.1056/NEJMoa1402584. PMID 24836310.
Lee JS, McLaughlin S, Collard HR (2011). "Comprehensive care of the patient with idiopathic pulmonary fibrosis". Current Opinion in Pulmonary Medicine. 17 (5): 348–354. doi:10.1097/mcp.0b013e328349721b. PMID 21760508.
Morrison DA, Stovall JR (1992). "Increased exercise capacity in hypoxemic patients after long-term oxygen therapy". Chest. 102 (2): 542–550. doi:10.1378/chest.102.2.542. PMID 1643945.
Spagnolo P, Tonelli R, Cocconcelli E, Stefani A, Richeldi L (2012). "Idiopathic pulmonary fibrosis: diagnostic pitfalls and therapeutic challenges". Multidiscip Respir Med. 7 (1): 42. doi:10.1186/2049-6958-7-42. PMC 3537555. PMID 23146172.
Lee JS, McLaughlin S, Collard HR (2011). "Comprehensive care of the patient with idiopathic pulmonary fibrosis". Current Opinion in Pulmonary Medicine. 17 (5): 348–354. doi:10.1097/mcp.0b013e328349721b. PMID 21760508.
Kenn, K; Gloeckl, R; Behr, J (2013). "Pulmonary rehabilitation in patients with idiopathic pulmonary fibrosis—a review". Respiration; International Review of Thoracic Diseases. 86 (2): 89–99. doi:10.1159/000354112. PMID 23942353.
King TE Jr; Albera C; Bradford WZ; Costabel U; Hormel P; Lancaster L; Noble PW; Sahn SA; et al. (2009). "Effect of interferon gamma-1b on survival in patients with idiopathic pulmonary fibrosis". Lancet. 374 (9685): 222–228. doi:10.1016/S0140-6736(09)60551-1. PMID 19570573.
King TE Jr; Brown KK; Raghu G; du Bois RM; Lynch DA; Martinez F; Valeyre D; Leconte I; et al. (2011). "BUILD-3: a randomized, controlled trial of bosentan in idiopathic pulmonary fibrosis". Am J Respir Crit Care Med. 184 (1): 92–99. doi:10.1164/rccm.201011-1874OC. PMID 21474646.
Raghu G, Behr J, Brown KK, Egan JJ, Kawut SM, Flaherty KR, Martinez FJ, Nathan SD, et al. (2013). "Treatment of idiopathic pulmonary fibrosis with ambrisentan: a parallel, randomized trial". Ann Intern Med. 158 (9): 641–649. doi:10.7326/0003-4819-158-9-201305070-00003. PMID 23648946.
Noth I, Anstrom KJ, Calvert SB, de Andrade J, Flaherty KR, Glazer C, Kaner RJ, Olman MA (2012). "Idiopathic Pulmonary Fibrosis Clinical Research Network (IPFnet) A placebo-controlled randomized trial of warfarin in idiopathic pulmonary fibrosis". Am J Respir Crit Care Med. 186 (1): 88–95. doi:10.1164/rccm.201202-0314OC. PMC 3400994. PMID 22561965.
Spagnolo P, Del Giovane C, Luppi F, Cerri S, Balduzzi S, Walters EH, D'Amico R, Richeldi L (2010). "Non-steroid agents for idiopathic pulmonary fibrosis". Cochrane Database Syst Rev (9): CD003134. doi:10.1002/14651858.CD003134.pub2. PMID 20824834.
Demedts M, Behr J, Buhl R, Costabel U, Dekhuijzen R, Jansen HM, MacNee W, Thomeer M, et al. (2005). "High-dose acetylcysteine in idiopathic pulmonary fibrosis". N Engl J Med. 353 (21): 2229–2242. doi:10.1056/NEJMoa042976. hdl:2066/47718. PMID 16306520.
Raghu G, Anstrom KJ, King TE, Lasky JA, Martinez FJ (May 2012). "Prednisone, azathioprine, and N-acetylcysteine for pulmonary fibrosis". N. Engl. J. Med. 366 (21): 1968–77. doi:10.1056/NEJMoa1113354. PMC 3422642. PMID 22607134.
"Commonly used three-drug regimen for idiopathic pulmonary fibrosis found harmful". NIH. October 21, 2011. Retrieved 2013-04-11.
The Idiopathic Pulmonary Fibrosis Clinical Research Network. (2014). "Randomized trial of acetylcysteine in idiopathic pulmonary fibrosis". N Engl J Med. 370 (22): 2093–2102. doi:10.1056/nejmoa1401739. PMC 4116664. PMID 24836309.
"BIBF 1120 Fact Sheet" (PDF). Dl.groovygecko.net. Retrieved 2014-04-08.
"FDA Approval Package for Nintedanib" (PDF). www.accessdata.fda.gov. Retrieved 2019-01-07.
"Ofev | European Medicines Agency". www.ema.europa.eu. 2018-09-17. Retrieved 2019-01-07.
Russo MJ, Iribarne A, Hong KN, Davies RR, Xydas S, Takayama H, Ibrahimiye A, Gelijns AC, Bacchetta MD, D'Ovidio F, Arcasoy S, Sonett JR (2010). "High lung allocation score is associated with increased morbidity and mortality following transplantation". Chest. 137 (3): 651–657. doi:10.1378/chest.09-0319. PMC 2832864. PMID 19820072.
George TJ, Arnaoutakis GJ, Shah AS (2007). "Lung transplantation for idiopathic pulmonary fibrosis". Ann. Thorac. Surg. 84 (4): 1121–1128. doi:10.1016/j.athoracsur.2007.04.096. PMID 17888957.
Mason DP, Brizzio ME, Alster JM, McNeill AM, Murthy SC, Budev MM, Mehta AC, Minai OA, et al. (2011). "Lung transplant in idiopathic pulmonary fibrosis". Arch. Surg. 146 (10): 1204–1209. doi:10.1001/archsurg.2011.239. PMID 22006881.
Keating D, Levvey B, Kotsimbos T, Whitford H, Westall G, Williams T, Snell G (2009). "Lung transplantation in pulmonary fibrosis challenging early outcomes counter balanced by surprisingly good outcomes beyond 15 years". Transplant. Proc. 41 (1): 289–291. doi:10.1016/j.transproceed.2008.10.042. PMID 19249537.
Ryerson CJ, Berkeley J, Carrieri-Kohlman VL, Pantilat SZ, Landefeld CS, Collard HR (2011). "Depression and functional status are strongly associated with dyspnea in interstitial lung disease". Chest. 139 (3): 609–616. doi:10.1164/ajrccm-conference.2010.181.1_meetingabstracts.a2960. PMID 20688924.
Allen S, Raut S, Woollard J, Vassallo M (2005). "Low dose diamorphine reduces breathlessness without causing a fall in oxygen saturation in elderly patients with end-stage idiopathic pulmonary fibrosis". Palliat Med. 19 (2): 128–130. doi:10.1191/0269216305pm998oa. PMID 15810751.
Agarwal R, Jindal SK (2008). "Acute exacerbation of idiopathic pulmonary fibrosis: a systematic review". Eur J Intern Med. 19 (4): 227–235. doi:10.1016/j.ejim.2007.04.024. PMID 18471669.
Stern JB, Mal H, Groussard O, Brugière O, Marceau A, Jebrak G, Fournier M (2001). "Prognosis of patients with advanced idiopathic pulmonary fibrosis requiring mechanical ventilation for acute respiratory failure". Chest. 120 (1): 213–219. doi:10.1378/chest.120.1.213.
Bjoraker JA, Ryu JH, Edwin MK, Myers JL, Tazelaar HD, Schroeder DR, Offord KP (1998). "Prognostic significance of histopathologic subsets in idiopathic pulmonary fibrosis". Am J Respir Crit Care Med. 157 (1): 199–203. doi:10.1164/ajrccm.157.1.9704130. PMID 9445300.
Kim DS, Collard HR, King TE (June 2006). "Classification and natural history of the idiopathic interstitial pneumonias". Proc Am Thorac Soc. 3 (4): 285–92. doi:10.1513/pats.200601-005TK. PMC 2658683. PMID 16738191.
Ley B, Ryerson CJ, Vittinghoff E, Ryu JH, Tomassetti S, Lee JS, Poletti V, Buccioli M, Elicker BM, Jones KD, King TE Jr, Collard HR (2012). "A multidimensional index and staging system for idiopathic pulmonary fibrosis". Annals of Internal Medicine. 156 (10): 684–691. CiteSeerX 10.1.1.691.4472. doi:10.7326/0003-4819-156-10-201205150-00004. PMID 22586007.
Ryerson CJ, Vittinghoff E, Ley B, Lee JS, Mooney JJ, Jones KD, Elicker BM, Wolters PJ, et al. (2014). "Predicting Survival Across Chronic Interstitial Lung Disease: The ILD-GAP Model". Chest. 145 (4): 723–728. doi:10.1378/chest.13-1474. PMID 24114524.
King TE, Albera C, Bradford WZ, Costabel U, du Bois RM, Leff JA, Nathan SD, Sahn SA, Valeyre D, Noble PW (April 2014). "All-cause mortality rate in patients with idiopathic pulmonary fibrosis. Implications for the design and execution of clinical trials". Am. J. Respir. Crit. Care Med. 189 (7): 825–31. doi:10.1164/rccm.201311-1951OC. PMID 24476390.
Peljto AL, Zhang Y, Fingerlin TE, Ma SF, Garcia JG, Richards TJ, Silveira LJ, Lindell KO, et al. (2013). "Association between the MUC5B promoter polymorphism and survival in patients with idiopathic pulmonary fibrosis". JAMA. 309 (21): 2232–2239. doi:10.1001/jama.2013.5827. PMC 4545271. PMID 23695349.
Stock CJ, Sato H, Fonseca C, Banya WA, Molyneaux PL, Adamali H, Russell AM, Denton CP, et al. (2013). "Mucin 5B promoter polymorphism is associated with idiopathic pulmonary fibrosis but not with development of lung fibrosis in systemic sclerosis or sarcoidosis". Thorax. 68 (5): 436–441. doi:10.1136/thoraxjnl-2012-201786. PMID 23321605.
Gribbin J, Hubbard RB, Le Jeune I, Smith CJ, West J, Tata LJ (2006). "Incidence and mortality of idiopathic pulmonary fibrosis and sarcoidosis in the UK". Thorax. 61 (11): 980–985. doi:10.1136/thx.2006.062836. PMC 2121155. PMID 16844727.
Navaratnam V, Fleming KM, West J, Smith CJ, Jenkins RG, Fogarty A, Hubbard RB (2011). "The rising incidence of idiopathic pulmonary fibrosis in the U.K". Thorax. 66 (6): 462–467. doi:10.1136/thx.2010.148031. PMID 21525528.
"Eurostat News Release. European demography. 110/2010. 27 July 2010" (PDF). Epp.eurostat.ec.europa.eu. Retrieved 7 June 2018.
Hyldgaard C, Hilberg O, Muller A, Bendstrup E (2014). "A cohort study of interstitial lung diseases in central Denmark". Respir Med. 108 (5): 793–799. doi:10.1016/j.rmed.2013.09.002. PMID 24636811.
Williams K, Malarkey D, Cohn L, Patrick D, Dye J, Toews G (2004). "Identification of spontaneous feline idiopathic pulmonary fibrosis: morphology and ultrastructural evidence for a type II pneumocyte defect". Chest. 125 (6): 2278–2288. doi:10.1378/chest.125.6.2278. PMID 15189952.
Webb JA, Armstrong J (2002). "Chronic idiopathic pulmonary fibrosis in a West Highland white terrier". Can Vet J. 43 (9): 703–705. PMC 339552. PMID 12240528.
"AKC Canine Health Foundation". Akcchf.org. Retrieved 7 June 2018.
"Active Clinical Trials and Investigational Research in IPF". Archived from the original on 2014-09-04. Retrieved 2014-09-04.
"Research Demonstrates Reversal Of Pulmonary Fibrosis With miRagen Therapeutics Synthetic microRNA-29 Mimic (promiR-29)". Pulmonaryfibrosisnews.com. 2014-09-23. Retrieved 8 June 2018.
Liu, M; Ren, D; Wu, D; Zheng, J; Tu, W (2015). "Stem Cell and Idiopathic Pulmonary Fibrosis: Mechanisms and Treatment". Current Stem Cell Research & Therapy. 10 (6): 466–76. doi:10.2174/1574888X10666150519092639. PMID 25986617.
"Stem cell therapy for lung fibrosis conditions". Sciencedaily.com. Retrieved 8 June 2018. |