范可尼贫血症(FA)是一种罕见的遗传性疾病,导致对DNA损伤的反应受损。尽管这是一种非常罕见的疾病,但对这种和其他骨髓衰竭综合征的研究已经提高了对正常骨髓功能和癌症发展机制的科学认识。在受影响的人中,大多数人患有癌症,最常见的是急性髓性白血病,并且到40岁时90%的人患有骨髓衰竭(无法产生血细胞)。大约60-75%的人患有先天性缺陷,通常身材矮小,异常皮肤,手臂,头部,眼睛,肾脏和耳朵,以及发育障碍。大约75%的人患有某种形式的内分泌问题,严重程度不同。
FA是通过同源重组负责DNA修复的蛋白质簇中的遗传缺陷的结果。[1]
雄激素和造血(血细胞)生长因子的治疗可以暂时帮助骨髓衰竭,但如果有供体,长期治疗就是骨髓移植。[2]由于DNA修复中的遗传缺陷,来自FA患者的细胞对通过DNA交联治疗癌症的药物敏感,例如丝裂霉素C. 2000年典型的死亡年龄为30岁。[2]
每130,000个新生儿中就有一个出现FA,以色列的Ashkenazi犹太人和南非的Afrikaners的频率更高。[3]这种疾病是以最初描述这种疾病的瑞士儿科医生Guido Fanconi命名的。[4] [5]它不应该与Fanconi综合症相混淆,Fanconi综合症是一种以Fanconi命名的肾脏疾病。
目录
1 症状和体征
2 遗传学
3 发病机制
3.1 骨髓增生异常综合征
3.2 急性髓性白血病
3.3 骨髓衰竭
3.4 分子基础
3.5 精子
3.6 神经干细胞稳态
4 治疗
5 预后
6 参考
体征和症状
FA的特征在于骨髓衰竭,AML,实体瘤和发育异常。 经典功能包括拇指异常,半径不足,身材矮小,皮肤色素沉着过度,包括咖啡色斑,异常面部特征(三角面,小头畸形),肾脏异常和生育能力下降。 许多FA患者(约30%)没有任何经典的身体检查结果,但Diepoxybutane染色体脆性检测显示染色体断裂增加可以作出诊断。[6] 大约80%的FA将在20岁时发生骨髓衰竭。
血液学问题的第一个迹象通常是瘀点和瘀伤,后来出现苍白的外观,感觉疲倦和感染。由于大细胞增多症通常发生在较低的血小板计数之前,因此应评估典型先天性异常伴有FA的患者红细胞平均红细胞体积升高[7]。
遗传学
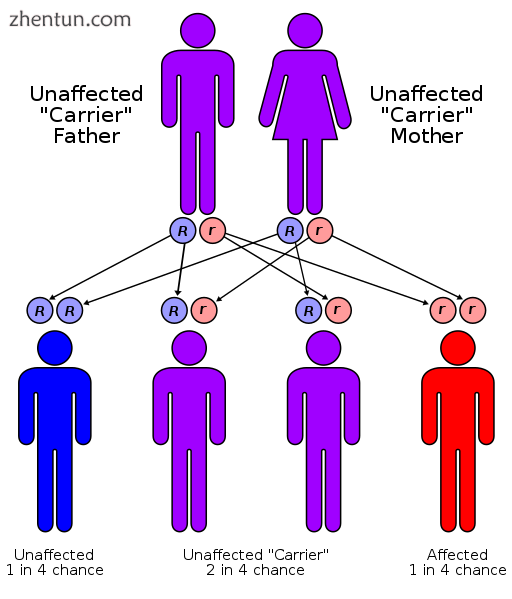
范可尼贫血具有常染色体隐性遗传模式。
FA主要是常染色体隐性遗传疾病。这意味着需要两个突变的等位基因(每个亲本一个)来引起疾病。每个后续孩子都有FA的风险为25%。大约2%的FA病例是X连锁隐性遗传,这意味着如果母亲在一条X染色体上携带一个突变的Fanconi贫血等位基因,那么50%的可能性是雄性后代会出现Fanconi贫血症。
科学家已经确定了17个FA或FA样基因:FANCA,FANCB,FANCC,FANCD1(BRCA2),FANCD2,FANCE,FANCF,FANCG,FANCI,FANCJ(BRIP1),FANCL,FANCM,FANCN(PALB2),FANCP(SLX4) ,FANCS(BRCA1),RAD51C和XPF。 FANCB是FA常染色体隐性遗传的一个例外,因为该基因位于X染色体上。这些基因参与DNA修复。
德系犹太人的载体频率约为90分之一。[8]对于可能是范可尼贫血的携带者,建议进行遗传咨询和基因检测。
由于血液成分未能发育 - 白细胞,红细胞和血小板 - 身体抵抗感染,输送氧气和形成凝块的能力都会降低。
发病
临床上,血液学异常是FA中最严重的症状。到40岁时,98%的FA患者会出现某种类型的血液学异常。然而,发生了一些病例,其中老年患者在没有发病的情况下死亡。症状逐渐出现,常导致骨髓完全衰竭。在出生时,血细胞计数通常是正常的,大红细胞增多症/巨幼红细胞性贫血,定义为异常大的红细胞,是第一个检测到的异常,通常在生命的第一个十年内(发病的中位年龄为7岁)。在接下来的10年内,超过50%出现血液学异常的患者会出现全血细胞减少症,定义为两种或两种以上血细胞谱系的异常。这与仅影响红细胞的Diamond-Blackfan贫血和主要引起中性粒细胞减少的Shwachman-Diamond综合症形成对比。最常见的是,低血小板计数(血小板减少症)先于低中性粒细胞计数(中性粒细胞减少症),两者都出现相对相等的频率。这些缺陷分别导致出血和复发感染的风险增加。[引证需要]
由于FA现在已知会影响DNA修复,特别是同源重组[1],并且鉴于目前对骨髓中动态细胞分裂的了解,发现患者更容易发生骨髓衰竭,骨髓增生异常综合征和急性髓性白血病( AML)并不奇怪。
骨髓增生异常综合征
MDS,以前称为白血病前期,是一组骨髓肿瘤疾病,具有AML的许多形态学特征,但有一些重要的差异。首先,未分化的祖细胞,胚细胞的百分比总是小于20%,与红细胞,粒细胞和巨核细胞前体中的细胞质和核形态变化相比,相当多的发育不良,比AML病例中常见的更多。这些变化反映了延迟的细胞凋亡或程序性细胞死亡的失败。如果不及时治疗,MDS可在约30%的病例中导致AML。由于FA病理学的性质,不能仅通过骨髓的细胞遗传学分析来进行MDS诊断。实际上,只有在进行骨髓细胞的形态学分析时,才能确定MDS的诊断。在检查时,受MDS折磨的FA患者将显示出许多克隆变异,出现在MDS之前或之后。此外,细胞将显示染色体畸变,最常见的是单体性7和染色体3q的部分三体性。骨髓内单体性7的观察与发生AML的风险增加和预后非常差相关,死亡通常在2年(除非提示同种异体造血祖细胞移植是一种选择)。[9]
急性髓性白血病
FA患者发生AML的风险升高,其定义为骨髓中存在20%或更多的髓样细胞或血液中5-20%的骨髓母细胞。除了早幼粒细胞外,所有AML亚型都可以在FA中发生。然而,骨髓单核细胞和急性单核细胞是观察到的最常见的亚型。许多MDS患者如果存活时间足够长,就会演变成AML。此外,随着骨髓衰竭的发生,发生AML的风险也会增加。
虽然在20岁之前患MDS或AML的风险仅为27%,但到30岁时这种风险会增加到43%,到40岁时会增加到52%。从历史上看,即使使用骨髓移植手术,大约四分之一诊断为MDS / ALS的FA患者在两年内死于MDS / ALS相关原因[10],尽管最近发表的证据表明早期异基因造血祖细胞移植在FA患儿中随着时间的推移会导致更好的结果[11]。
骨髓衰竭
与FA相关的最后一个主要血液学并发症是骨髓衰竭,定义为血细胞生成不足。在FA患者中观察到几种类型的失败,并且通常在MDS和AML之前。检测血细胞计数减少通常是用于评估治疗必要性和可能移植的第一个标志。虽然大多数FA患者最初对雄激素治疗和造血生长因子有反应,但这些已被证明可促进白血病,特别是在克隆性细胞遗传学异常的患者中,并且具有严重的副作用,包括肝腺瘤和腺癌。唯一的治疗方法是骨髓移植;然而,当供体不相关时(30%5年存活率),这种手术在FA患者中的成功率相对较低。因此,从HLA相同的兄弟姐妹移植是必要的。此外,由于FA患者对染色体损伤的易感性增加,移植前调理不能包括高剂量的放射或免疫抑制剂,因此患者发生移植物抗宿主病的机会增加。如果采取所有预防措施,并且骨髓移植在生命的最初十年内进行,则两年的生存概率可高达89%。但是,如果移植手术的年龄大于10岁,则两年生存率降至54%。[需要引证]
Zhang等人最近的一篇报道。研究FANCC - / - 细胞中骨髓衰竭的机制。[12]他们假设并成功证明了缺氧 - 复氧的连续循环,例如血红蛋白和祖细胞在高氧血液和缺氧骨髓组织之间迁移时所观察到的循环导致细胞过早衰老并因此抑制造血功能。衰老与细胞凋亡一起可能构成骨髓衰竭中发生的造血细胞耗竭的主要机制。
分子基础
这个标题并不简洁。 (2018年1月)
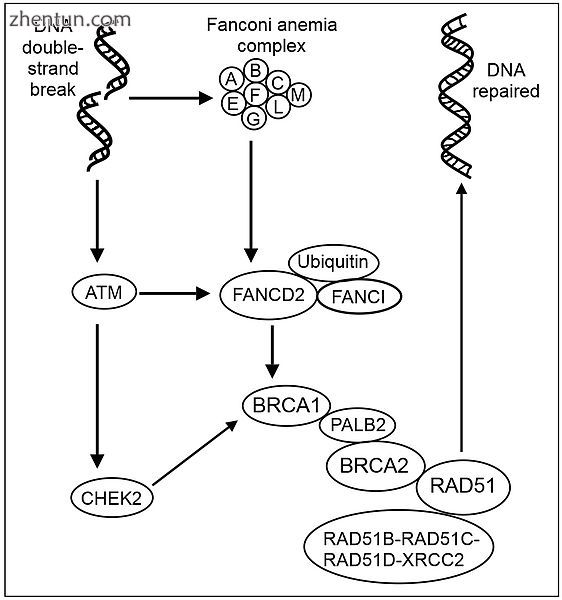
重组修复DNA双链损伤 - 一些关键步骤。 ATM(ATM)是一种蛋白激酶,由DNA双链断裂募集和激活。 DNA双链损伤也会激活Fanconi贫血核心复合体(FANCA / B / C / E / F / G / L / M)。[13] FA核心复合体单独泛化了下游目标FANCD2和FANCI。[14] ATM激活(磷酸化)CHEK2和FANCD2 [15] CHEK2使BRCA1磷酸化。[16]泛素化FANCD2与BRCA1和RAD51复合物。[17] PALB2蛋白作为中枢,[18]在DNA双链断裂位点汇集BRCA1,BRCA2和RAD51,并与RAD51旁系同源RAD51B-RAD51C-RAD51D-XRCC2成员RAD51C结合( BCDX2)。 BCDX2复合体负责RAD51在损伤部位的募集或稳定。[19] RAD51在双链断裂修复过程中在DNA的同源重组修复中起主要作用。在该过程中,发生ATP依赖性DNA链交换,其中单链侵入同源DNA分子的碱基配对链。 RAD51参与了该过程的同源性和链配对阶段的研究。
有19个基因负责FA,其中一个是乳腺癌易感基因BRCA2。他们参与受损DNA的识别和修复;遗传缺陷使他们无法修复DNA。当DNA由于损伤而停止复制时,通常激活8种蛋白质的FA核心复合物。核心复合物添加泛素,一种与另一簇中的BRCA2结合的小蛋白质来修复DNA(参见图DNA重组修复DNA双链损伤)。在该过程结束时,泛素被去除。[2]
最近的研究表明,这些蛋白中的8种,FANCA,-B,-C,-E,-F,-G,-L和-M组装在细胞核中形成核心蛋白复合物。根据目前的模型,复合物在FANCA和FANCE的核定位信号之后从细胞质移动到细胞核。通过复制应激激活装配,特别是由FANCM蛋白检测到的交联剂(如丝裂霉素C或顺铂)或活性氧(ROS)引起的DNA损伤。[20]
组装后,蛋白质核心复合物激活FANCL蛋白,其充当E3泛素连接酶和单泛素化FANCD2。[21] [22] [23] [24]
单泛素化的FANCD2,也称为FANCD2-L,然后继续与BRCA1 / BRCA2复合物相互作用(参见图解DNA双链损伤的重组修复)。细节尚不清楚,但类似的复合物参与基因组监测,并与涉及DNA修复和染色体稳定性的各种蛋白质相关联。[25] [26]由于复合物中任何FA蛋白的突变都很严重,DNA修复的效果要差得多,如其对交联剂如顺铂,二环氧丁烷[27]和丝裂霉素C引起的损伤的反应所示。骨髓对特别敏感这个缺陷。
在响应电离辐射的另一途径中,认为FANCD2被双链DNA断裂激活的蛋白质复合物ATM / ATR磷酸化,并参与S期检查点控制。在FA-D1或FA-D2患者中,通过放射抗性DNA合成的存在证明了该途径,这是S期检查点缺陷的标志。这种缺陷容易导致细胞不可控制的复制,并且还可能解释这些患者中AML的增加频率。
精子发生
在人类中,不育是FANC基因突变缺陷个体的特征之一。[28]在小鼠中,精原细胞,preleptotene精母细胞和瘦黄素,合子和早期粗线期的减数分裂阶段的精母细胞富含FANC蛋白。[28]该发现表明由FANC蛋白介导的重组修复过程在生殖细胞发育期间是活跃的,特别是在减数分裂期间,并且该活性的缺陷可导致不育。
神经干细胞稳态
微小症和小头畸形是FA患者的常见先天性缺陷。小鼠中FANCA和FANCG的丧失在早期发育神经发生期间和后期成人神经发生期间引起神经祖细胞凋亡。这导致神经干细胞池随着衰老而耗尽。[29] Fanconi贫血表型的大部分可能被解释为干细胞过早衰老的反映。[29]
治疗
第一线治疗是雄激素和造血生长因子,但只有50-75%的患者有反应。更永久的治疗方法是造血干细胞移植。[30]如果不存在潜在的捐赠者,可以通过胚胎植入前遗传学诊断(PGD)来设想救世主兄弟姐妹以匹配接受者的HLA类型。[31] [32]
预测
许多患者最终发展为急性髓性白血病(AML)。老年患者极易发生头颈部,食管,胃肠道,外阴和肛门癌。[33]已经成功进行骨髓移植并且因此治愈与FA相关的血液问题的患者仍然必须定期检查以观察癌症的迹象。许多患者没有到达成年期。
Fanconi患者面临的首要医疗挑战是他们的骨髓未能产生血细胞。此外,Fanconi患者通常出生时有各种先天缺陷。大量的Fanconi患者有肾脏问题,眼睛出现问题,发育迟缓和其他严重缺陷,如小头畸形(小头)。[34]
另见
Absent radius
BRCA2
PALB2
RecQ family
参考
Walden, Helen; Deans, Andrew J (April 17, 2014). "The Fanconi Anemia DNA Repair Pathway: Structural and Functional Insights into a Complex Disorder". Annu. Rev. Biophys. 43: 257–278. doi:10.1146/annurev-biophys-051013-022737. PMID 24773018.
Schwartz, Robert S.; d'Andrea, Alan D. (May 2010). "Susceptibility pathways in Fanconi's anemia and breast cancer". N. Engl. J. Med. 362 (20): 1909–1919. doi:10.1056/NEJMra0809889. PMC 3069698. PMID 20484397.
Rosenberg PS (2011). "How high are carrier frequencies of rare recessive syndromes? Contemporary estimates for Fanconi Anemia in the United States and Israel". American Journal of Medical Genetics Part A. 155: 1877–1883. doi:10.1002/ajmg.a.34087. PMC 3140593.
synd/61 at Who Named It?
Fanconi, G. "Familiäre, infantile perniciosähnliche Anämie (perniziöses Blutbild und Konstitution)". Jahrbuch für Kinderheilkunde.
Chirnomas SD, Kupfer GM (2013). "The inherited bone marrow failure syndromes". Pediatr Clin North Am. 60: 1291–310. doi:10.1016/j.pcl.2013.09.007. PMC 3875142. PMID 24237972.
Fanconi Anemia~clinical at eMedicine
Kutler DI, Auerbach AD (2004). "Fanconi anemia in Ashkenazi Jews". Fam. Cancer. 3 (3–4): 241–248. doi:10.1007/s10689-004-9565-8. PMID 15516848.
Mehta PA, et al. (2010). "Numerical chromosomal changes and risk of development of myelodysplastic syndrome-acute myeloid leukemia in patients with Fanconi anemia". Cancer Genetics. 203 (2): 180–186. doi:10.1016/j.cancergencyto.2010.07.127.
Butturini A; et al. (1994). "Hematologic abnormalities in Fanconi anemia: an International Fanconi Anemia Registry study". Blood. 84: 1650–4. PMID 8068955.
de Latour RP, et al. (2013). "Allogeneic hematopoietic stem cell transplantation in Fanconi anemia: the EBMT experience". Blood. 122: 4279–4286. doi:10.1182/blood-2013-01-479733.
Zhang X, Li J, Sejas DP, Pang Q (2005). "Hypoxia-reoxygenation induces premature senescence in FA bone marrow hematopoietic cells". Blood. 106 (1): 75–85. doi:10.1182/blood-2004-08-3033. PMID 15769896.
D'Andrea AD (2010). "Susceptibility pathways in Fanconi's anemia and breast cancer". N. Engl. J. Med. 362 (20): 1909–19. doi:10.1056/NEJMra0809889. PMC 3069698. PMID 20484397.
Sobeck A, Stone S, Landais I, de Graaf B, Hoatlin ME (2009). "The Fanconi anemia protein FANCM is controlled by FANCD2 and the ATR/ATM pathways". J. Biol. Chem. 284 (38): 25560–8. doi:10.1074/jbc.M109.007690. PMC 2757957. PMID 19633289.
Castillo P, Bogliolo M, Surralles J (2011). "Coordinated action of the Fanconi anemia and ataxia telangiectasia pathways in response to oxidative damage". DNA Repair (Amst.). 10 (5): 518–25. doi:10.1016/j.dnarep.2011.02.007. PMID 21466974.
Stolz A, Ertych N, Bastians H (2011). "Tumor suppressor CHK2: regulator of DNA damage response and mediator of chromosomal stability". Clin. Cancer Res. 17 (3): 401–5. doi:10.1158/1078-0432.CCR-10-1215. PMID 21088254.
Taniguchi T, Garcia-Higuera I, Andreassen PR, Gregory RC, Grompe M, D'Andrea AD (2002). "S-phase-specific interaction of the Fanconi anemia protein, FANCD2, with BRCA1 and RAD51". Blood. 100 (7): 2414–20. doi:10.1182/blood-2002-01-0278. PMID 12239151.
Park JY, Zhang F, Andreassen PR (2014). "PALB2: the hub of a network of tumor suppressors involved in DNA damage responses". Biochim. Biophys. Acta. 1846 (1): 263–75. doi:10.1016/j.bbcan.2014.06.003. PMC 4183126. PMID 24998779.
Chun J, Buechelmaier ES, Powell SN (2013). "Rad51 paralog complexes BCDX2 and CX3 act at different stages in the BRCA1-BRCA2-dependent homologous recombination pathway". Mol. Cell. Biol. 33 (2): 387–95. doi:10.1128/MCB.00465-12. PMC 3554112. PMID 23149936.
Deans AJ, West SC (December 2009). "FANCM connects the genome instability disorders Bloom's Syndrome and Fanconi Anemia". Mol. Cell. 36 (6): 943–53. doi:10.1016/j.molcel.2009.12.006. PMID 20064461.
Vandenberg CJ; Gergely F; Ong CY; et al. (2003). "BRCA1-independent ubiquitination of FANCD2". Mol. Cell. 12 (1): 247–254. doi:10.1016/S1097-2765(03)00281-8. PMID 12887909.
Garcia-Higuera I; Taniguchi T; Ganesan S; et al. (2001). "Interaction of the Fanconi anemia proteins and BRCA1 in a common pathway". Mol. Cell. 7 (2): 249–262. doi:10.1016/S1097-2765(01)00173-3. PMID 11239454.
Wang Y, Cortez D, Yazdi P, Neff N, Elledge SJ, Qin J (2000). "BASC, a super complex of BRCA1-associated proteins involved in the recognition and repair of aberrant DNA structures". Genes Dev. 14 (8): 927–39. doi:10.1101/gad.14.8.927. PMC 316544. PMID 10783165.
Cortez D, Wang Y, Qin J, Elledge SJ (1999). "Requirement of ATM-dependent phosphorylation of brca1 in the DNA damage response to double-strand breaks". Science. 286 (5442): 1162–1166. doi:10.1126/science.286.5442.1162. PMID 10550055.
Howlett NG; Taniguchi T; Olson S; et al. (2002). "Biallelic inactivation of BRCA2 in Fanconi anemia". Science. 297 (5581): 606–609. doi:10.1126/science.1073834. PMID 12065746.
Connor F; Bertwistle D; Mee PJ; et al. (1997). "Tumorigenesis and a DNA repair defect in mice with a truncating Brca2 mutation". Nat. Genet. 17 (4): 423–430. doi:10.1038/ng1297-423. PMID 9398843.
Auerbach AD, Rogatko A, Schroeder-Kurth TM (1989). "International Fanconi Anemia Registry: relation of clinical symptoms to diepoxybutane sensitivity". Blood. 73 (2): 391–6. doi:10.1007/978-3-642-74179-1_1. PMID 2917181.
Jamsai D, O'Connor AE, O'Donnell L, Lo JC, O'Bryan MK (2015). "Uncoupling of transcription and translation of Fanconi anemia (FANC) complex proteins during spermatogenesis". Spermatogenesis. 5 (1): e979061. doi:10.4161/21565562.2014.979061. PMC 4581071. PMID 26413409.
Sii-Felice K, Barroca V, Etienne O, Riou L, Hoffschir F, Fouchet P, Boussin FD, Mouthon MA (2008). "Role of Fanconi DNA repair pathway in neural stem cell homeostasis". Cell Cycle. 7 (13): 1911–5. doi:10.4161/cc.7.13.6235. PMID 18604174.
Fanconi Anemia~treatment at eMedicine
Page 29 in Moore, Pete (2007). The Debate About Genetic Engineering (Ethical Debates). New York, NY: Rosen Central. ISBN 1-4042-3754-2.
Verlinsky, Y; Rechitsky, S; Schoolcraft, W; Strom, C; Kuliev, A (2001). ", Preimplantation diagnosis for Fanconi anemia combined with HLA matching". JAMA. 285 (24): 3130–3133. doi:10.1001/jama.285.24.3130. PMID 11427142.
Institut Biologia Fonamental de Barcelona, "Constitutional chromosomal instability: a case with three primary and sequential cancers", USUJ 2009. Retrieved 2010-04-13
Anemia, Fanconi Archived February 22, 2014, at the Wayback Machine. |