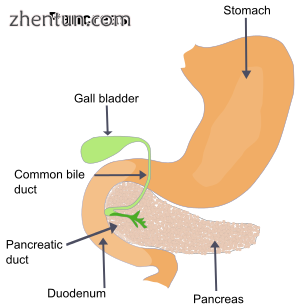
急性胰腺炎是胰腺的突然发炎。 频率顺序的原因包括胆总管中的胆结石超过胰管与其连接的点; 重酒精使用; 全身性疾病; 外伤; 在未成年人中,腮腺炎。 急性胰腺炎可能是单一事件; 它可能是经常性的; 或者它可能发展为慢性胰腺炎。
轻度病例通常采用保守措施成功治疗:住院治疗,控制疼痛,无口腔,静脉营养支持和静脉补液。 严重病例通常需要进入重症监护室以监测和控制疾病的并发症。 即使采用最佳管理,并发症也会导致高死亡率。
目录
1 症状和体征
1.1 常见
1.2 不寻常
2 并发症
3 原因
3.1 最常见的
3.2 不太常见
4 病理学
4.1 发病机制
4.2 病理生理学
4.3 组织病理学
5 诊断
5.1 鉴别诊断
5.2 生化
5.3 计算机断层扫描
5.4 磁共振成像
5.5 超声
6 严重程度分类:预后评分系统
6.1 Ranson得分
6.2 替代Ranson得分
6.3 APACHE II得分
6.4 Balthazar得分
6.5 格拉斯哥得分
6.6 BISAP得分
7 治疗
7.1 换液
7.2 疼痛控制
7.3 肠道休息
7.4 营养支持
7.5 氧
7.6 抗生素
7.7 ERCP
7.8 手术
7.9 其他措施
8 流行病学
9 参考
症状和体征
共同
严重的上腹部疼痛(上腹部疼痛)在50%的病例中向后辐射
恶心
呕吐
食欲不振
发热
发冷(发抖)
血流动力学不稳定,包括休克
心动过速(心跳加快)
呼吸窘迫
腹膜炎
嗝
虽然这些是常见的症状,但它们通常不会全部存在; 和胃疼痛可能是唯一的症状。
罕见
以下与严重疾病有关:
Gray-Turner征兆(侧腹出血性变色)
卡伦征兆(脐部出血性褪色)
胸腔积液(胸膜腔底液)
Grünwald征(瘀斑,大瘀伤,由于局部毒性损伤导致脐周围)
Körte征兆(胰头部所在区域的疼痛或阻力(在上腹部,脐部上方6-7厘米处))
Kamenchik标志(剑突下的压力疼痛)
Mayo-Robson征兆(在竖脊肌的侧面顶部和左侧第12肋骨下方(左肋角(CVA))按压疼痛[2]
Mayo-Robson观 - 内部2/3的边界上的一个点与线的外部1/3代表左上腹象限的二分,其中压力的压痛存在于胰腺疾病中。此时,胰腺尾部投射在腹壁上。
Pandiaraja标志 - 右腋下的瘀斑[3] [4]
并发症
局部并发症包括胰腺假性囊肿(最常见,多达25%的病例,通常在4-6周后发生)和痰/脓肿形成,脾动脉假性动脉瘤,糜烂导致脾动脉和静脉出血,脾静脉血栓形成,肠系膜上静脉和门静脉(频率降序),十二指肠梗阻,胆总管梗阻,慢性胰腺炎,胰腺腹水,胸腔积液,无菌/感染性胰腺坏死。[5]
全身并发症包括ARDS,多器官功能障碍综合征,DIC,低钙血症(来自脂肪皂化),高血糖和胰岛素依赖性糖尿病(来自产生胰岛素的胰岛素β细胞损伤),外分泌失败导致的吸收不良
新陈代谢
低钙血症,高血糖,高甘油三酯血症
呼吸
低氧血症,肺不张,积液,肺炎,急性呼吸窘迫综合征(ARDS)
肾
肾动脉或静脉血栓形成
肾功能衰竭
循环
心律失常
低血容量和休克
心肌梗死
心包积液
血管血栓形成
胃肠道
应激性溃疡引起的胃肠道出血;
胃静脉曲张(继发于脾静脉血栓形成)
胃肠道阻塞
肝胆
黄疸
门静脉血栓形成
神经
精神病或脑病(紊乱,妄想和昏迷)
脑栓塞
失明(血管性视网膜病变伴出血)
血液学
贫血
DIC
白细胞增多
皮肤科
疼痛的皮下脂肪坏死
其它
皮下脂肪坏死
关节痛
原因
最常见的
40%的患者因胆结石或壶腹壶腹部收缩引起胆道性胰腺炎
酒精占30%
特发性占15-25%的病例
代谢紊乱:遗传性胰腺炎,高钙血症,甘油三酯升高,营养不良
ERCP术后
腹部创伤
穿透性溃疡
胰腺癌和其他癌症的癌症
药物:利尿剂(如噻嗪类,呋塞米),格列吡嗪(如维格列汀,西他列汀,沙格列汀,利格列汀),四环素,磺胺类,雌激素,硫唑嘌呤和巯基嘌呤,喷他脒,水杨酸盐,类固醇,Depakote [需要引证]
感染:腮腺炎,病毒性肝炎,柯萨奇B病毒,巨细胞病毒,肺炎支原体,蛔虫
结构异常:胆总管,胰腺分裂
放射治疗
自身免疫性胰腺炎
不常见
蝎子毒液
中国肝吸虫
来自旁路手术的缺血
心脏瓣膜手术[6]
脂肪坏死
怀孕
腮腺炎以外的感染,包括水痘带状疱疹
甲状旁腺功能亢进症
丙戊酸
囊性纤维化
厌食症或贪食症
可待因磷酸盐反应[7] [8]
病理
发病
当胰腺内的消化酶异常激活时,发生急性胰腺炎。这通过在胰腺内称为酶原(或酶原)的非活性酶前体的不适当激活而发生,最显着的是胰蛋白酶原。通常,胰蛋白酶原在小肠的第一部分(十二指肠)中转化为其活性形式(胰蛋白酶),其中酶有助于蛋白质的消化。在急性胰腺炎发作期间,胰蛋白酶原与溶酶体酶(特别是组织蛋白酶)接触,溶酶体酶激活胰蛋白酶原至胰蛋白酶。然后,活性形式的胰蛋白酶导致其他胰蛋白酶原分子的进一步活化。这些消化酶的活化导致炎症,水肿,血管损伤,甚至细胞死亡。胰腺细胞的死亡通过两种主要机制发生:坏死,其组织较少且更具破坏性,或细胞凋亡,其更受控制。这两种细胞死亡机制之间的平衡是由调节细胞凋亡的半胱氨酸蛋白酶介导的,并且在胰腺炎期间具有重要的抗坏死功能:预防胰蛋白酶原激活,通过抑制polyADP-核糖聚合酶阻止ATP消耗,以及抑制细胞凋亡抑制剂(IAPs) 。然而,如果由于慢性乙醇暴露或通过严重损伤而使半胱天冬酶耗尽,那么坏死可能占主导地位。
病理生理学
两种类型的急性胰腺炎是轻度和严重的,其基于对细胞损伤的主要反应是炎症(轻度)还是坏死(严重)来定义。在轻度胰腺炎中,胰腺有炎症和水肿。在严重的胰腺炎中,胰腺坏死,附近的器官可能会受伤。
作为初始损伤的一部分,由于胰腺细胞合成和分泌炎症介质(主要是TNF-α和IL-1),因此存在广泛的炎症反应。急性胰腺炎的标志是炎症反应的表现,即向胰腺募集嗜中性粒细胞。炎症反应导致胰腺炎的继发性表现:毛细血管通透性的血容量不足,急性呼吸窘迫综合征,弥散性血管内凝血,肾衰竭,心血管衰竭和胃肠道出血。
组织病理学
急性胰腺炎(急性出血性胰腺坏死)的特征在于胰腺实质的急性炎症和坏死,胰腺脂肪的局灶性酶坏死和血管坏死(出血)。这些是通过胰酶的胰腺内活化产生的。脂肪酶活化导致胰腺间质和胰周间隙中的脂肪组织坏死以及血管损伤。坏死的脂肪细胞表现为阴影,细胞轮廓,缺乏细胞核,粉红色,细颗粒状细胞质。可以找到钙沉淀物(苏木精)。血管壁的消化导致血栓形成和出血。炎性浸润富含中性粒细胞。由于胰腺缺乏胶囊,炎症和坏死可以延伸到包括胰腺附近的筋膜层。
诊断
急性胰腺炎在临床上被诊断出来,但需要进行CT评估以区分轻度急性胰腺炎和严重坏死性胰腺炎。[引证需要]有经验的临床医生能够在大约34-39%的患者中发现严重的胰腺炎,这些患者后来有影像学确诊的严重坏死性胰腺炎。血液研究用于识别器官衰竭,提供预后信息,确定液体复苏是否足够,以及是否指示抗生素。
血液检查 - 全血细胞计数,肾功能检查,肝功能,血清钙,血清淀粉酶和脂肪酶,动脉血气,胰蛋白酶选择性检测[9]
影像学 - 三相腹部CT和腹部超声一起被认为是评估急性胰腺炎的金标准。包括腹部X射线在内的其他方式缺乏敏感性,不推荐使用。一个重要的警告是,在最初的12小时内进行成像可能会错误地让人放心,因为炎症和坏死过程通常需要48小时才能完全显现。
鉴别诊断
鉴别诊断包括:[10]
穿孔性消化性溃疡
胆绞痛
急性胆囊炎
肺炎
胸膜炎疼痛
心肌梗塞
生化
血清淀粉酶和脂肪酶水平升高,伴有严重的腹痛,常引发急性胰腺炎的初步诊断。 然而,他们在评估疾病严重程度方面没有任何作用。
血清脂肪酶从症状出现后上升4至8小时,并在治疗后7至14天内恢复正常。
对于急性或慢性胰腺炎(消耗的腺泡细胞团)和高甘油三酯血症的病例,血清淀粉酶可能是正常的(在10%的病例中)。
血清淀粉酶假阳性升高的原因包括唾液腺疾病(唾液淀粉酶升高),肠梗阻,梗塞,胆囊炎和穿孔性溃疡。
如果脂肪酶水平约为淀粉酶的2.5至3倍,则表明酒精会引起胰腺炎。[11]
血清钙下降
糖尿
关于这些测试的选择,两个实践指南规定:
“通常没有必要同时测量血清淀粉酶和脂肪酶。血清脂肪酶可能​​是优选的,因为它在一些非胰腺条件下保持正常,增加血清淀粉酶,包括大淀粉酶血症,腮腺炎和一些癌症。一般来说,血清脂肪酶被认为更多敏感和特异性比血清淀粉酶诊断急性胰腺炎“[12]
“虽然淀粉酶可广泛使用并提供可接受的诊断准确性,但在脂肪酶可用的情况下,它更适用于急性胰腺炎的诊断(建议A级)”[13]
大多数但并非所有个别研究都支持脂肪酶的优越性。[14]在一项大型研究中,没有胰腺炎患者的淀粉酶升高,脂肪酶正常[15]。另一项研究发现,淀粉酶可以增加脂肪酶的诊断价值,但前提是两项试验的结果与判别函数方程相结合。[16]
虽然经常引用的脂肪酶水平是正常上限的3倍或更多是胰腺炎的诊断,但也有其他鉴别诊断被认为与这种上升有关。[17]
CT检查
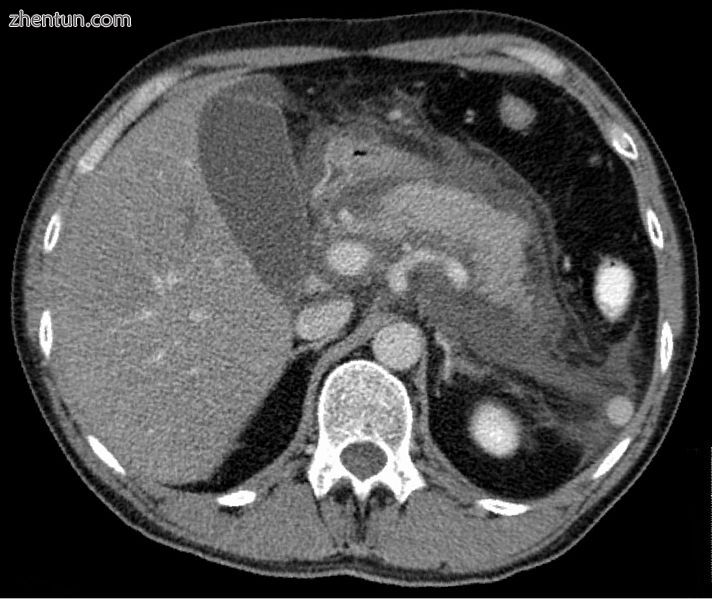
急性渗出性胰腺炎患者的轴向CT显示胰腺周围广泛的液体收集。
关于计算机断层扫描的需要,实践指南规定:
CT是急性胰腺炎的重要常见初始评估工具。如果出现以下情
急性胰腺炎的诊断尚不确定
有腹胀和压痛,发烧> 102,或白细胞增多
Ranson评分> 3或APACHE评分> 8
保守治疗72小时后没有改善
状态发生了急剧变化:发烧,疼痛或休克
在以下情况下,建议将CT作为延迟评估工具:
地位急剧变化
确定手术或介入放射学程序后的治疗反应
出院前重症急性胰腺炎患者
在症状出现的前12小时之前不应进行CT腹部,因为早期CT(<12小时)可能导致模棱两可或正常的发现。
CT Findings可分为以下类别,便于召回:
胰腺 - 弥漫性或节段性肿大,水肿,气泡,胰腺假性囊肿和痰/脓肿(初次发病后4至6周)
胰周/胰外 - 不规则胰腺轮廓,闭塞性胰周脂肪,腹膜后水肿,小脑囊内液体,左前肾上腺间隙液体
局部区域 - Gerota筋膜征(发炎的Gerota筋膜增厚,可见),胰腺腹水,胸腔积液(见于胸膜基底切口),动态肠梗阻等。
CT成像对治疗临床医生的主要价值在于能够识别由于缺血而已经坏死的胰腺失活区域。通过静脉造影增强CT成像可以可靠地识别胰腺坏死[18],并且如果发生感染并且指示手术或经皮清创术则具有价值。
磁共振成像
虽然计算机断层扫描被认为是急性胰腺炎诊断成像的金标准,但[19]磁共振成像(MRI)作为胰腺可视化的工具已变得越来越有价值,尤其是胰液收集和坏死性碎片。[20] MRI的额外效用包括其对CT对比材料过敏患者的成像指征,以及对出血,血管并发症,假性动脉瘤和静脉血栓形成的总体更大敏感性。[21]
MRI的另一个优点是其利用磁共振胰胆管造影(MRCP)序列。 MRCP提供了有关急性胰腺炎病因的有用信息,即胆小结石(胆总管结石或胆石症)和导管异常的存在[20]。临床试验表明,MRCP可作为急性胰腺炎的诊断工具,具有胆道病因学作为内镜逆行胰胆管造影术,但具有创伤小,并发症少的优点[22] [23]。
超声
腹部超声检查急性胰腺炎。
在腹部超声检查中,低回声和大体积胰腺的发现被认为是急性胰腺炎的诊断。[24]
严重程度分类:预后评分系统
急性胰腺炎患者在大多数病例中恢复。有些可能会出现脓肿,假性囊肿或十二指肠梗阻。在5%的病例中,可能导致ARDS(急性呼吸窘迫综合征),DIC(弥漫性血管内凝血)急性胰腺炎可进一步分为轻度和重度胰腺炎。
大多数情况下,Ranson标准用于确定急性胰腺炎的严重程度。在严重的胰腺炎中,严重的坏死量决定了进一步的临床结果。约20%的急性胰腺炎严重,死亡率约为20%。这是一个重要的分类,因为重症胰腺炎需要重症监护治疗,而轻度胰腺炎可以在普通病房治疗。
坏死后将出现全身炎症反应综合征(SIRS),并将确定即刻的临床过程。然后通过细菌感染确定进一步的临床过程。 SIRS是患者结肠细菌(革兰氏阴性)易位的原因。
有几种方法可以帮助区分这两种形式。一个是上面提到的Ranson分数。
在预测预后时,有几个评分指数已被用作生存的预测因子。两种这样的评分系统是Ranson标准和APACHE II(急性生理学和慢性健康评估)指数。大多数[25] [26]但并非所有[27]研究都报告说Apache分数可能更准确。在APACHE-II的阴性研究中,[27]使用APACHE-II 24小时评分而不是48小时评分。此外,研究中的所有患者都接受了两次超声检查,这可能影响了共同干预的分配。无论如何,只有APACHE-II可以在入场时完全计算出来。由于APACHE-II计算起来比较麻烦,可能只有实验室异常是脂肪酶或淀粉酶升高的患者不需要用APACHE-II进行评估;但是,这种方法没有研究过。
实践指南声明:
2006年:“在区分轻度和重度急性胰腺炎方面最有助于进行的两项测试是APACHE-II评分和血清红细胞压积。建议在住院的前3天内生成APACHE-II评分,之后根据需要有助于这种区别。还建议在入院时,入院后12小时和入院后24小时获得血清血细胞比容,以帮助评估液体复苏的充分性。“[12]
2005年:“即时评估应包括临床评估,特别是任何心血管,呼吸和肾脏损害,体重指数,胸部X线和APACHE II评分”[13]
兰森得分
主要文章:Ranson标准
Ranson评分用于预测急性胰腺炎的严重程度。它们于1974年推出。
入院时
年龄> 55岁
白细胞计数> 16000个细胞/ mm3
血糖> 11.1 mmol / L(> 200 mg / dL)
血清AST> 250 IU / L.
血清LDH> 350 IU / L.
在48小时
钙(血清钙<2.0 mmol / L(<8.0 mg / dL)
血细胞比容下降> 10%
氧气(低氧血症PO2 <60 mmHg)
IV液体水合后,BUN增加1.8或更多mmol / L(5或更多mg / dL)
碱缺乏(负碱基过量)> 4 mEq / L.
流体封存> 6升
点分配的标准是在48小时期间的任何时间都满足某个断点,因此在某些情况下可以在入场后不久计算。 它适用于胆结石和酒精性胰腺炎。
或者,可以通过满足以下任何一种来诊断胰腺炎:[2]
替代Ranson得分
Ranson评分≥8器官衰竭大量胰腺坏死(根据对比增强CT,至少30%腺体坏死)
解读如果得分≥3,可能是重症胰腺炎。 如果得分<3,重症胰腺炎不太可能或
得分0至2:2%死亡率得分3至4:15%死亡率得分5至6:40%死亡率得分7至8:死亡率100%
APACHE II得分
主要文章:APACHE II
“急性生理学和慢性健康评估”(APACHE II)得分> 8分预测死亡率为11%至18%[12]
出血性腹膜液
肥胖
器官衰竭的指标
低血压(SBP <90 mmHG)或心动过速> 130次/分
PO2 <60 mmHg
少尿(<50 mL / h)或增加BUN和肌酐
血清钙<1.90 mmol / L(<8.0 mg / dL)或血清白蛋白<33 g / L(<3.2 g / dL)>
Balthazar得分
由Emil J. Balthazar等人于20世纪90年代初开发,[28]计算机断层扫描严重程度指数(CTSI)是一种用于确定急性胰腺炎严重程度的分级系统。 数字CTSI最多有10个点,是Balthazar等级点和胰腺坏死等级点的总和:
Balthazar等级
Balthazar等级在CT CT等级上的外观
A级正常CT 0分
B级焦点或弥漫性扩大胰腺1点
C级胰腺异常和胰周炎2分
D级流体收集在一个位置3点
E级胰腺中或附近的两个或多个液体收集和/或气泡4个点
坏死评分
坏死率百分点
没有坏死0分
0~30%坏死2分
30至50%坏死4分
超过50%的坏死6分
许多研究表明CTSI对急性胰腺炎严重程度的分期比APACHE II,Ranson和C反应蛋白(CRP)水平更准确。[29] [30] [31] [32]然而,一些研究表明,CTSI与胰腺坏死患者的住院预后无显着相关性,也不是AP严重程度的准确预测因子[33] [34]。
格拉斯哥得分
格拉斯哥评分对胆结石和酒精诱导的胰腺炎均有效,而Ranson评分仅适用于酒精性胰腺炎[需要引证]。如果患者得分为3分或更高,则表明患有严重的胰腺炎,应考虑将患者转入国际电联。它是通过助记符PANCREAS得分的:
P - PaO2 <8kPa
A - 年龄> 55岁
N - 中性白细胞增多:WCC> 15x10(9)/ L.
C - 钙<2 mmol / L.
R - 肾功能:尿素> 16 mmol / L.
E - 酶:LDH> 600iu / L; AST> 200iu / L.
A - 白蛋白<32g / L(血清)
S - 糖:血糖> 10 mmol / L.
BISAP得分
用比Ranson标准更少的变量预测胰腺炎的死亡风险。数据应从患者评估的前24小时开始。
BUN> 25 mg / dL(8.9 mmol / L)
格拉斯哥昏迷评分<15时的精神状态异常
SIRS证据(全身炎症反应综合征)
患者年龄> 60岁
影像学研究显示胸腔积液
评分为零的患者的死亡率低于1%,而评分为5的患者的死亡率为22%。在验证队列中,BISAP评分具有与预测APACHE II评分的死亡率相似的测试表现特征。[35]由于许多其他评分系统存在问题,BISAP尚未经过验证,无法预测住院时间,ICU护理需求或干预需求等结果。
治疗
急性胰腺炎患者的初始治疗包括支持液体复苏,疼痛控制,无口腔和营养支持。
更换液体
对于所有患有急性胰腺炎的患者,以每小时5至10mL / kg的等渗晶体溶液(例如,生理盐水或乳酸林格氏液)的速率进行积极的水合,除非心血管,肾或其他相关的共病因素妨碍积极的液体替代。在严重体积减少的患者中,表现为低血压和心动过速,30分钟内给予20 mL / kg静脉输液更快速补充,然后3 mL / kg /小时,持续8至12小时。[36] [37]
在入院的前六个小时和接下来的24到48小时内,应经常重新评估液体需求。应根据临床评估,血细胞比容和血尿素氮(BUN)值调整液体复苏率。
在急性胰腺炎的初始阶段(在最初的12到24小时内),液体替代与发病率和死亡率的降低相关[38] [39] [40] [41]。
疼痛控制
腹痛通常是急性胰腺炎患者的主要症状,应该用镇痛药治疗。
阿片类药物在急性胰腺炎患者中提供疼痛控制是安全有效的。[42]足够的疼痛控制需要使用静脉注射阿片类药物,通常采用患者自控镇痛泵的形式。氢吗啡酮或芬太尼(静脉内)可用于急性胰腺炎的疼痛缓解。芬太尼因其更好的安全性而越来越多地被使用,特别是在肾功能损害方面。与其他阿片类药物一样,芬太尼可降低呼吸功能。它可以作为推注和持续输注给予。由于认为吗啡导致Oddi括约肌压力增加,因此哌替啶在历史上一直比吗啡更受青睐。然而,没有临床研究表明吗啡会加重或引起胰腺炎或胆囊炎。[43]此外,哌替啶具有短的半衰期,并且重复剂量可导致代谢物诺美哌啶的积累,其导致神经肌肉副作用,并且很少发生癫痫发作。
肠道休息
在急性胰腺炎的治疗中,治疗方法是停止给患者喂食,不给他们口服,给予静脉输液以防止脱水,并充分控制疼痛。由于胃中食物的存在刺激胰腺分泌酶,没有食物通过系统使胰腺得以休息。[引证需要]大约20%的患者在急性胰腺炎期间复发疼痛[44]。 ]大约75%的复发发生在口服再喂食的48小时内。
在口服再喂食之前,口服再喂食后复发的发生率可以通过幽门后肠内而不是肠外喂养来降低。[44] IMRIE评分也很有用。
营养支持
最近,管理范例从TPN(全胃肠外营养)转变为早期幽门后肠内喂养(其中饲管通过内窥镜或放射线引入十二指肠的第三部分)。肠内喂养的优点是它更具生理性,防止肠粘膜萎缩,并且不受TPN的副作用(例如真菌血症)。幽门后喂养的额外优点是胰腺外分泌分泌物与幽门养分输送距离的反比关系,以及降低的误吸风险。
鼻肠管饲管的缺点包括增加鼻窦炎的风险(特别是如果管保持在两周以上),即使在插管患者中仍然存在意外插管气管的风险(与流行的观点相反,气管导管相反)单独的袖带并不总是足以防止NG管进入气管)。
氧
如果Pao2水平低于70mm汞,则可以在一些患者中提供氧气(约30%)。
抗生素
高达20%的急性胰腺炎患者会在胰腺外发生感染,如血流感染,肺炎或尿路感染。[45]这些感染与死亡率增加有关。[46]怀疑感染时,应在确定感染源时开始使用抗生素。但是,如果培养物呈阴性并且未发现感染源,则应停用抗生素。
急性胰腺炎患者不推荐使用预防性抗生素,无论其类型(间质或坏死)或疾病严重程度(轻度,中度严重或严重)[47] [48]
ERCP
如果检测到胆结石,已知内镜逆行胰胆管造影术(ERCP)在成功取出结石后24至72小时内进行,可降低发病率和死亡率。[49]早期ERCP的适应症是:
24小时后临床恶化或缺乏改善
检测腹部CT上胆总管结石或扩张的肝内或肝外导管
ERCP的风险在于它可能使胰腺炎恶化,可能会引起感染,导致其他无菌性胰腺炎和出血。
手术
手术适用于(i)感染的胰腺坏死和(ii)诊断不确定性和(iii)并发症。急性胰腺炎最常见的死亡原因是继发感染。基于2个标准诊断感染
CT扫描气泡(占感染性坏死的20%~50%)
胰腺上的FNA(细针穿刺,通常是CT或US引导)的阳性细菌培养。
感染性坏死的手术方案包括:
微创管理 - 通过皮肤(左侧)或腹部的小切口进行坏死切除术
常规管理 - 简单引流的坏死切除术
封闭式管理 - 切除连续术后灌洗的坏死切除术
开放式管理 - 坏死切除术,计划分期再次手术,确定间隔(在某些情况下最多20次再次手术)
其他措施
事实证明,胰酶抑制剂不起作用。[50]
奥曲肽的使用已被证明不能改善预后。[51]
流行病学
在美国,每年发病率为每10万人中有18例急性胰腺炎,并且在美国有220,000例住院治疗。[52]在一项欧洲横断面研究中,从1985年到1995年,急性胰腺炎的发病率从每10万人每年12.4增加到15.9;然而,由于更好的结果,死亡率保持稳定。[53]另一项研究表明,随着时间的推移,发病率较低,为每10万人9.8,但也有类似的恶化趋势(从1963 - 74年的4.9增加)。[54]
在西方国家,最常见的原因是酒精,占美国急性胰腺炎病例的65%,瑞典占20%,英国占5%。在东方国家,胆结石是急性胰腺炎最常见的原因。急性胰腺炎的病因也因年龄组而异,创伤和全身性疾病(如感染)在儿童中更为常见。腮腺炎是青少年和年轻人比其他年龄组更常见的原因。
另见
Canine pancreatitis
Chronic pancreatitis
参考
Sommermeyer L (December 1935). "Acute Pancreatitis". American Journal of Nursing. 35 (12): 1157–1161. doi:10.2307/3412015. JSTOR 3412015.
Sriram Bhat M (2018-10-31). SRB's Clinical Methods in Surgery. JP Medical Ltd. pp. 488–. ISBN 978-93-5270-545-0.
http://www.sgmu.ru/edu/learn/stu ... ation/digestion.pdf[full citation needed]
Пропедевтика детских болезней с уходом за детьми, Капитан Т.В., 2006, page 290
Bassi C, Falconi M, Butturini G, Pederzoli P (2001). "Early complications of severe acute pancreatitis". In Holzheimer RG, Mannick JA. Surgical Treatment: Evidence-Based and Problem-Oriented. Munich: Zuckschwerdt.
Chung JW, Ryu SH, Jo JH, Park JY, Lee S, Park SW, Song SY, Chung JB (January 2013). "Clinical implications and risk factors of acute pancreatitis after cardiac valve surgery". Yonsei Medical Journal. 54 (1): 154–9. doi:10.3349/ymj.2013.54.1.154. PMC 3521256. PMID 23225812.
Hastier P, Buckley MJ, Peten EP, Demuth N, Dumas R, Demarquay JF, Caroli-Bosc FX, Delmont JP (November 2000). "A new source of drug-induced acute pancreatitis: codeine". The American Journal of Gastroenterology. 95 (11): 3295–8. doi:10.1111/j.1572-0241.2000.03213.x. PMID 11095359.
Moreno Escobosa MC, Amat López J, Cruz Granados S, Moya Quesada MC (2005). "Pancreatitis due to codeine". Allergologia et Immunopathologia. 33 (3): 175–7. doi:10.1157/13075703. PMID 15946633.
http://web5.cns.utexas.edu/news/2011/04/blood-activated-sensor/ Archived 2012-12-11 at Archive.is[full citation needed]
Bailey & Love's/24th/1123
Gumaste VV, Dave PB, Weissman D, Messer J (November 1991). "Lipase/amylase ratio. A new index that distinguishes acute episodes of alcoholic from nonalcoholic acute pancreatitis". Gastroenterology. 101 (5): 1361–6. PMID 1718808.
Banks PA, Freeman ML, et al. (Practice Parameters Committee of the American College of Gastroenterology) (October 2006). "Practice guidelines in acute pancreatitis". The American Journal of Gastroenterology. 101 (10): 2379–400. doi:10.1111/j.1572-0241.2006.00856.x. PMID 17032204.
UK Working Party on Acute Pancreatitis (May 2005). "UK guidelines for the management of acute pancreatitis". Gut. 54 Suppl 3 (Suppl 3): iii1–9. doi:10.1136/gut.2004.057026. PMC 1867800. PMID 15831893.
[improper synthesis?]In support of the superiority of the lipase:
Smith RC, Southwell-Keely J, Chesher D (June 2005). "Should serum pancreatic lipase replace serum amylase as a biomarker of acute pancreatitis?". ANZ Journal of Surgery. 75 (6): 399–404. doi:10.1111/j.1445-2197.2005.03391.x. PMID 15943725.
Treacy J, Williams A, Bais R, Willson K, Worthley C, Reece J, Bessell J, Thomas D (October 2001). "Evaluation of amylase and lipase in the diagnosis of acute pancreatitis". ANZ Journal of Surgery. 71 (10): 577–82. doi:10.1046/j.1445-2197.2001.02220.x. PMID 11552931.
Steinberg WM, Goldstein SS, Davis ND, Shamma'a J, Anderson K (May 1985). "Diagnostic assays in acute pancreatitis. A study of sensitivity and specificity". Annals of Internal Medicine. 102 (5): 576–80. doi:10.7326/0003-4819-102-5-576. PMID 2580467.
Lin XZ, Wang SS, Tsai YT, Lee SD, Shiesh SC, Pan HB, Su CH, Lin CY (February 1989). "Serum amylase, isoamylase, and lipase in the acute abdomen. Their diagnostic value for acute pancreatitis". Journal of Clinical Gastroenterology. 11 (1): 47–52. doi:10.1097/00004836-198902000-00011. PMID 2466075.
Keim V, Teich N, Fiedler F, Hartig W, Thiele G, Mössner J (January 1998). "A comparison of lipase and amylase in the diagnosis of acute pancreatitis in patients with abdominal pain". Pancreas. 16 (1): 45–9. doi:10.1097/00006676-199801000-00008. PMID 9436862.
Without support for the superiority of the lipase:
Ignjatović S, Majkić-Singh N, Mitrović M, Gvozdenović M (November 2000). "Biochemical evaluation of patients with acute pancreatitis". Clinical Chemistry and Laboratory Medicine. 38 (11): 1141–4. doi:10.1515/CCLM.2000.173. PMID 11156345.
Sternby B, O'Brien JF, Zinsmeister AR, DiMagno EP (December 1996). "What is the best biochemical test to diagnose acute pancreatitis? A prospective clinical study". Mayo Clinic Proceedings. 71 (12): 1138–44. doi:10.4065/71.12.1138. PMID 8945483.
Smith RC, Southwell-Keely J, Chesher D (June 2005). "Should serum pancreatic lipase replace serum amylase as a biomarker of acute pancreatitis?". ANZ Journal of Surgery. 75 (6): 399–404. doi:10.1111/j.1445-2197.2005.03391.x. PMID 15943725.
Corsetti JP, Cox C, Schulz TJ, Arvan DA (December 1993). "Combined serum amylase and lipase determinations for diagnosis of suspected acute pancreatitis". Clinical Chemistry. 39 (12): 2495–9. PMID 7504593.
Hameed AM, Lam VW, Pleass HC (February 2015). "Significant elevations of serum lipase not caused by pancreatitis: a systematic review". HPB. 17 (2): 99–112. doi:10.1111/hpb.12277. PMC 4299384. PMID 24888393.
Larvin M, Chalmers AG, McMahon MJ (June 1990). "Dynamic contrast enhanced computed tomography: a precise technique for identifying and localising pancreatic necrosis". BMJ. 300 (6737): 1425–8. doi:10.1136/bmj.300.6737.1425. PMC 1663140. PMID 2379000.
Arvanitakis M, Koustiani G, Gantzarou A, Grollios G, Tsitouridis I, Haritandi-Kouridou A, Dimitriadis A, Arvanitakis C (May 2007). "Staging of severity and prognosis of acute pancreatitis by computed tomography and magnetic resonance imaging-a comparative study". Digestive and Liver Disease. 39 (5): 473–82. doi:10.1016/j.dld.2007.01.015. PMID 17363349.
Scaglione M, Casciani E, Pinto A, Andreoli C, De Vargas M, Gualdi GF (October 2008). "Imaging assessment of acute pancreatitis: a review". Seminars in Ultrasound, CT, and MR. 29 (5): 322–40. doi:10.1053/j.sult.2008.06.009. PMID 18853839.
Miller FH, Keppke AL, Dalal K, Ly JN, Kamler VA, Sica GT (December 2004). "MRI of pancreatitis and its complications: part 1, acute pancreatitis". AJR. American Journal of Roentgenology. 183 (6): 1637–44. doi:10.2214/ajr.183.6.01831637. PMID 15547203.
Testoni PA, Mariani A, Curioni S, Zanello A, Masci E (June 2008). "MRCP-secretin test-guided management of idiopathic recurrent pancreatitis: long-term outcomes". Gastrointestinal Endoscopy. 67 (7): 1028–34. doi:10.1016/j.gie.2007.09.007. PMID 18179795.
Khalid A, Peterson M, Slivka A (August 2003). "Secretin-stimulated magnetic resonance pancreaticogram to assess pancreatic duct outflow obstruction in evaluation of idiopathic acute recurrent pancreatitis: a pilot study". Digestive Diseases and Sciences. 48 (8): 1475–81. doi:10.1023/A:1024747319606. PMID 12924639.
Dr. Dileep Kumar Jha, , Dr. Mahesh Vadel, Dr. Rahul Sharma (2013). "Role of Ultrasonography and Computed Tomography in Diagnosis of Pancreatitis" (PDF). International Journal of Science and Research (IJSR). 5 (8).
Larvin M, McMahon MJ (July 1989). "APACHE-II score for assessment and monitoring of acute pancreatitis". Lancet. 2 (8656): 201–5. doi:10.1016/S0140-6736(89)90381-4. PMID 2568529.
Yeung YP, Lam BY, Yip AW (May 2006). "APACHE system is better than Ranson system in the prediction of severity of acute pancreatitis". Hepatobiliary & Pancreatic Diseases International. 5 (2): 294–9. PMID 16698595. Archived from the original on 2006-10-26.
Chatzicostas C, Roussomoustakaki M, Vlachonikolis IG, Notas G, Mouzas I, Samonakis D, Kouroumalis EA (November 2002). "Comparison of Ranson, APACHE II and APACHE III scoring systems in acute pancreatitis". Pancreas. 25 (4): 331–5. doi:10.1097/00006676-200211000-00002. PMID 12409825. (comment=this study used a Apache cutoff of >=10)
Balthazar EJ, Robinson DL, Megibow AJ, Ranson JH (February 1990). "Acute pancreatitis: value of CT in establishing prognosis". Radiology. 174 (2): 331–6. doi:10.1148/radiology.174.2.2296641. PMID 2296641.
Gürleyik G, Emir S, Kiliçoglu G, Arman A, Saglam A (November 2005). "Computed tomography severity index, APACHE II score, and serum CRP concentration for predicting the severity of acute pancreatitis". Jop. 6 (6): 562–7. PMID 16286706.
Knoepfli AS, Kinkel K, Berney T, Morel P, Becker CD, Poletti PA (2007). "Prospective study of 310 patients: can early CT predict the severity of acute pancreatitis?". Abdominal Imaging. 32 (1): 111–5. doi:10.1007/s00261-006-9034-y. PMID 16944038.
Leung TK, Lee CM, Lin SY, Chen HC, Wang HJ, Shen LK, Chen YY (October 2005). "Balthazar computed tomography severity index is superior to Ranson criteria and APACHE II scoring system in predicting acute pancreatitis outcome". World Journal of Gastroenterology. 11 (38): 6049–52. doi:10.3748/wjg.v11.i38.6049. PMC 4436733. PMID 16273623.
Vriens PW, van de Linde P, Slotema ET, Warmerdam PE, Breslau PJ (October 2005). "Computed tomography severity index is an early prognostic tool for acute pancreatitis". Journal of the American College of Surgeons. 201 (4): 497–502. doi:10.1016/j.jamcollsurg.2005.06.269. PMID 16183486.
Triantopoulou C, Lytras D, Maniatis P, Chrysovergis D, Manes K, Siafas I, Papailiou J, Dervenis C (October 2007). "Computed tomography versus Acute Physiology and Chronic Health Evaluation II score in predicting severity of acute pancreatitis: a prospective, comparative study with statistical evaluation". Pancreas. 35 (3): 238–42. doi:10.1097/MPA.0b013e3180619662. PMID 17895844.
Mortelé KJ, Mergo PJ, Taylor HM, Wiesner W, Cantisani V, Ernst MD, Kalantari BN, Ros PR (October 2004). "Peripancreatic vascular abnormalities complicating acute pancreatitis: contrast-enhanced helical CT findings". European Journal of Radiology. 52 (1): 67–72. doi:10.1016/j.ejrad.2003.10.006. PMID 15380848.
Papachristou GI, Muddana V, Yadav D, O'Connell M, Sanders MK, Slivka A, Whitcomb DC (February 2010). "Comparison of BISAP, Ranson's, APACHE-II, and CTSI scores in predicting organ failure, complications, and mortality in acute pancreatitis". The American Journal of Gastroenterology. 105 (2): 435–41, quiz 442. doi:10.1038/ajg.2009.622. PMID 19861954.
Gardner TB, Vege SS, Pearson RK, Chari ST (October 2008). "Fluid resuscitation in acute pancreatitis". Clinical Gastroenterology and Hepatology. 6 (10): 1070–6. doi:10.1016/j.cgh.2008.05.005. PMID 18619920.
Haydock MD, Mittal A, Wilms HR, Phillips A, Petrov MS, Windsor JA (February 2013). "Fluid therapy in acute pancreatitis: anybody's guess". Annals of Surgery. 257 (2): 182–8. doi:10.1097/SLA.0b013e31827773ff. PMID 23207241.
Working Group IAP/APA Acute Pancreatitis Guidelines (2013). "IAP/APA evidence-based guidelines for the management of acute pancreatitis". Pancreatology. 13 (4 Suppl 2): e1–15. doi:10.1016/j.pan.2013.07.063. PMID 24054878.
Talukdar R, Swaroop Vege S (April 2011). "Early management of severe acute pancreatitis". Current Gastroenterology Reports. 13 (2): 123–30. doi:10.1007/s11894-010-0174-4. PMID 21243452.
Trikudanathan G, Navaneethan U, Vege SS (August 2012). "Current controversies in fluid resuscitation in acute pancreatitis: a systematic review". Pancreas. 41 (6): 827–34. doi:10.1097/MPA.0b013e31824c1598. PMID 22781906.
Gardner TB, Vege SS, Chari ST, Petersen BT, Topazian MD, Clain JE, Pearson RK, Levy MJ, Sarr MG (2009). "Faster rate of initial fluid resuscitation in severe acute pancreatitis diminishes in-hospital mortality". Pancreatology. 9 (6): 770–6. doi:10.1159/000210022. PMID 20110744.
Basurto Ona X, Rigau Comas D, Urrútia G (July 2013). "Opioids for acute pancreatitis pain". The Cochrane Database of Systematic Reviews. 7 (7): CD009179. doi:10.1002/14651858.CD009179.pub2. PMID 23888429.
Helm JF, Venu RP, Geenen JE, Hogan WJ, Dodds WJ, Toouli J, Arndorfer RC (October 1988). "Effects of morphine on the human sphincter of Oddi". Gut. 29 (10): 1402–7. doi:10.1136/gut.29.10.1402. PMC 1434014. PMID 3197985.
Petrov MS, van Santvoort HC, Besselink MG, Cirkel GA, Brink MA, Gooszen HG (September 2007). "Oral refeeding after onset of acute pancreatitis: a review of literature". The American Journal of Gastroenterology. 102 (9): 2079–84, quiz 2085. doi:10.1111/j.1572-0241.2007.01357.x. hdl:1874/26559. PMID 17573797.
Besselink MG, van Santvoort HC, Boermeester MA, Nieuwenhuijs VB, van Goor H, Dejong CH, Schaapherder AF, Gooszen HG (March 2009). "Timing and impact of infections in acute pancreatitis". The British Journal of Surgery. 96 (3): 267–73. doi:10.1002/bjs.6447. PMID 19125434.
Wu BU, Johannes RS, Kurtz S, Banks PA (September 2008). "The impact of hospital-acquired infection on outcome in acute pancreatitis". Gastroenterology. 135 (3): 816–20. doi:10.1053/j.gastro.2008.05.053. PMC 2570951. PMID 18616944.
Tenner S, Baillie J, DeWitt J, Vege SS (September 2013). "American College of Gastroenterology guideline: management of acute pancreatitis". The American Journal of Gastroenterology. 108 (9): 1400–15, 1416. doi:10.1038/ajg.2013.218. PMID 23896955.
Jafri NS, Mahid SS, Idstein SR, Hornung CA, Galandiuk S (June 2009). "Antibiotic prophylaxis is not protective in severe acute pancreatitis: a systematic review and meta-analysis". American Journal of Surgery. 197 (6): 806–13. doi:10.1016/j.amjsurg.2008.08.016. PMID 19217608.
Apostolakos MJ, Papadakos PJ (2001). The Intensive Care Manual. McGraw-Hill Professional. ISBN 978-0-07-006696-0.
DeCherney AH, Nathan L (2003). Current Obstetric & Gynecologic Diagnosis & Treatment. McGraw-Hill Professional. ISBN 978-0-8385-1401-6.
Peitzman AB, Schwab CW, Yealy DM, Fabian TC (2007). The Trauma Manual: Trauma and Acute Care Surgery. Lippincott Williams & Wilkins. ISBN 978-0-7817-6275-5.
Whitcomb DC (May 2006). "Clinical practice. Acute pancreatitis". The New England Journal of Medicine. 354 (20): 2142–50. doi:10.1056/NEJMcp054958. PMID 16707751.
Eland IA, Sturkenboom MJ, Wilson JH, Stricker BH (October 2000). "Incidence and mortality of acute pancreatitis between 1985 and 1995". Scandinavian Journal of Gastroenterology. 35 (10): 1110–6. doi:10.1080/003655200451261. PMID 11099067.
Goldacre MJ, Roberts SE (June 2004). "Hospital admission for acute pancreatitis in an English population, 1963-98: database study of incidence and mortality". BMJ. 328 (7454): 1466–9. doi:10.1136/bmj.328.7454.1466. PMC 428514. PMID 15205290. |