|
Jonas Salk in 1955 holds two bottles of a culture used to grow polio vaccines.

Jonas Salk于1955年拥有两瓶用于种植脊髓灰质炎疫苗的培养物。
疫苗是一种生物制剂,可为特定疾病提供活跃的获得性免疫。疫苗通常含有类似致病微生物的试剂,并且通常由微生物的弱化或杀死形式,其毒素或其表面蛋白之一制成。该药剂刺激身体的免疫系统,将药剂识别为威胁,摧毁它,并进一步识别和摧毁未来可能遇到的任何与该药剂相关的微生物。疫苗可以是预防性的(例如:预防或改善未来感染天然或“野生”病原体的影响),或治疗(例如,正在研究抗癌疫苗)。[1] [2] [3] [ 4]
视频1: ↓ 疫苗是如何工作的?
https://cache.tv.qq.com/qqplayerout.swf?vid=d07332rknym
疫苗的管理称为疫苗接种。疫苗接种是预防传染病的最有效方法; [5]疫苗接种导致的广泛免疫是全球根除天花和限制来自世界许多地区的脊髓灰质炎,麻疹和破伤风等疾病的主要原因。疫苗接种的有效性已得到广泛研究和验证;例如,流感疫苗,[6] HPV疫苗,[7]和水痘疫苗。[8]世界卫生组织(WHO)报告说,目前有许可疫苗可用于25种不同的可预防感染。[9]
术语疫苗和疫苗接种来自Variolae vaccinae(牛的天花),Edward Jenner设计的用于表示牛痘的术语。他在1798年使用它来研究被称为牛痘的Variolae疫苗的长期标题,其中他描述了牛痘对天花的保护作用。[10] 1881年,为了纪念詹纳,路易斯巴斯德提议将这些术语扩展到涵盖当时正在开发的新的保护性接种。[11]
内容
1 有效性
2 不利影响
3 类型
3.1 灭活
3.2 减毒
3.3 类毒素
3.4 亚基
3.5 结合
3.6 实验
3.7 Valence
3.8 异型
4 命名
5 培养免疫力
5.1 佐剂和防腐剂
6 附表
7 历史记录
7.1 时间轴
8 发展经济学
9 专利
10 生产
10.1 辅料
10.2 防腐剂的作用
11 输送系统
11.1 质粒
12 兽医
13 DIVA疫苗
13.1 第一批DIVA疫苗
13.2 在实践中使用
13.3 其他DIVA疫苗(正在开发中)
14 趋势
14.1 植物作为疫苗生产的生物反应器
15 另见
16参考资料
效用
疫苗历来是消灭和根除传染病的最有效手段。然而,存在对其有效性的限制。[12]有时,保护失败是因为宿主的免疫系统根本没有充分响应或根本没有响应。缺乏反应通常来自临床因素,如糖尿病,类固醇使用,HIV感染或年龄。[引证需要]如果宿主的免疫系统不包含任何能产生适合有效反应的抗体的B细胞株,它也可能因遗传原因而失败并与与病原体相关的抗原结合。
即使宿主确实产生抗体,保护可能也不充分;免疫可能发展得太慢而不能及时有效,抗体可能不会完全使病原体失效,或者可能存在多种病原体菌株,并非所有菌株都对免疫反应同样敏感。然而,甚至部分,晚期或弱免疫力,例如由对目标菌株以外的菌株的交叉免疫产生的免疫力,可以减轻感染,导致较低的死亡率,较低的发病率和较快的恢复。
佐剂通常用于增强免疫反应,特别是对于老年人(50-75岁及以上),其对简单疫苗的免疫反应可能已经减弱。[13]
Maurice Hilleman's measles vaccine is estimated to prevent 1 million deaths every year

莫里斯希勒曼的麻疹疫苗估计每年可以预防100万人死亡。[14]
疫苗的功效或性能取决于许多因素:
疾病本身(对于某些疾病疫苗接种比其他疾病表现更好)
疫苗株(某些疫苗对疾病的特定菌株具有特异性,或至少最有效)[15]
是否正确观察了疫苗接种计划。
对疫苗接种的特异反应;有些人对某些疫苗“无反应”,这意味着他们即使在正确接种疫苗后也不会产生抗体。
各种因素,如种族,年龄或遗传倾向。
如果接种疫苗的个体确实患有接种疫苗(突破性感染)的疾病,那么这种疾病可能比未接种疫苗的受害者的毒力更小。[16]
以下是疫苗接种计划有效性的重要考虑因素:
仔细建模以预测免疫运动将对中长期疾病的流行病学产生的影响
在引入新疫苗后对相关疾病进行持续监测
保持高免疫率,即使疾病变得罕见。
1958年,美国有763,094例麻疹病例;造成552人死亡。[17] [18]引入新疫苗后,病例数下降到每年不到150例(中位数为56)。[18] 2008年初,有64例疑似麻疹病例。其中54个感染与另一个国家的进口有关,尽管只有13%的感染实际上是在美国境外获得的; 64名患者中有63人从未接种过麻疹疫苗,或者不确定是否接种了疫苗。[18]
疫苗有助于根除天花,天花是人类最具传染性和致命性的疾病之一。其他疾病,如风疹,脊髓灰质炎,麻疹,腮腺炎,水痘和伤寒,都不像一百年前那么普遍。只要绝大多数人接种疫苗,疾病爆发就更加困难,更不用说传播了。这种效应称为群体免疫力。脊髓灰质炎仅在人类之间传播,其目标是广泛的根除运动,地方性脊髓灰质炎仅限于三个国家(阿富汗,尼日利亚和巴基斯坦)的一部分。[19]然而,接触所有儿童的困难以及文化上的误解导致预期的根除日期被错过了好几次。
疫苗还有助于预防抗生素耐药性的发展。例如,通过大大降低肺炎链球菌引起的肺炎发病率,疫苗计划大大降低了对青霉素或其他一线抗生素耐药的感染率。[20]
不利影响
儿童期接种疫苗通常是安全的。[21]如果有任何副作用通常是轻微的。[22]副作用的比率取决于所涉及的疫苗。[22]一些常见的副作用包括发烧,注射部位周围的疼痛和肌肉疼痛。[22]此外,一些人可能对疫苗中的成分过敏。[23] MMR疫苗很少与热性惊厥有关。[21]
严重的副作用极为罕见。[21]水痘疫苗很少与免疫缺陷个体的并发症有关,轮状病毒疫苗与肠套叠有中度相关[21]。
类型
Vaccine
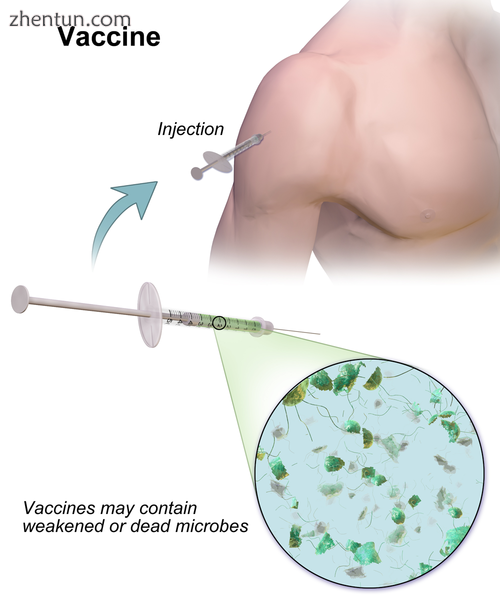
疫苗
Avian flu vaccine development by reverse genetics techniques.
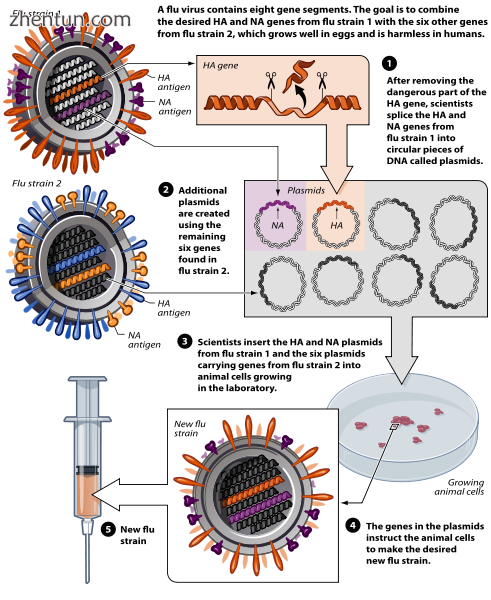
通过反向遗传学技术开发禽流感疫苗。
疫苗是死亡或灭活的生物或来自它们的纯化产物。
有几种类型的疫苗在使用。[24]这些代表了用于尝试降低疾病风险同时保留诱导有益免疫应答能力的不同策略。
灭活
主要文章:灭活疫苗
一些疫苗含有灭活的,但以前有毒的微生物,这些微生物已经被化学物质,热或辐射破坏。[25]例子包括脊髓灰质炎疫苗,甲型肝炎疫苗,狂犬病疫苗和一些流感疫苗。[需要引证]
视频2: ↓ 反疫苗接种学观点
https://cache.tv.qq.com/qqplayerout.swf?vid=i0733y91tlx
减毒
主要文章:减毒疫苗
一些疫苗含有活的减毒微生物。其中许多是活性病毒,它们是在使其毒性失效的条件下培育的,或者是使用密切相关但危险性较小的生物来产生广泛的免疫反应。虽然大多数减毒疫苗是病毒,但有些是细菌性的。例子包括病毒性疾病黄热病,麻疹,腮腺炎和风疹,以及细菌性伤寒。由Calmette和Guérin开发的活结核分枝杆菌疫苗不是由传染性菌株制成,而是含有一种被称为“BCG”的毒力修饰菌株,用于引发对疫苗的免疫应答。含有菌株耶尔森氏菌EV的减毒活疫苗用于鼠疫免疫。减毒疫苗有一些优点和缺点。它们通常会引起更持久的免疫反应,是健康成人的首选类型。但它们可能不适合用于免疫功能低下的个体,并且在极少数情况下会变异为致病形式并导致疾病。[26]
类毒素
类毒素疫苗是由灭活的有毒化合物制成的,这些化合物会导致疾病而不是微生物。[引证需要]基于类毒素的疫苗的例子包括破伤风和白喉。已知类毒素疫苗的功效。并非所有类毒素都用于微生物;例如,Crotalus atrox类毒素用于接种狗以抵抗响尾蛇咬伤。
亚基
蛋白质亚基 - 而不是将灭活或减毒的微生物引入免疫系统(构成“全剂”疫苗),它的一个片段可以产生免疫反应。例子包括亚单位疫苗乙型肝炎病毒仅由病毒的表面蛋白组成(先前从慢性感染患者的血清中提取,但现在通过将病毒基因重组到酵母中产生)或作为可食用的藻类疫苗,由人类乳头瘤病毒(HPV)组成的病毒样颗粒(VLP)疫苗,由病毒主要衣壳蛋白,和流感病毒的血凝素和神经氨酸酶亚基组成。亚单位疫苗用于瘟疫免疫接种。
结合
结合物 - 某些细菌具有免疫原性差的多糖外包衣。通过将这些外涂层与蛋白质(例如,毒素)连接起来,可以使免疫系统识别多糖,就好像它是蛋白质抗原一样。[引证需要]这种方法用于B型流感嗜血杆菌疫苗。
试验
Electroporation System for experimental "DNA vaccine" delivery
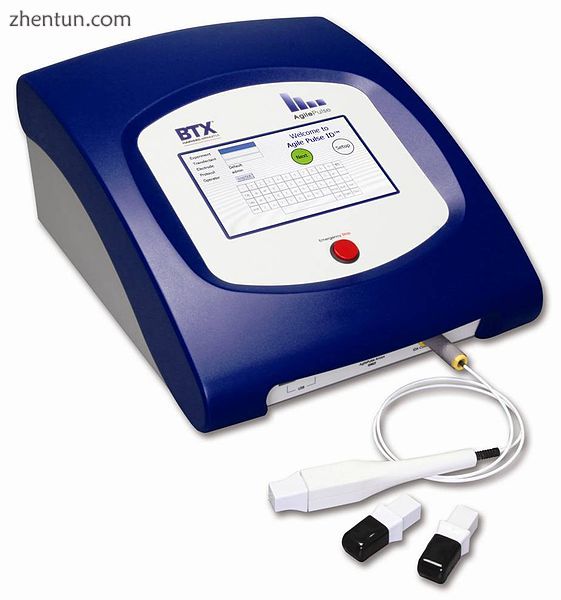
用于实验“DNA疫苗”递送的电穿孔系统
许多创新疫苗也在开发和使用中:
树突细胞疫苗将树突细胞与抗原结合,以将抗原呈递给身体的白细胞,从而刺激免疫反应。这些疫苗已经显示出治疗脑肿瘤的一些积极的初步结果[27],并且也在恶性黑素瘤中进行了测试[28]。
重组载体 - 通过结合一种微生物的生理学和另一种微生物的DNA,可以产生针对具有复杂感染过程的疾病的免疫力。一个例子是获得Merck许可的RVSV-ZEBOV疫苗,该疫苗于2018年用于对抗刚果的埃博拉病毒。[29]
DNA疫苗接种 - 一种替代的,实验性的疫苗接种方法,称为DNA疫苗接种,由感染因子的DNA产生,正在开发中。所提出的机制是将病毒或细菌DNA插入(和表达,通过使用电穿孔,触发免疫系统识别)到人或动物细胞中。识别表达的蛋白质的免疫系统的一些细胞将对这些蛋白质和表达它们的细胞发起攻击。因为这些细胞存活很长时间,如果通常表达这些蛋白质的病原体在以后遇到,它们将立即被免疫系统攻击。 DNA疫苗的一个潜在优势是它们非常容易生产和储存。截至2015年,DNA疫苗接种仍处于试验阶段,尚未获准用于人类使用。
正在使用谷热,口腔炎和特应性皮炎的模型开发T细胞受体肽疫苗用于几种疾病。已显示这些肽调节细胞因子的产生并改善细胞介导的免疫。
针对与补体抑制有关的已鉴定细菌蛋白的靶向将中和关键的细菌毒力机制。[30]
虽然大多数疫苗是使用来自微生物的灭活或减毒化合物产生的,但合成疫苗主要或完全由合成肽,碳水化合物或抗原组成。
价
疫苗可以是单价的(也称为单价的)或多价的(也称为多价的)。设计单价疫苗以针对单一抗原或单一微生物进行免疫。[31]设计多价或多价疫苗以针对相同微生物的两种或更多种菌株或针对两种或更多种微生物进行免疫。[32]多价疫苗的化合价可以用希腊语或拉丁语前缀(例如,四价或四价)表示。在某些情况下,单价疫苗可能更适合快速发展强免疫反应。[33]
异型
也称为异源或“Jennerian”疫苗,这些疫苗是其他动物的病原体,其在所治疗的生物体中不引起疾病或引起轻度疾病。典型的例子是Jenner使用牛痘来预防天花。目前的一个例子是使用由牛分枝杆菌制成的BCG疫苗来预防人类结核病。[34]
命名法
已经开发了各种相当标准化的疫苗名称缩写,尽管标准化决不是集中的或全球性的。例如,在美国使用的疫苗名称具有公认的缩写,这些缩写也广为人知并在其他地方使用。美国疾病控制和预防中心网页提供了可在美国疾病控制和预防中心网页上提供的可分类表中可自由访问的大量列表。[35]该页面解释说:“本表(第3栏)的缩写由疾病控制和预防中心,ACIP工作组的工作人员共同标准化,ACIP工作组,发病率和死亡率周报(MMWR)编辑,编辑流行病学和预防疫苗可预防疾病(粉红书),ACIP成员和ACIP的联络组织。“[35]一些例子是”DTaP“用于白喉和破伤风类毒素和无细胞百日咳疫苗,”DT“用于白喉和破伤风类毒素,破伤风和白喉类毒素的“Td”。在其破伤风疫苗接种页面[36]中,疾病预防控制中心进一步解释说,“这些缩写中的大写字母表示全强度剂量的白喉(D)和破伤风(T)类毒素和百日咳(P)疫苗。小写” d“和”p“表示青少年/成人制剂中使用的白喉和百日咳的剂量减少.DTaP和Tdap中的'a'代表'无细胞',意味着百日咳成分仅含有百日咳生物的一部分。 “[36]另一份确定的疫苗缩写清单在CDC的”疫苗缩略语和缩写“页面上,缩写用于美国免疫记录。[37]美国采用名称系统对疫苗名称的单词顺序有一些约定,首先是头名词,后面是形容词。这就是为什么“OPV”的USAN是“口服脊髓灰质炎病毒疫苗”而不是“口服脊髓灰质炎病毒疫苗”。
培养免疫力
免疫系统将疫苗剂识别为外来物,破坏它们并“记住”它们。当遇到毒性的毒剂时,身体识别出病毒上的蛋白质外壳,因此准备通过(1)在靶细胞进入细胞之前中和靶细胞,以及(2)识别和破坏受感染的细胞来做出反应。在那个代理人可以成倍增加之前。
当两种或多种疫苗在同一制剂中混合在一起时,这两种疫苗可能会发生干扰。这种情况最常见于减毒活疫苗,其中一种疫苗成分比其他疫苗成分更稳健,并抑制对其他成分的生长和免疫反应。这种现象首先在三价Sabin脊髓灰质炎疫苗中得到注意,疫苗中必须减少疫苗中血清型2病毒的数量,以防止其干扰疫苗中“1型”和3型病毒的“摄取”。[38]这种现象也被发现是目前正在研究的登革热疫苗的问题,[何时?]发现DEN-3血清型占优势并抑制对DEN-1,-2和-4血清型的反应。[39 ]
佐剂和防腐剂
疫苗通常含有一种或多种佐剂,用于增强免疫应答。例如,破伤风类毒素通常被吸附在明矾上。这使得抗原以比单纯的破伤风类毒素产生更大作用的方式呈递抗原。对吸附破伤风类毒素有不良反应的人可以在加强时给予简单的疫苗。
在1990年波斯湾运动的准备中,全细胞百日咳疫苗被用作炭疽疫苗的佐剂。与仅给予炭疽疫苗相比,这产生了更快的免疫反应,如果暴露可能即将来临,这会带来一些好处。
疫苗还可含有防腐剂以防止细菌或真菌污染。直到最近几年,防腐剂硫柳汞被用于许多不含活病毒的疫苗中。截至2005年,美国唯一一种含有大于痕量硫柳汞的儿童疫苗是流感疫苗,[40]目前仅推荐用于有某些危险因素的儿童。[41]英国提供的单剂量流感疫苗未在成分中列出硫柳汞(其英国名称)。防腐剂可用于疫苗生产的各个阶段,最先进的测量方法可能会检测成品中的痕量,因为它们可能在环境和整个人群中发现。[42]
时间表
主要文章:疫苗接种时间表
有关疫苗接种政策和做法的国别信息,请参阅:疫苗接种政策
为了提供最好的保护,建议儿童一旦其免疫系统充分发展以响应特定疫苗就接受疫苗接种,并且通常需要额外的“加强”注射来实现“完全免疫”。这导致了复杂的疫苗接种计划的发展。在美国,免疫实践咨询委员会建议为疾病控制和预防中心增加时间表,建议对儿童进行常规疫苗接种:[43]甲型肝炎,乙型肝炎,脊髓灰质炎,腮腺炎,麻疹,风疹,白喉,百日咳,破伤风,HiB,水痘,轮状病毒,流行性感冒,脑膜炎球菌病和肺炎。[44]建议使用大量疫苗和加强剂(2岁时最多注射24次)导致实现完全依从性的问题。为了对抗合规率下降,已经建立了各种通知系统,并且现在市场上出现了许多组合注射剂(例如,肺炎球菌结合疫苗和MMRV疫苗),其提供针对多种疾病的保护。
除了婴儿接种疫苗和助推器的建议外,许多特定疫苗被推荐用于其他年龄或终生重复注射 - 最常见的是麻疹,破伤风,流行性感冒和肺炎。经常筛查孕妇对风疹的持续抵抗力。人乳头瘤病毒疫苗推荐在美国(截至2011年)[45]和英国(截至2009年)。[46]针对老年人的疫苗建议集中于肺炎和流感,这对该群体更为致命。 2006年,一种针对带状疱疹的疫苗被引入,这是一种通常影响老年人的水痘病毒引起的疾病。
历史
Edward Jenner

爱德华詹纳
在引入牛痘病例(异型免疫)物质的疫苗接种之前,可以通过故意接种天花病毒来预防天花,后来将其称为变异,以区别于天花疫苗接种。 中国天花接种实践的最早提示出现在10世纪。[47] 中国人也实践了历史最悠久的变种术,其历史可以追溯到十五世纪。 他们实施了一种“鼻腔吹气”的方法,通过在鼻孔上吹粉状天花材料(通常是结痂)来进行。 在中国的十六和十七世纪,记录了各种吹气技术。[48]:60 1700年伦敦皇家学会收到两份关于中国接种实践的报告; 一位由Martin Lister博士接受了一份来自中国的东印度公司的员工和Clopton Havers的另一位员工的报告。[49]
Jenner's handwritten draft of the first vaccination

詹纳的第一次疫苗接种的手写草案
在1760年代后期的某个时候,作为外科医生/药剂师爱德华·詹纳(Edward Jenner)在学徒期间学习了这个故事,在农村地区很常见,乳品工人永远不会有常常致命或毁容的天花病,因为他们已经患有牛痘, 对人类非常温和的影响。 1796年,詹娜从带挤奶的挤奶女工的手中脓流,将其划入一名8岁男孩詹姆斯菲普斯的手臂,六周后用天花接种(变异)该男孩,然后观察他做了 不要抓天花。[50] [51] 詹纳延长了他的研究,并在1798年报告他的疫苗在儿童和成人中是安全的,并且可以从一臂到另一头转移,减少对受感染奶牛不确定供应的依赖。[10] 由于接种牛痘比接种天花更加安全,[52]后者虽然在英格兰仍广泛使用,但在1840年被禁止使用。[53]
French print in 1896 marking the centenary of Jenner's vaccine

1896年的法国印刷品标志着詹纳疫苗的百年纪念
第二代疫苗是由路易斯巴斯德在19世纪80年代引入的,他开发了鸡霍乱和炭疽疫苗,[11]并且从十九世纪末开始,疫苗被认为是国家声望的问题,并通过了强制性疫苗接种法。[50]
二十世纪出现了几种成功的疫苗,包括针对白喉,麻疹,腮腺炎和风疹的疫苗。 主要成就包括20世纪50年代脊髓灰质炎疫苗的开发和20世纪60年代和70年代根除天花。 Maurice Hilleman是二十世纪最多产的疫苗开发者。 随着疫苗变得越来越普遍,许多人开始认为它们是理所当然的。 然而,疫苗仍然难以治愈许多重要疾病,包括单纯疱疹,疟疾,淋病和艾滋病毒。[50] [54]
视频3: ↓ 关于疫苗安全的真相
https://cache.tv.qq.com/qqplayerout.swf?vid=s0733btymey
时间线
主要文章:疫苗的时间表
Vaccine timeline
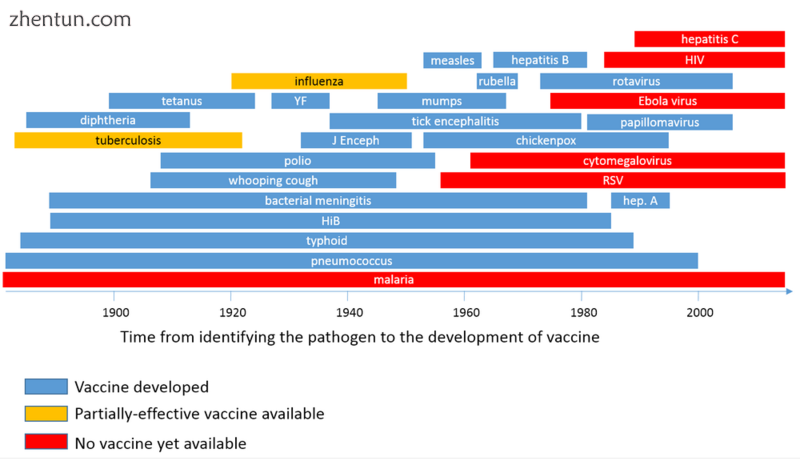
疫苗时间表
发展经济学
疫苗开发的一个挑战是经济:许多最需要疫苗的疾病,包括艾滋病毒,疟疾和肺结核,主要存在于贫穷国家。制药公司和生物技术公司没有动力为这些疾病开发疫苗,因为收入潜力很小。即使在较富裕的国家,财务回报通常很小,财务和其他风险也很大。[55]
迄今为止,大多数疫苗开发都依赖于政府,大学和非营利组织的“推动”资助。[56]许多疫苗具有很高的成本效益,对公众健康有益。[57]近几十年来,实际管理的疫苗数量急剧增加。[58]这种增加,特别是在进入学校之前对儿童施用的不同疫苗的数量可能是由于政府的授权和支持,而不是经济激励。
专利
提交疫苗开发过程专利也可视为新疫苗开发的障碍。由于通过最终产品专利提供的保护薄弱,对疫苗创新的保护通常是通过新疫苗开发过程中使用的专利以及保密来实现的。[59]
根据世界卫生组织的报告,欠发达国家当地疫苗生产的最大障碍不是专利,而是市场准入所需的大量金融,基础设施和劳动力专业知识要求。疫苗是生物化合物的复杂混合物,与药物不同,没有真正的通用疫苗。新设施生产的疫苗必须经过完整的临床试验,其安全性和有效性与原始制造商生产的疫苗相似。对于大多数疫苗,特定的过程已获得专利。这些可以通过替代制造方法来规避,但这需要研发基础设施和适当熟练的劳动力。对于一些相对较新的疫苗,如人乳头瘤病毒疫苗,这些专利可能会增加一个障碍。[60]
生产
Two workers make openings in chicken eggs in preparation for production of measles vaccine.

两名工人在鸡蛋中开口,准备生产麻疹疫苗。
疫苗生产有几个阶段。首先,产生抗原本身。病毒生长在原代细胞如鸡蛋(例如流感病毒)或连续细胞系(如培养的人类细胞(例如甲型肝炎))上。[61]细菌在生物反应器(例如b型流感嗜血杆菌)中生长。同样,可以在酵母,细菌或细胞培养物中产生衍生自病毒或细菌的重组蛋白。在产生抗原后,将其与用于产生抗原的细胞分离。病毒可能需要灭活,可能无需进一步纯化。重组蛋白质需要许多操作,包括超滤和柱层析。最后,根据需要通过添加佐剂,稳定剂和防腐剂来配制疫苗。佐剂增强抗原的免疫反应,稳定剂增加储存寿命,防腐剂允许使用多剂量小瓶。[62] [63]由于抗原与其他相关成分之间可能存在不相容性和相互作用,因此联合疫苗难以开发和生产。[64]
疫苗生产技术正在发展。与诸如鸡蛋之类的常规选择相比,预期培养的哺乳动物细胞变得越来越重要,因为更高的生产率和低污染问题的发生率。生产遗传解毒疫苗的重组技术预计会越来越受欢迎,用于生产使用类毒素的细菌疫苗。预计联合疫苗可通过使用与病原体相关的分子模式来减少它们所含抗原的数量,从而减少不良相互作用。[64]
2010年,印度生产了世界疫苗的60%,价值约9亿美元(6.7亿欧元)。[65]
辅料
除了活性疫苗本身,以下赋形剂和残留的制造化合物存在或可能存在于疫苗制剂中:[66]
加入铝盐或凝胶作为佐剂。添加佐剂以促进更早,更有效的反应,以及对疫苗更持久的免疫反应;它们允许较低的疫苗剂量。
在一些疫苗中加入抗生素以防止细菌在生产和储存疫苗期间生长。
流感和黄热病疫苗中存在鸡蛋蛋白,因为它们是使用鸡蛋制备的。可能存在其他蛋白质。
甲醛用于灭活类毒素疫苗的细菌产品。甲醛还用于灭活不需要的病毒并杀死可能在生产过程中污染疫苗的细菌。
谷氨酸钠(MSG)和2-苯氧基乙醇在少数疫苗中用作稳定剂,以帮助疫苗在暴露于热,光,酸或湿度时保持不变。
硫柳汞是一种含汞的抗菌剂,添加到含有一剂以上剂量的疫苗小瓶中,以防止潜在有害细菌的污染和生长。由于围绕硫柳汞的争议,除了多用途流感之外,它已从大多数疫苗中除去,在那里它被降低到水平,因此单剂量含有少于1微克汞,与吃10克罐装金枪鱼的水平相似。[67 ]
防腐剂的作用
许多疫苗需要防腐剂来预防严重的不良反应,例如葡萄球菌感染,在1928年的一次事件中,21名接种了缺乏防腐剂的白喉疫苗的儿童中有12人死亡。[68]有几种防腐剂可供选择,包括硫柳汞,苯氧乙醇和甲醛。硫柳汞对细菌更有效,具有更好的保质期,并提高疫苗的稳定性,效力和安全性;但是,在美国,欧盟和其他一些富裕国家,由于其含汞量,它不再被用作儿童疫苗的防腐剂,作为预防措施。[69]虽然有争议的说法是硫柳汞有助于自闭症,但没有令人信服的科学证据支持这些说法。[70]
输送系统
Woman receiving rubella vaccination, Brazil, 2008.

接受风疹接种的妇女,巴西,2008年。
新的递送系统的开发使疫苗的希望更加安全,更有效地提供和管理。研究方向包括脂质体和ISCOM(免疫刺激复合物)。[71]
疫苗递送技术的显着发展包括口服疫苗。从20世纪早期开始,在有效口服抗菌疫苗的可能性存在争议的时候,早期尝试使用口服疫苗的尝试表现出不同程度的希望。[72]到20世纪30年代,人们越来越关注口腔伤寒疫苗的预防价值。[73]
口服脊髓灰质炎疫苗在未经正式培训的情况下由志愿者工作人员进行疫苗接种时效果良好;结果还表明增加疫苗接种的容易性和效率。有效的口服疫苗有许多优点;例如,没有血液污染的风险。用于口服给药的疫苗不一定是液体,作为固体,它们通常更稳定,不易损坏或在运输和储存时因冷冻而变质。[74]这种稳定性降低了对“冷链”的需求:将疫苗保持在从制造阶段到施用点的受限温度范围内所需的资源,这反过来可以降低疫苗的成本。
仍处于开发阶段的微针方法使用“制成阵列的尖锐突起,可以通过皮肤形成疫苗递送途径”。[75]
实验性无针[76]疫苗输送系统正在进行动物试验。[77] [78]类似于胶粘绷带的邮票大小的贴片每平方厘米包含约20,000个微观投影。[79]这种皮肤给药可能会提高疫苗接种效率,同时需要的疫苗数量少于注射疫苗。[80]
质粒
质粒的使用已在临床前研究中作为癌症和传染病的保护性疫苗策略得到验证。 然而,在人体研究中,这种方法未能提供临床相关的益处。 质粒DNA免疫的总体功效取决于增加质粒的免疫原性,同时还纠正参与免疫效应细胞特异性激活的因子。[81]
老兵专用医药
另见:流感疫苗§非人类流感疫苗和狗的疫苗接种
Goat vaccination against sheep pox and pleural pneumonia

针对绵羊痘和胸膜肺炎的山羊疫苗接种
动物接种既可用于预防感染疾病,也可用于预防疾病传播给人类。[82]两只动物都像宠物一样饲养,动物饲养的动物经常接种疫苗。在某些情况下,可以接种野生种群。这有时通过在疾病易发区域扩散的疫苗来实现,并且已经被用于试图控制浣熊中的狂犬病。
狂犬病发生时,法律可能要求对狗进行狂犬病疫苗接种。其他犬类疫苗包括犬瘟热,犬细小病毒,传染性犬肝炎,腺病毒-2,钩端螺旋体病,博德特拉菌,犬副流感病毒和莱姆病等。
已经记录了人类使用的兽用疫苗的情况,无论是有意还是无意,有些病例,特别是布鲁氏菌病。[83]但是,报告此类案件的情况很少,而且对此类案件的安全性和结果的研究很少。随着兽医诊所对伴侣动物的气溶胶疫苗接种的出现,近年来人类暴露于非天然携带的病原体,如支气管炎博德特氏菌,可能会增加。[83]在某些情况下,最明显的是狂犬病,针对病原体的平行兽医疫苗可能比人类更经济一个数量级。
DIVA疫苗
DIVA(区分受感染动物的疫苗)疫苗可以区分感染和接种疫苗的动物。
DIVA疫苗携带至少一个比在田间循环的微生物少的表位。检测针对该表位的抗体的伴随诊断测试允许我们实际上进行该分化。
首批DIVA疫苗
J.T.开发了第一种DIVA疫苗(以前称为标记疫苗,自1999年以来被称为DIVA疫苗)和伴随诊断试验。 van Oirschot及其同事在荷兰莱利斯塔德的中央兽医研究所工作。[84] [85]他们发现一些针对伪狂犬病的现有疫苗(也称为Aujeszky病)在其病毒基因组(其中包括gE基因)中具有缺失。针对该缺失产生单克隆抗体,并选择该抗体以开发显示针对gE的抗体的ELISA。此外,还构建了新型基因工程gE阴性疫苗。[86]同样,DIVA疫苗和针对牛疱疹病毒1感染的伴随诊断测试已经开发出来。[87] [88]
在实践中使用
DIVA战略已在各个国家得到应用,并成功根除了伪狂犬病病毒。通过伴随诊断试验对猪群进行集中接种和监测,随后从群体中移除感染的猪。牛疱疹病毒1 DIVA疫苗也在实践中广泛使用。
其他DIVA疫苗(正在开发中)
科学家已经并且仍在努力将DIVA原则应用于广泛的传染病,例如,典型的猪瘟,[89]禽流感,[90]胸膜肺炎放线杆菌[91]和沙门氏菌感染在猪。[92]
趋势
Ambox当前red.svg
此部分需要更新。请更新此文章以反映最近的事件或新的可用信息。 (2018年6月)
疫苗开发有几个趋势:[93]
直到最近,[何时?]大多数疫苗都针对婴儿和儿童,但青少年和成年人越来越多地成为目标。[93] [94]
疫苗的组合正变得越来越普遍;世界上许多地方都使用含有五种或更多种成分的疫苗。[93]
正在开发新的疫苗接种方法,[何时?]如皮肤贴片,通过吸入装置的气溶胶和食用转基因植物。[93]
疫苗被设计用于刺激先天免疫反应,以及适应性。[93]
正在努力开发疫苗以帮助治愈慢性感染,而不是预防疾病。[93]
正在开发疫苗以防御炭疽,瘟疫和天花等生物恐怖袭击。[93]
对疫苗反应中性别和妊娠差异的鉴赏“可能会改变公共卫生官员使用的策略”。[95]
科学家们现在正试图通过重建病毒的外部结构来开发合成疫苗,这将有助于防止疫苗接种。[96]
控制免疫反应的原则现在可以用于针对许多非传染性人类疾病的定制疫苗,例如癌症和自身免疫性疾病。[97]例如,已经研究了实验性疫苗CYT006-AngQb作为高血压的可能治疗方法。[98]影响疫苗开发趋势的因素包括翻译医学,人口统计学,监管科学,政治,文化和社会反应方面的进展。[99]
植物作为疫苗生产的生物反应器
已经将转基因植物鉴定为用于疫苗生产的有希望的表达系统。复杂的植物如烟草,马铃薯,番茄和香蕉可以插入基因,使它们产生可用于人类的疫苗。[100]已经开发出香蕉,其产生针对乙型肝炎的人疫苗。[101]另一个例子是在苜蓿转基因植物中表达融合蛋白,用于选择性地定向抗原呈递细胞,从而提高针对牛病毒性腹泻病毒(BVDV)的疫苗效力。[102] [103]
也可以看看
流行病预防创新联盟
飞行注射器
马命名为吉姆
免疫登记
免疫治疗
疫苗成分清单
疫苗主题清单
疫苗的非特异性作用
OPV艾滋病假说
反向疫苗学
参考:
1. Melief C, van Hall T, Arens R, Ossendorp F, van der Burg S (2015). "Therapeutic cancer vaccines". J Clin Invest. 125 (9): 3401–12. doi:10.1172/JCI80009. PMC 4588240 Freely accessible. Archived from the original on 2017-06-29.
2. Bol K, et al. (2016). "Prophylactic vaccines are potent activators of monocyte-derived dendritic cells and drive effective anti-tumor responses in melanoma patients at the cost of toxicity". Cancer Immunology, Immunotherapy. 65 (3): 327–39. doi:10.1007/s00262-016-1796-7. PMC 4779136 Freely accessible.
3. Brotherton J (2015). "HPV prophylactic vaccines: lessons learned from 10 years experience". Future Medicine. 10 (8): 999–1009. doi:10.2217/fvl.15.60.
4. Frazier I (2014). "Development and Implementation of Papillomavirus Prophylactic Vaccines". J. Immunol. 192 (9): 4007–11. doi:10.4049/jimmunol.1490012. Archived from the original on 2017-08-11.
5.United States Centers for Disease Control and Prevention (2011). A CDC framework for preventing infectious diseases. Archived 2017-08-29 at the Wayback Machine. Accessed 11 September 2012. "Vaccines are our most effective and cost-saving tools for disease prevention, preventing untold suffering and saving tens of thousands of lives and billions of dollars in healthcare costs each year."
American Medical Association (2000). Vaccines and infectious diseases: putting risk into perspective. Archived 2015-02-05 at the Wayback Machine. Accessed 11 September 2012. "Vaccines are the most effective public health tool ever created."
Public Health Agency of Canada. Vaccine-preventable diseases. Archived 2015-03-13 at the Wayback Machine. Accessed 11 September 2012. "Vaccines still provide the most effective, longest-lasting method of preventing infectious diseases in all age groups."
United States National Institute of Allergy and Infectious Diseases (NIAID). NIAID Biodefense Research Agenda for Category B and C Priority Pathogens. Archived 2016-03-04 at the Wayback Machine. Accessed 11 September 2012. "Vaccines are the most effective method of protecting the public against infectious diseases."
6. Fiore AE, Bridges CB, Cox NJ (2009). "Seasonal influenza vaccines". Curr. Top. Microbiol. Immunol. Current Topics in Microbiology and Immunology. 333: 43–82. doi:10.1007/978-3-540-92165-3_3. ISBN 978-3540921646. PMID 19768400.
7. Chang Y, Brewer NT, Rinas AC, Schmitt K, Smith JS (July 2009). "Evaluating the impact of human papillomavirus vaccines". Vaccine. 27 (32): 4355–62. doi:10.1016/j.vaccine.2009.03.008. PMID 19515467.
8. Liesegang TJ (August 2009). "Varicella zoster virus vaccines: effective, but concerns linger". Can. J. Ophthalmol. 44 (4): 379–84. doi:10.3129/i09-126. PMID 19606157.
9. World Health Organization, Global Vaccine Action Plan 2011-2020. Archived 2014-04-14 at the Wayback Machine. Geneva, 2012.
10. Baxby, Derrick (1999). "Edward Jenner's Inquiry; a bicentenary analysis". Vaccine. 17 (4): 301–07. doi:10.1016/s0264-410x(98)00207-2. PMID 9987167.
11. Pasteur, Louis (1881). "Address on the Germ Theory". Lancet. 118 (3024): 271–72. doi:10.1016/s0140-6736(02)35739-8.
12. Grammatikos, Alexandros P.; Mantadakis, Elpis; Falagas, Matthew E. (June 2009). "Meta-analyses on Pediatric Infections and Vaccines". Infectious Disease Clinics of North America. 23 (2): 431–57. doi:10.1016/j.idc.2009.01.008. PMID 19393917.
13. Neighmond, Patti (2010-02-07). "Adapting Vaccines For Our Aging Immune Systems". Morning Edition. NPR. Archived from the original on 2013-12-16. Retrieved 2014-01-09.open access publication – free to read
14. Sullivan, Patricia (2005-04-13). "Maurice R. Hilleman dies; created vaccines". Wash. Post. Archived from the original on 2012-10-20. Retrieved 2014-01-09.open access publication – free to read
15. Schlegel; et al. (August 1999). "Comparative efficacy of three mumps vaccines during disease outbreak in eastern Switzerland: cohort study". BMJ. 319 (7206): 352. doi:10.1136/bmj.319.7206.352. PMC 32261 Freely accessible. PMID 10435956. Archived from the original on 2014-01-10. Retrieved 2014-01-09.open access publication – free to read
16. Préziosi, M.; Halloran, M.E. (2003). "Effects of Pertussis Vaccination on Disease: Vaccine Efficacy in Reducing Clinical Severity". Clinical Infectious Diseases. Oxford Journals. 37 (6): 772–79. doi:10.1086/377270.
17. Orenstein WA, Papania MJ, Wharton ME (2004). "Measles elimination in the United States". J Infect Dis. 189 (Suppl 1): S1–3. doi:10.1086/377693. PMID 15106120.
18. "Measles—United States, January 1 – April 25, 2008". Morb. Mortal. Wkly. Rep. 57 (18): 494–98. May 2008. PMID 18463608. Archived from the original on October 11, 2017.open access publication – free to read
19. "WHO South-East Asia Region certified polio-free". WHO. 27 March 2014. Archived from the original on 27 March 2014. Retrieved November 3, 2014.
20. 19 July 2017 Vaccines promoted as key to stamping out drug-resistant microbes "Immunization can stop resistant infections before they get started, say scientists from industry and academia." Archived 22 July 2017 at the Wayback Machine.
21. Maglione, M. A.; Das, L.; Raaen, L.; Smith, A.; Chari, R.; Newberry, S.; Shanman, R.; Perry, T.; Goetz, M. B.; Gidengil, C. (1 July 2014). "Safety of Vaccines Used for Routine Immunization of US Children: A Systematic Review". Pediatrics. 134 (2): 325–37. doi:10.1542/peds.2014-1079. PMID 25086160.
22. "Possible Side-effects from Vaccines". Centers for Disease Control and Prevention. Archived from the original on 17 March 2017. Retrieved 24 February 2014.
23. "Seasonal Flu Shot – Seasonal Influenza (Flu)". CDC. Archived from the original on 2015-10-01.
24. "Vaccine Types". National Institute of Allergy and Infectious Diseases. 2012-04-03. Archived from the original on 2015-09-05. Retrieved 2015-01-27.
25. "Types of Vaccines". Archived from the original on 2017-07-29. Retrieved October 19, 2017.
26. J.K. Sinha; S. Bhattacharya. A Text Book of Immunology (Google Book Preview). Academic Publishers. p. 318. ISBN 978-8189781095. Retrieved 2014-01-09.
27. Kim W, Liau LM (2010). "Dendritic cell vaccines for brain tumors". Neurosurg Clin N Am. 21 (1): 139–57. doi:10.1016/j.nec.2009.09.005. PMC 2810429 Freely accessible. PMID 19944973.
28. Anguille, S; Smits, EL; Lion, E; van Tendeloo, VF; Berneman, ZN (June 2014). "Clinical use of dendritic cells for cancer therapy". The Lancet. Oncology. 15 (7): e257–67. doi:10.1016/s1470-2045(13)70585-0. PMID 24872109.
29. McKenzie, David (26 May 2018). "Fear and failure: How Ebola sparked a global health revolution". CNN. Retrieved 26 May 2018.
30. Meri, S; Jördens, M; Jarva, H (December 2008). "Microbial complement inhibitors as vaccines". Vaccine. 26 Suppl 8: I113–17. doi:10.1016/j.vaccine.2008.11.058. PMID 19388175.
31. "Monovalent" at Dorland's Medical Dictionary
32. Polyvalent vaccine at Dorlands Medical Dictionary Archived March 7, 2012, at the Wayback Machine.
33. "Questions And Answers On Monovalent Oral Polio Vaccine Type 1 (mOPV1)'Issued Jointly By WHO and UNICEF'". Pediatric Oncall. 2 (8). 3. What advantages does mOPV1 have over trivalent oral polio vaccine (tOPV)?. 2005-01-08. Archived from the original on 2012-02-29.
34. Scott (April 2004). "Classifying Vaccines" (PDF). BioProcesses International: 14–23. Archived (PDF) from the original on 2013-12-12. Retrieved 2014-01-09.
35. Centers for Disease Control and Prevention, U.S. Vaccine Names, archived from the original on 2016-05-26, retrieved 2016-05-21.
36. Centers for Disease Control and Prevention, Tetanus (Lockjaw) Vaccination, archived from the original on 2016-05-16, retrieved 2016-05-21.
37. Centers for Disease Control and Prevention, Vaccine Acronyms and Abbreviations [Abbreviations used on U.S. immunization records], archived from the original on 2017-06-02, retrieved 2017-05-22.
38. Sutter RW, Cochi SL, Melnick JL (1999). "Live attenuated polio vaccines". In Plotkin SA, Orenstein WA. Vaccines. Philadelphia: W. B. Saunders. pp. 364–408.
39. Kanesa-thasan N, Sun W, Kim-Ahn G, et al. (2001). "Safety and immunogenicity of attenuated dengue virus vaccines (Aventis Pasteur) in human volunteers". Vaccine. 19 (23–24): 3179–88. doi:10.1016/S0264-410X(01)00020-2. PMID 11312014.
40. "Institute for Vaccine Safety – Thimerosal Table". Archived from the original on 2005-12-10.
41. Wharton, Melinda E.; National Vaccine Advisory committee "U.S.A. national vaccine plan" Archived 2016-05-04 at the Wayback Machine.
42.http://www.npl.co.uk/environment ... nts/ngp_metals.html Archived 29 September 2007 at the Wayback Machine.
43. "ACIP Vaccine Recommendations Home Page". CDC. 2013-11-15. Archived from the original on 2013-12-31. Retrieved 2014-01-10.
44. "Vaccine Status Table". Red Book Online. American Academy of Pediatrics. April 26, 2011. Archived from the original on December 27, 2013. Retrieved January 9, 2013.
45. "HPV Vaccine Safety". Centers for Disease Control and Prevention (CDC). 2013-12-20. Archived from the original on 2009-11-10. Retrieved 2014-01-10.
46. "HPV vaccine in the clear". NHS choices. 2009-10-02. Archived from the original on 2014-01-10. Retrieved 2014-01-10.open access publication – free to read
47. Needham, Joseph. (2000). Science and Civilization in China: Volume 6, Biology and Biological Technology, Part 6, Medicine. Cambridge: Cambridge University Press. p.154
48. Williams, Gareth (2010). Angel of Death. Basingstoke: Palgrave Macmillan. ISBN 978-0230274716.
49. Silverstein, Arthur M. (2009). A History of Immunology (2nd ed.). Academic Press. p. 293. ISBN 978-0080919461..
50. Stern AM, Markel H (2005). "The history of vaccines and immunization: familiar patterns, new challenges". Health Aff. (Millwood). 24 (3): 611–21. doi:10.1377/hlthaff.24.3.611. PMID 15886151. Archived from the original on 2014-04-24.open access publication – free to read
51. Dunn PM (January 1996). "Dr Edward Jenner (1749–1823) of Berkeley, and vaccination against smallpox" (PDF). Arch. Dis. Child. Fetal Neonatal Ed. 74 (1): F77–78. doi:10.1136/fn.74.1.F77. PMC 2528332 Freely accessible. PMID 8653442. Archived from the original (PDF) on 2011-07-08.
52. Van Sant JE (2008). "The Vaccinators: Smallpox, Medical Knowledge, and the 'Opening' of Japan". J Hist Med Allied Sci. 63 (2): 276–79. doi:10.1093/jhmas/jrn014.
53. Dudgeon JA (1963). "Development of smallpox vaccine in England in the eighteenth and nineteenth centuries". BMJ (5342): 1367–72. doi:10.1136/bmj.1.5342.1367. PMC 2124036 Freely accessible. PMID 20789814.
54. Baarda, Benjamin I.; Sikora, Aleksandra E. (2015). "Proteomics of Neisseria gonorrhoeae: the treasure hunt for countermeasures against an old disease". Frontiers in Microbiology. 6. doi:10.3389/fmicb.2015.01190. ISSN 1664-302X; Access provided by the University of Pittsburgh.
55. Goodman, Jesse L. (2005-05-04). "Statement by Jesse L. Goodman, M.D., M.P.H. Director Center for Biologics, Evaluation and Research Food and Drug Administration U.S. Department of Health and Human Services on US Influenza Vaccine Supply and Preparations for the Upcoming Influenza Season before Subcommittee on Oversight and Investigations Committee on Energy and Commerce United States House of Representatives". Archived from the original on 2008-09-21. Retrieved 2008-06-15.
56. Olesen OF, Lonnroth A, Mulligan B (2009). "Human vaccine research in the European Union". Vaccine. 27 (5): 640–45. doi:10.1016/j.vaccine.2008.11.064. PMID 19059446.
57. Jit, Mark; Newall, Anthony T.; Beutels, Philippe (1 April 2013). "Key issues for estimating the impact and cost-effectiveness of seasonal influenza vaccination strategies". Human vaccines & immunotherapeutics. 9 (4): 834–840. doi:10.4161/hv.23637. PMC 3903903 Freely accessible. PMID 23357859.
58. Newall, A.T.; Reyes, J.F.; Wood, J.G.; McIntyre, P.; Menzies, R.; Beutels, P. (February 2014). "Economic evaluations of implemented vaccination programmes: key methodological challenges in retrospective analyses". Vaccine. 32 (7): 759–65. doi:10.1016/j.vaccine.2013.11.067. PMID 24295806.
59. Hardman Reis T (2006). "The role of intellectual property in the global challenge for immunization". J World Intellect Prop. 9 (4): 413–25. doi:10.1111/j.1422-2213.2006.00284.x.
60. "www.who.int" (PDF). Archived (PDF) from the original on 2015-11-23.
61. "Three ways to make a vaccine" (infographic). Archived from the original on 2015-12-23. Retrieved 2015-08-05, in Stein, Rob (24 November 2009). "Vaccine system remains antiquated". The Washington Post. Archived from the original on 19 October 2017.
62. Muzumdar JM, Cline RR (2009). "Vaccine supply, demand, and policy: a primer". J Am Pharm Assoc. 49 (4): e87–99. doi:10.1331/JAPhA.2009.09007. PMID 19589753.
63. "Components of a vaccine". Archived from the original on 2017-06-13.
64. Bae K, Choi J, Jang Y, Ahn S, Hur B (2009). "Innovative vaccine production technologies: the evolution and value of vaccine production technologies". Arch Pharm Res. 32 (4): 465–80. doi:10.1007/s12272-009-1400-1. PMID 19407962.
65. Staff (15 November 2011). "India produces 60 percent of world's vaccines". Indonesia. Antara. Archived from the original on 19 September 2015. Retrieved 2015-08-05.
66. CDC. "Ingredients of Vaccines — Fact Sheet". Archived from the original on December 17, 2009. Retrieved December 20, 2009.
67. The mercury levels in the table, unless otherwise indicated, are taken from: Mercury Levels in Commercial Fish and Shellfish (1990-2010) Archived 2015-05-03 at the Wayback Machine. U.S. Food and Drug Administration. Accessed 8 January 2012.
68. "Thimerosal in vaccines". Center for Biologics Evaluation and Research, U.S. Food and Drug Administration. 2007-09-06. Archived from the original on 2013-01-06. Retrieved 2007-10-01.
69. Bigham M, Copes R (2005). "Thiomersal in vaccines: balancing the risk of adverse effects with the risk of vaccine-preventable disease". Drug Saf. 28 (2): 89–101. doi:10.2165/00002018-200528020-00001. PMID 15691220.
70. Offit PA (2007). "Thimerosal and vaccines—a cautionary tale" (PDF). N Engl J Med. 357 (13): 1278–79. doi:10.1056/NEJMp078187. PMID 17898096. Archived from the original on 2011-09-21.
71. Morein B, Hu KF, Abusugra I (2004). "Current status and potential application of ISCOMs in veterinary medicine". Adv Drug Deliv Rev. 56 (10): 1367–82. doi:10.1016/j.addr.2004.02.004. PMID 15191787.
72. American Medicine. American-Medicine Publishing Company. 1926.
73. South African Institute for Medical Research (1929). Annual report [Jaarverslag]. South African Institute for Medical Research – Suid-Afrikaanse Instituut vir Mediese Navorsing.
74. Firdos Alam Khan (2011-09-20). Biotechnology Fundamentals. CRC Press. p. 270. ISBN 978-1439820094.
75. Giudice EL, Campbell JD (2006). "Needle-free vaccine delivery". Adv Drug Deliv Rev. 58 (1): 68–89. doi:10.1016/j.addr.2005.12.003. PMID 16564111.
76. WHO to trial Nanopatch needle-free delivery system| ABC News, 16 Sep 2014| "Archived copy". Archived from the original on 2015-04-02. Retrieved 2015-09-15.
77. "Australian scientists develop 'needle-free' vaccination". The Sydney Morning Herald. 18 August 2013. Archived from the original on 25 September 2015.
78. Vaxxas raises $25m to take Brisbane's Nanopatch global| Business Review Weekly, 10 February 2015 |"Archived copy". Archived from the original on 2015-03-16. Retrieved 2015-03-05.
79. "Australian scientists develop 'needle-free' vaccination". Chennai, India: The Hindu. 28 September 2011. Archived from the original on 1 January 2014.
80. "Needle-free nanopatch vaccine delivery system". News Medical. 3 August 2011. Archived from the original on 11 May 2012.
81. Lowe (2008). "Plasmid DNA as Prophylactic and Therapeutic vaccines for Cancer and Infectious Diseases". Plasmids: Current Research and Future Trends. Caister Academic Press. ISBN 978-1904455356. Archived from the original on 2008-04-11.
82. Patel, JR; Heldens, JG (March 2009). "Immunoprophylaxis against important virus disease of horses, farm animals and birds". Vaccine. 27 (12): 1797–810. doi:10.1016/j.vaccine.2008.12.063. PMID 19402200.
83. Berkelman, Ruth L. (1 August 2003). "Human Illness Associated with Use of Veterinary Vaccines". Clinical Infectious Diseases. 37 (3): 407–14. doi:10.1086/375595. PMID 12884166.open access publication – free to read
84. Van Oirschot JT, Rziha HJ, Moonen PJ, Pol JM, Van Zaane D (1986). "Differentiation of serum antibodies from pigs vaccinated or infected with Aujeszky's disease virus by a competitive enzyme immunoassay". The Journal of General Virology. 67 (6): 1179–82. doi:10.1099/0022-1317-67-6-1179. PMID 3011974.
85. Van Oirschot JT (1999). "Diva vaccines that reduce virus transmission". Journal of Biotechnology. 73 (2–3): 195–205. doi:10.1016/S0168-1656(99)00121-2. PMID 10486928.
86. Van Oirschot JT, Gielkens AL, Moormann RJ, Berns AJ (1990). "Marker vaccines, virus protein-specific antibody assays and the control of Aujeszky's disease". Veterinary Microbiology. 23 (1–4): 85–101. doi:10.1016/0378-1135(90)90139-M. PMID 2169682.
87. Van Oirschot JT (1999). "Diva vaccines that reduce virus transmission". Journal of Biotechnology. 73 (2–3): 195–205. doi:10.1016/S0168-1656(99)00121-2. PMID 10486928.
88. Kaashoek MJ, Moerman A, Madic J, Rijsewijk FA, Quak J, Gielkens AL, Van Oirschot JT (1994). "A conventionally attenuated glycoprotein E-negative strain of bovine herpesvirus type 1 is an efficacious and safe vaccine". Vaccine. 12 (5): 439–44. doi:10.1016/0264-410X(94)90122-8. PMID 8023552.
89. Hulst MM, Westra DF, Wensvoort G, Moormann RJ (1993). "Glycoprotein E1 of hog cholera virus expressed in insect cells protects swine from hog cholera". Journal of Virology. 67 (9): 5435–42. PMC 237945 Freely accessible. PMID 8350404.
90. Capua I, Terregino C, Cattoli G, Mutinelli F, RodriguezJF (2003). "Development of a DIVA (Differentiating Infected from Vaccinated Animals) strategy using a vaccine containing a heterologous neuraminidase for the control of avian influenza". Avian Pathology. 32 (1): 47–55. doi:10.1080/0307945021000070714. PMID 12745380.
91. Maas A, Meens J, Baltes N, Hennig-Pauka I, Gerlach GF (2006). "Development of a DIVA subunit vaccine against Actinobacillus pleuropneumoniae infection". Vaccine. 24 (49): 7226–32. doi:10.1016/j.vaccine.2006.06.047. PMID 17027123.
92. Leyman B, Boyen F, Van Parys A, Verbruggh E, Haesebrouck F, Pasmans F (2011). "Salmonella Typhimurium LPS mutations for use in vaccines allowing differentiation of infected and vaccinated pigs". Vaccine. 29 (20): 3679–85. doi:10.1016/j.vaccine.2011.03.004. PMID 21419163. Archived from the original on 2017-10-28.
93. Plotkin SA (2005). "Vaccines: past, present and future". Nat Med. 11 (4 Suppl): S5–11. doi:10.1038/nm1209. PMID 15812490.
94. Carlson B (2008). "Adults now drive growth of vaccine market". Gen. Eng. Biotechnol. News. 28 (11). pp. 22–3. Archived from the original on 2014-01-10.open access publication – free to read
95. Klein SL, Jedlicka A, Pekosz A (May 2010). "The Xs and Y of immune responses to viral vaccines". Lancet Infect Dis. 10 (5): 338–49. doi:10.1016/S1473-3099(10)70049-9. PMID 20417416.
96. Staff (28 March 2013). "Safer vaccine created without virus". The Japan Times. Agence France-Presse – Jiji Press. Archived from the original on 30 March 2013. Retrieved 2013-03-28.
97. Spohn G, Bachmann MF (2008). "Exploiting viral properties for the rational design of modern vaccines". Expert Rev Vaccines. 7 (1): 43–54. doi:10.1586/14760584.7.1.43. PMID 18251693.
98. Samuelsson O, Herlitz H (2008). "Vaccination against high blood pressure: a new strategy". Lancet. 371 (9615): 788–89. doi:10.1016/S0140-6736(08)60355-4. PMID 18328909.
99. Poland GA, Jacobson RM, Ovsyannikova IG (2009). "Trends affecting the future of vaccine development and delivery: the role of demographics, regulatory science, the anti-vaccine movement, and vaccinomics". Vaccine. 27 (25–26): 3240–44. doi:10.1016/j.vaccine.2009.01.069. PMC 2693340 Freely accessible. PMID 19200833.
100. Sala, F.; Manuela Rigano, M.; Barbante, A.; Basso, B.; Walmsley, AM; Castiglione, S (January 2003). "Vaccine antigen production in transgenic plants: strategies, gene constructs and perspectives". Vaccine. 21 (7–8): 803–08. doi:10.1016/s0264-410x(02)00603-5. PMID 12531364.
101. Kumar, G. B. Sunil; T. R. Ganapathi; C. J. Revathi; L. Srinivas; V. A. Bapat (October 2005). "Expression of hepatitis B surface antigen in transgenic banana plants". Planta. 222 (3): 484–93. doi:10.1007/s00425-005-1556-y. PMID 15918027.
102. Ostachuk A; Chiavenna SM; Gómez C; Pecora A; Pérez-Filgueira MD; Escribano JA; Ardila F; Dus Santos MJ; Wigdorovitz A (2009). "Expression of a ScFv–E2T fusion protein in CHO-K1 cells and alfalfa transgenic plants for the selective directioning to antigen presenting cells". Veterinary Immunology and Immunopathology. 128 (1): 315. doi:10.1016/j.vetimm.2008.10.224. Archived from the original on 2018-05-01.
103. Aguirreburualde MSP; Gómez C; Ostachuk A; Wolman F; Albanesi G; Pecora A; Odeon A; Ardila F; Escribano JA; Dus Santos MJ; Wigdorovitz A (2013). "Efficacy of a BVDV subunit vaccine produced in alfalfa transgenic plants". Veterinary Immunology and Immunopathology. 151 (3): 315–324. doi:10.1016/j.vetimm.2012.12.004. Archived from the original on 2018-05-01. |