高尿酸血症是血液中尿酸水平异常高。 在体液的pH条件下,尿酸主要以尿酸盐、离子形式存在。 女性血清尿酸浓度大于 6 mg/dL,男性大于 7 mg/dL,青少年(18 岁以下)大于 5.5 mg/dL 被定义为高尿酸血症。 体内的尿酸盐量取决于食物中摄入的嘌呤量、体内合成的尿酸盐量(例如,通过细胞更新)以及从尿液中或通过胃肠道排出的尿酸盐量之间的平衡。 高尿酸血症可能是由于尿酸生成增加、尿酸排泄减少或尿酸生成增加和排泄减少。
高尿酸血症
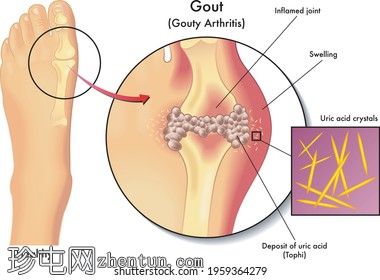
体征和症状
除非在临床实验室确定高血尿酸水平,否则高尿酸血症可能不会在大多数人中引起明显的症状。痛风是一种痛苦的短期疾病,是高尿酸血症最常见的后果,会导致尿酸结晶沉积在四肢关节,但也可能导致肾结石形成,这是另一种痛苦的疾病。痛风症状通常是关节(例如脚趾或膝盖)发炎、肿胀和发红,并伴有剧烈疼痛。并非所有患有高尿酸血症的人都会患上痛风。
原因
许多因素会导致高尿酸血症,包括遗传、胰岛素抵抗、高血压、甲状腺功能减退、慢性肾病、肥胖、饮食、铁超负荷、使用利尿剂(例如噻嗪类、袢利尿剂)和过量饮用酒精饮料。其中,饮酒是最重要的。
高尿酸血症的病因可分为三种功能型:尿酸生成增多、尿酸排泄减少和混合型。产量增加的原因包括饮食中嘌呤含量高和嘌呤代谢增加。排泄减少的原因包括肾脏疾病、某些药物以及尿酸和其他分子之间的排泄竞争。混合原因包括饮食中酒精和/或果糖含量高,以及饥饿。
尿酸生成增加
富含嘌呤的饮食是高尿酸血症的常见但次要原因。单纯的饮食通常不足以引起高尿酸血症(见痛风)。嘌呤腺嘌呤和次黄嘌呤含量高的食物可能会加重高尿酸血症的症状。
各种研究发现,较高的尿酸水平与肉类和海鲜的消费呈正相关,与乳制品的消费呈负相关。
痛风经历的高尿酸血症是实体器官移植的常见并发症。除了正常变异(具有遗传成分)外,肿瘤溶解综合征会产生极端水平的尿酸,主要导致肾功能衰竭。 Lesch-Nyhan 综合征也与极高水平的尿酸有关。
尿酸排泄减少
通过减少排泄导致高尿酸血症的主要药物是主要的抗尿酸尿药。其他药物和药剂包括利尿剂、水杨酸盐、吡嗪酰胺、乙胺丁醇、烟酸、环孢素、2-乙基氨基-1,3,4-噻二唑和细胞毒剂。
SLC2A9基因编码一种有助于在肾脏中运输尿酸的蛋白质。已知该基因的几个单核苷酸多态性与血尿酸具有显著相关性。使用外显子组测序已证明与成骨不全症共分离的高尿酸血症与 GPATCH8 突变有关
由于尿酸和酮之间的运输竞争,生酮饮食会损害肾脏排泄尿酸的能力。
血铅升高与肾功能受损和高尿酸血症显著相关(尽管这些相关性之间的因果关系尚不清楚)。在一项针对台湾 2500 多名居民的研究中,血铅水平超过 7.5 微克/分升(小幅升高)与肾功能不全的比值比为 1.92(95% CI:1.18-3.10)和 2.72(95% CI:1.64) -4.52) 用于高尿酸血症。
混合型
混合型高尿酸血症的病因具有双重作用,即增加尿酸的产生和减少尿酸的排泄。
大量摄入酒精(乙醇)是高尿酸血症的一个重要原因,它具有由多种机制复合而成的双重作用。乙醇通过增加乳酸的产生来增加尿酸的产生,从而导致乳酸性酸中毒。乙醇还通过加速腺嘌呤核苷酸降解增加次黄嘌呤和黄嘌呤的血浆浓度,并且可能是黄嘌呤脱氢酶的弱抑制剂。作为发酵过程的副产品,啤酒还含有嘌呤。乙醇通过促进脱水和(很少)临床酮症酸中毒来减少尿酸的排泄。
果糖的高膳食摄入量显著导致高尿酸血症。在美国的一项大型研究中,每天饮用四种或更多含糖软饮料导致高尿酸血症的优势比为 1.82。尿酸产生增加是果糖代谢产物干扰嘌呤代谢的结果。这种干扰具有双重作用,既增加了 ATP 向肌苷和尿酸的转化,又增加了嘌呤的合成。果糖还抑制尿酸的排泄,显然是通过与尿酸竞争获得转运蛋白 SLC2A9。在具有高尿酸血症和/或痛风的遗传(遗传)倾向的人群中,果糖在减少尿酸排泄方面的作用增加。
饥饿会导致身体代谢其自身(富含嘌呤)的组织以获取能量。因此,就像高嘌呤饮食一样,饥饿会增加嘌呤转化为尿酸的量。缺乏碳水化合物的极低热量饮食会导致极度高尿酸血症;包括一些碳水化合物(并减少蛋白质)可降低高尿酸血症的水平。由于尿酸和酮之间的运输竞争,饥饿也会削弱肾脏排泄尿酸的能力。
诊断
高尿酸血症可以通过血液和尿液检查来检测。
治疗
旨在降低尿酸浓度的药物
用于治疗高尿酸血症的药物分为两类:黄嘌呤氧化酶抑制剂和排尿酸。对于痛风反复发作的人,建议使用这两类药物中的一种。无症状高尿酸血症患者服用这些药物的证据尚不清楚。
黄嘌呤氧化酶抑制剂
黄嘌呤氧化酶抑制剂,包括别嘌醇、非布司他和托吡司他,通过干扰黄嘌呤氧化酶来减少尿酸的产生。
泌尿科
排尿酸药物(苯溴马隆、苯并碘酮、丙磺舒、来西那拉、磺吡酮、乙烯利、唑沙唑胺和替克萘芬)通过减少尿酸被肾脏从血液中滤出后的重吸收来增加尿酸的排泄。
其中一些药物按指示使用,其他药物则在标签外使用。在接受血液透析的人中,司维拉姆可以显著降低血清尿酸,显然是通过在肠道中吸附尿酸盐。在女性中,使用复方口服避孕药与降低血清尿酸显著相关。遵循Le Chatelier的原理,降低血尿酸浓度可以使任何现有的尿酸晶体逐渐溶解到血液中,从而将溶解的尿酸排出体外。维持较低的血尿酸浓度同样应减少新晶体的形成。如果该人患有慢性痛风或已知痛风石,则关节和其他组织中可能积聚了大量尿酸结晶,可能需要积极和/或长期使用药物。已知尿酸晶体的沉淀和相反的溶解取决于溶液中尿酸的浓度、pH、钠浓度和温度。
高尿酸血症的非药物治疗包括低嘌呤饮食(见痛风)和各种膳食补充剂。锂盐治疗已被用于改善尿酸溶解度。
酸碱度
血清 pH 值既不安全也不容易改变。改变 pH 值的疗法主要改变尿液的 pH 值,以防止尿酸排泄治疗可能出现的并发症:由于尿液中的尿酸增加而形成尿酸肾结石(见肾结石)。具有类似作用的药物包括乙酰唑胺。
温度
据报道,低温是急性痛风的诱因。一个例子是在冷水中呆了一天,第二天早上痛风发作。这被认为是由于在低于正常温度的组织中尿酸晶体的温度依赖性沉淀。因此,预防的一个目的是保持手脚温暖,浸泡在热水中可能是治疗性的。
预后
水平升高易患痛风,如果非常高,则易患肾衰竭。代谢综合征常表现为高尿酸血症。经常服用别嘌醇,预后良好。
痛风患者以及高尿酸血症患者患帕金森病的可能性显著降低,除非他们还需要利尿剂。
参考资料:
Al-Ashkar, Feyrouz (2010). "Gout and pseudogout". Disease Management Project. Cleveland Clinic. Retrieved 26 December 2014.
Choi, Hyon K.; Mount, David B.; Reginato, Anthony M. (2005). "Pathogenesis of gout". Annals of Internal Medicine. 143 (7): 499–516. doi:10.7326/0003-4819-143-7-200510040-00009. PMID 16204163. S2CID 194570.
Gois, Pedro Henrique França; Souza, Edison Regio de Moraes (2020-09-02). "Pharmacotherapy for hyperuricaemia in hypertensive patients". The Cochrane Database of Systematic Reviews. 2020 (9): CD008652. doi:10.1002/14651858.CD008652.pub4. ISSN 1469-493X. PMC 8094453. PMID 32877573.
"Gout". Arthritis Society of Canada. 2022. Retrieved 25 April 2022.
"High uric acid level". Cleveland Clinic. 15 May 2018. Retrieved 25 April 2022.
Sam Z Sun; Brent D Flickinger; Patricia S Williamson-Hughes; Mark W Empie (March 2010). "Lack of association between dietary fructose and hyperuricemia risk in adults". Nutrition & Metabolism. 7 (16): 16. doi:10.1186/1743-7075-7-16. PMC 2842271. PMID 20193069.
Yamamoto T, Moriwaki Y, Takahashi S (June 2005). "Effect of ethanol on metabolism of purine bases (hypoxanthine, xanthine, and uric acid)". Clinica Chimica Acta; International Journal of Clinical Chemistry. 356 (1–2): 35–57. doi:10.1016/j.cccn.2005.01.024. PMID 15936302.
Yamamoto T (April 2008). "[Definition and classification of hyperuricemia]". Nippon Rinsho (in Japanese). 66 (4): 636–40. PMID 18409507.
Brulé D, Sarwar G, Savoie L (1992). "Changes in serum and urinary uric acid levels in normal human subjects fed purine-rich foods containing different amounts of adenine and hypoxanthine". J Am Coll Nutr. 11 (3): 353–8. doi:10.1080/07315724.1992.10718238. PMID 1619189.
Villegas, R.; Xiang, Y. B.; Elasy, T.; Xu, W. H.; Cai, H.; Cai, Q.; Linton, M.; Fazio, S.; Zheng, W.; Shu, X. O. (2011). "Purine-rich foods, protein intake, and the prevalence of hyperuricemia: The Shanghai Men's Health Study". Nutrition, Metabolism, and Cardiovascular Diseases. 22 (5): 409–416. doi:10.1016/j.numecd.2010.07.012. PMC 3150417. PMID 21277179.
Stamp L, Searle M, O'Donnell J, Chapman P (2005). "Gout in solid organ transplantation: a challenging clinical problem". Drugs. 65 (18): 2593–611. doi:10.2165/00003495-200565180-00004. PMID 16392875. S2CID 46979126.
Nanagiri, Apoorva; Shabbir, Nadeem (2020), "Lesch Nyhan Syndrome", StatPearls, Treasure Island (FL): StatPearls Publishing, PMID 32310539, retrieved 2020-09-03
Scott JT (April 1991). "Drug-induced gout". Baillière's Clinical Rheumatology. 5 (1): 39–60. doi:10.1016/S0950-3579(05)80295-X. PMID 2070427.
Brandstätter A, Kiechl S, Kollerits B, Hunt SC, Heid IM, Coassin S, Willeit J, Adams TD, Illig T, Hopkins PN, Kronenberg F (August 2008). "Sex-specific association of the putative fructose transporter SLC2A9 variants with uric acid levels is modified by BMI". Diabetes Care. 31 (8): 1662–7. doi:10.2337/dc08-0349. PMC 2494626. PMID 18487473.
Kaneko, Hiroshi; Kitoh Hiroshi; Matsuura Tohru; Masuda Akio; Ito Mikako; Mottes Monica; Rauch Frank; Ishiguro Naoki; Ohno Kinji (Nov 2011). "Hyperuricemia cosegregating with osteogenesis imperfecta is associated with a mutation in GPATCH8". Hum. Genet. 130 (5): 671–83. doi:10.1007/s00439-011-1006-9. PMID 21594610. S2CID 1075364.
Förster H (August 1979). "[Possibilities for weight reduction by means of diet]". Fortschr. Med. (in German). 97 (32): 1339–44. PMID 488876.
Lai LH, Chou SY, Wu FY, Chen JJ, Kuo HW (August 2008). "Renal dysfunction and hyperuricemia with low blood lead levels and ethnicity in community-based study". Sci. Total Environ. 401 (1–3): 39–43. Bibcode:2008ScTEn.401...39L. doi:10.1016/j.scitotenv.2008.04.004. PMID 18514766.
Shadick NA, Kim R, Weiss S, Liang MH, Sparrow D, Hu H. (2000 ), Effect of low level lead exposure on hyperuricemia and gout among middle aged and elderly men: the normative aging study; J Rheumatol. 2000 Jul; 27(7):1708-12 (概要).
Nakagawa T, Hu H, Zharikov S, et al. (2006). "A causal role for uric acid in fructose-induced metabolic syndrome". Am. J. Physiol. Renal Physiol. 290 (3): F625–31. doi:10.1152/ajprenal.00140.2005. PMID 16234313. S2CID 2667982.
Mayes PA (1993). "Intermediary metabolism of fructose". Am. J. Clin. Nutr. 58 (5 Suppl): 754S–765S. doi:10.1093/ajcn/58.5.754S. PMID 8213607.
Miller A, Adeli K (March 2008). "Dietary fructose and the metabolic syndrome". Curr. Opin. Gastroenterol. 24 (2): 204–9. doi:10.1097/MOG.0b013e3282f3f4c4. PMID 18301272. S2CID 26026368.
Choi JW, Ford ES, Gao X, Choi HK (January 2008). "Sugar-sweetened soft drinks, diet soft drinks, and serum uric acid level: the Third National Health and Nutrition Examination Survey". Arthritis Rheum. 59 (1): 109–16. doi:10.1002/art.23245. PMID 18163396.
Mayes PA (November 1993). "Intermediary metabolism of fructose". Am. J. Clin. Nutr. 58 (5 Suppl): 754S–765S. doi:10.1093/ajcn/58.5.754S. PMID 8213607.
Vitart V, Rudan I, Hayward C, Gray NK, Floyd J, Palmer CN, Knott SA, Kolcic I, Polasek O, Graessler J, Wilson JF, Marinaki A, Riches PL, Shu X, Janicijevic B, Smolej-Narancic N, Gorgoni B, Morgan J, Campbell S, Biloglav Z, Barac-Lauc L, Pericic M, Klaric IM, Zgaga L, Skaric-Juric T, Wild SH, Richardson WA, Hohenstein P, Kimber CH, Tenesa A, Donnelly LA, Fairbanks LD, Aringer M, McKeigue PM, Ralston SH, Morris AD, Rudan P, Hastie ND, Campbell H, Wright AF (April 2008). "SLC2A9 is a newly identified urate transporter influencing serum urate concentration, urate excretion and gout". Nat. Genet. 40 (4): 437–42. doi:10.1038/ng.106. PMID 18327257. S2CID 6720464.
Howard AN (1981). "The historical development, efficacy and safety of very-low-calorie diets". Int J Obes. 5 (3): 195–208. PMID 7024153.
Kirch W, von Gicycki C (April 1980). "[Renal function in therapeutic starvation (author's transl)]". Wien. Klin. Wochenschr. (in German). 92 (8): 263–6. PMID 7405247.
Garg JP, Chasan-Taber S, Blair A, et al. (January 2005). "Effects of sevelamer and calcium-based phosphate binders on uric acid concentrations in patients undergoing hemodialysis: a randomized clinical trial". Arthritis and Rheumatism. 52 (1): 290–5. doi:10.1002/art.20781. PMID 15641045.
Ohno I, Yamaguchi Y, Saikawa H, Uetake D, Hikita M, Okabe H, Ichida K, Hosoya T (2009). "Sevelamer decreases serum uric acid concentration through adsorption of uric acid in maintenance hemodialysis patients". Internal Medicine (Tokyo, Japan). 48 (6): 415–20. doi:10.2169/internalmedicine.48.1817. PMID 19293539.
Gresser U, Gathof B, Zöllner N (December 1990). "Uric acid levels in southern Germany in 1989. A comparison with studies from 1962, 1971, and 1984". Klin. Wochenschr. 68 (24): 1222–8. doi:10.1007/BF01796514. PMID 2290309. S2CID 1660026.
Abhishek, Abhishek; Doherty, Michael (January 2018). "Education and non-pharmacological approaches for gout". Rheumatology (Oxford, England). 57 (suppl_1): i51–i58. doi:10.1093/rheumatology/kex421. ISSN 1462-0332. PMID 29272507.
Si K, Wei C, Xu L, Zhou Y, Lv W, Dong B, Wang Z, Huang Y, Wang Y, Chen Y (2021). "Hyperuricemia and the Risk of Heart Failure: Pathophysiology and Therapeutic Implications". Front Endocrinol (Lausanne). 12: 770815. doi:10.3389/fendo.2021.770815. PMC 8633872. PMID 34867815.
De Vera M, Rahman MM, Rankin J, Kopec J, Gao X, Choi H (November 2008). "Gout and the risk of Parkinson's disease: a cohort study". Arthritis Rheum. 59 (11): 1549–54. doi:10.1002/art.24193. PMID 18975349. |