发病率和病理生理
胆结石极为常见,可影响多达20%的人口。在胆石症患者中,20%的胆总管(CBD)中也会有结石。当胆囊中形成的结石迁移进入导管系统(继发性CBDS)时,会发生CBD结石(CBDS),而在胆管本身内原位形成结石时,则发生CBD结石(主要CBDS)。
胆汁成分
胆汁盐和胆汁酸是正常胆汁的主要成分,占其含量的67%。肝细胞羟化酶作用于胆固醇,形成伯胆汁酸。肠细菌在肠肝循环中进一步将胆汁酸修饰为仲胆汁酸。胆汁盐是牛磺酸或甘氨酸与肝细胞胆汁酸结合产生的。胆汁酸和胆汁盐都是水溶性的,并且像去污剂一样将游离胆固醇保持在溶液中。磷脂占胆汁的22%,也有助于溶解胆固醇。其他成分的含量很少,包括蛋白质(4.5%),游离胆固醇(4%),结合胆红素(0.3%)和痕量的水,电解质和碳酸氢盐。

图2.1胆固醇结石
胆固醇结石
胆固醇结石(图2.1)占所有胆结石的90%。 当胆汁中的胆固醇过多(如肥胖症)或胆汁酸/盐不足时,胆汁中的游离胆固醇过饱和,就会形成胆汁。 胆汁酸/盐缺乏症可能是由于:
1.产量下降(例如肝硬化)
2.由细菌过度生长引起的破坏(例如,自主神经病)
3.结合和从肠肝循环中去除(例如,胆甾胺)
4.末端回肠缺乏重吸收(例如克罗恩氏病)
结石的危险因素
胆固醇结石的主要危险因素包括女性,40岁以上的年龄,肥胖,体重迅速减轻和美国原住民血统。具体的风险因素阐述如下。
雌激素通过多种机制增加胆固醇结石的形成。它增加了肝细胞从循环中摄取脂蛋白的能力,从而导致胆汁中排泄的膳食胆固醇含量更高。它上调HMG-CoA还原酶,这是内源性胆固醇合成中的限速步骤。它还减少了胆固醇中胆汁酸的合成,进一步促进了胆汁中游离胆固醇的过饱和。考虑到雌激素的作用,可以得出结论,怀孕是一种众所周知的结石状态。值得注意的是,分别在产后第一年内,分别有多达60%和28%的女性出现了污泥甚至胆结石的消退,这表明雌激素增加可能具有可逆的作用[4,5]。
快速的体重减轻是指由于禁食,低热量饮食或减肥手术而导致每周体重减轻1.5公斤以上。患有这些疾病的人中约有30%会形成胆结石。在减肥手术患者中,结石形成的特定危险因素包括低纤维或低热量饮食,长期禁食和胆囊运动不足。减肥手术后,每日摄入7-10 g脂肪的饮食可改善胆囊排空,并可抵抗有症状结石的形成。每天至少服用500 mg熊去氧胆酸是一种经济有效的疗法,可防止减肥手术后胆结石的形成。
遗传也影响结石的形成。已显示特定人群的胆结石患病率很高(例如,高达65%的美洲原住民和高达35%的具有本土背景的智利人)。瑞典双胞胎登记处对43,141对双胞胎进行了分析,结果表明,遗传因素占形成胆结石风险的25%。最近的全基因组关联研究已经确定了多种基因异常,这些异常也可能导致结石形成。肠道胆固醇转运蛋白ABCG8的变异占估计的25%遗传风险的大部分,将来可能为个性化药物治疗提供机会以降低这种风险。
颜料石
颜料石(图2.2)有两种:黑色和棕色。 它们主要由胆红素钙组成,当胆红素以异常高的浓度存在时,胆红素钙会从胆汁中沉淀出来。 黑色色素结石是一种慢性血管外溶血过程的迹象,例如遗传性球囊病或镰状细胞性贫血。 在胆道感染的情况下,褐色的色素结石通常在胆管和胆道内形成,在亚洲人群中更常见。

图2.2颜料结石
临床症状
从良性,无症状到危及生命的败血性休克,胆管结石症可产生多种症状和病理。体征和症状取决于胆道梗阻的解剖学水平和感染的存在。有关临床综合征特征的摘要,请参见表2.1。
无症状的
CBDS约占总人口的4%,其中多达一半是无症状的。这些石头的绝大多数形成在胆囊中,小到足以穿过壶腹的石头遵循胆汁进入十二指肠的正常路径。无症状CBDS的自然过程很难研究,因为术中胆管造影术上注意到的结石通常会被清除。但是,最近的研究表明,在进行胆囊切除术后,无症状的CBDS最多可通过三分之一。
IU国际单位,LFTs肝功能检查
胆绞痛
胆绞痛的定义为持续时间至少20–30分钟的发作性,严重上腹痛或右上腹痛。疼痛通常会辐射到背部或右侧肩部,并通过止痛药缓解。胆绞痛通常归因于胆囊内的胆结石,而胆结石引起的CBD阻塞可能具有相同的症状。 CBDS引起的疼痛是由胆管树扩张引起的,症状通常伴有肝功能检查改变,以及影像学上胆管扩张。阻塞性结石进入十二指肠或结石逆行进入扩张的导管可减轻胆道内的压力和相关症状(图2.3)。因此,假设由于患者的疼痛已缓解而结石已经过去,这不是一个安全的假设。
胆绞痛本身没有死亡的风险,发病率仅限于经常需要麻醉性止痛药的疼痛。然而,在一项研究中,约有一半患有复杂性胆结石疾病(胰腺炎,CBDS或胆囊炎)的患者曾先发胆绞痛,因此该症状应被视为更严重情况的潜在先兆。
黄疸
梗阻性黄疸的最常见原因是胆总管结石症。黄疸是由结合的胆红素沉积在皮肤,粘膜和巩膜中引起的。通常,血清胆红素必须高于3 mg / dL才能使变色可见。阻塞性CBDS可能伴有无痛性黄疸,但更常见的是出现胆绞痛症状(图2.4)。黄疸引起的阻塞性结石的发病率仅限于胆红素沉积引起的瘙痒和由于胆道系统压力升高而引起的轻度肝细胞损伤。但是,胆汁淤积会增加感染的风险,壶腹结石阻塞可能会导致胰腺炎。这些条件将在下面详细讨论。
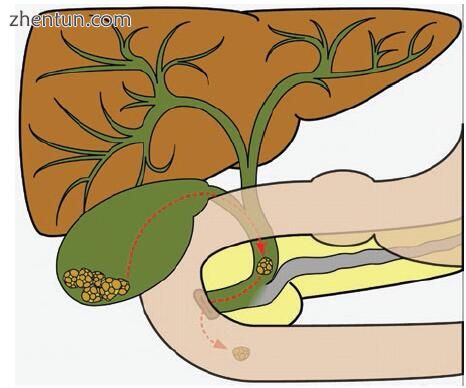
图2.3暂时性CBDS可能无症状或引起胆绞痛
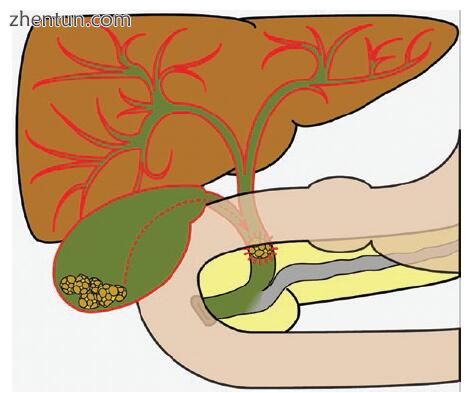
图2.4受影响的CBDS可能引起疼痛,胆结石性肝炎,黄疸和胆管炎
胆管炎
由于胆汁的顺行流动,胆道上皮紧密连接和粘膜免疫球蛋白A(IgA),通常保护胆道树免受感染。当来自十二指肠的细菌以逆行方式穿过壶腹时,就会发生细菌漏菌,这是无症状的CBDS患者的常见发现。胆汁淤积症并发细菌感染时会发生胆管炎,而阻塞性CBDS迄今为止是胆管炎的最常见原因。 CBD内的正常压力为7–14 cm H2O。当压力增加到> 20 cm H2O时,细菌细胞和毒素会穿过胆管上皮转移到全身循环中,从而引起败血性休克。胆管炎的危险因素包括糖尿病,年龄> 70岁和最近在胆道外感染。
夏科特三联征中,多达75%的胆管炎病例为黄疸,右上腹疼痛和发烧。夏科特三联征的存在具有很高的特异性,但鉴于并非所有患有胆管炎的患者都会出现这三种症状,因此敏感性仅为50-70%。实验室分析反映出胆道梗阻的肝功能检查(LFTs)升高,全身性炎症反应的白细胞计数和C反应蛋白(CRP)升高。胆管扩张可能会发生,并且在成像时可能会看到有问题的结石。感染的进展会导致败血性休克,其特征是低血压和精神状态改变。
将这些发现添加到Charcot三联征中被称为雷诺兹·彭塔德(Reynolds’Pentad),大约5–7%的病例可见[10,11]。
根据《东京指南》,可根据标准将胆管炎的诊断分类为可疑或确定,并可分为严重,中度或轻度。诊断标准包括:
A.全身性炎症:发烧和/或发冷,炎症反应的实验室证据(白细胞增多或白细胞减少,CRP升高)
B.胆汁淤积:黄疸(总胆红素> 2 mg / dL),肝功能异常
C.影像学检查:胆道扩张,影像学病因学证据(例如,结石,狭窄或支架)
如果存在标准“ A”中的一项,以及标准“ B”或“ C”中的一项,则怀疑诊断为胆管炎。如果所有三个标准(A,B和C)中都存在一项,则胆管炎的诊断是确定的。
至少下列器官系统之一的器官功能障碍的迹象定义为严重的胆管炎:
心理状态改变
低血压
PaO2 / FiO2> 300
急性肾损伤
凝血酶原时间(PT)升高或国际标准化比率(INR)
血小板计数<100,000
中度胆管炎缺乏器官功能障碍,但包括以下两种:
年龄> 75岁
白细胞(WBC)计数> 12,000或<4000
发烧> 39°C或102.2°F
血清总胆红素> 5 mg / dL
血清白蛋白<正常值下限的70%
在诊断时,轻度胆管炎不符合上述标准。胆结石引起的急性阻塞性胆管炎在人群中相对罕见
水平,因此其绝对发生率很难确定。一项研究发现,在无症状或轻度有症状的胆结石患者中,有0.3–1.6%的人会在5-10年内患上急性胆管炎。根据《东京指南》,约有12.3%的胆结石相关性急性胆管炎病例表现为某些终末器官功能障碍,并属于严重。
胆管炎导致的死亡率随疾病的严重程度而异。胆管炎,器官衰竭的征兆和对药物治疗缺乏反应的个体如果没有迅速的胆道减压就无法生存,而轻度至中度的胆管炎可能对最初的全身性抗生素治疗反应良好。报告的死亡率随着时间的推移而下降,1980年之前报告的死亡率> 50%,最近的研究则以2.7-10%的死亡率为参考。
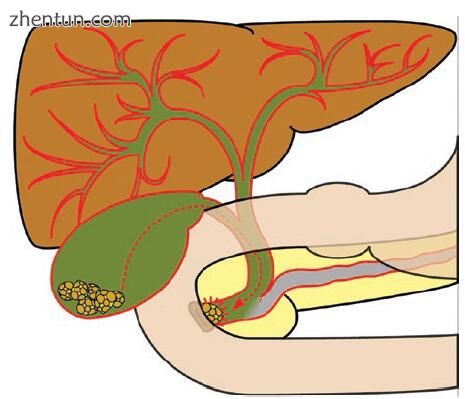
图2.5 CBDS撞击壶腹可引起疼痛,胆结石性肝炎和胆结石性胰腺炎
胆结石性胰腺炎
胆结石是西方世界急性胰腺炎的最常见原因。 CBD和胰管在Vater壶腹汇合,胆汁自然流动后的胆结石可能会受到影响(图2.5)。导致的胰管阻塞导致胰内消化酶的激活,胰腺和周围组织的炎症以及胰腺炎的典型上腹部胃痛。在大多数情况下,冒犯的结石在进入十二指肠之前仅受到短暂的冲击,并且在检查后的成像中并不明显。在诊断为胆石性胰腺炎(GSP)的人中,有90%的人发现粪便胆结石,而总人口中只有10%的人有胆汁结石。结石持续阻塞或结石通过后壶腹水肿会增加GSP的严重程度。危险因素包括女性,年龄> 60岁,直径小于5毫米的多发性胆结石,胆囊管扩张,餐后胆囊排空良好,以及胰腺管的解剖异常,例如非显露性副管[11, 15]。
GSP的发病率和死亡率取决于其严重程度。有多种评分系统可用于对GSP的严重程度进行分层,包括Ranson标准,格拉斯哥标准和急性生理与慢性健康评估II(APACHE-II)评分系统。但是,严重GSP的发生率相对较低,将这些临床工具的阳性预测值降低到不足50%。通过Ranson标准进行的分类如下:
年龄> 55岁
血清葡萄糖> 200 mg / dL
乳酸脱氢酶(LDH)> 350 mg / dL
天门冬氨酸转氨酶(AST)> 250单位/ L
白细胞计数> 16,000
中度至严重GSP:
四个或以上Ranson准则
器官衰竭的证据
轻度GSP:
临床稳定性
富血量
血尿素氮(BUN)<15
心率(HR)<110 bpm
<4 Ranson标准
APACHE-II分数也大于7也可预测严重GSP。
亚特兰大分类法是一种基于临床的工具,可将严重疾病与器官衰竭,胃肠道出血,胰腺坏死/假多囊肿或全身性并发症(如弥散性血管内凝血)的发现相关联。 这些临床因素会对死亡率产生重大影响。 轻度急性胰腺炎的死亡率为1-3%。 在轻度病例中,15-25%会发展为胰腺坏死,而受感染的坏死组织的存在会使死亡率上升至30%。 器官衰竭的持续时间也是死亡率的重要预测指标。 持续少于48小时的器官衰竭会导致36%的死亡率,而在最初症状的前72小时内出现的进行性多系统器官衰竭会导致死亡率大于50%。
实验室研究
有症状的胆总管结石
胆道阻塞的压力增加可能会导致肝细胞坏死和肝脏转氨酶释放到循环系统中,如血液化学中的LFT增加所表明的。阻塞性CBDS引起的肝细胞破坏和随之而来的炎症称为胆石性肝炎(GSH)。在一项对有症状的CBDS的个体进行的研究中,有18%的患者发现谷氨酰胺转氨酶升高至500–1000 IU,而有10%的患者发现GSH升高超过1000 IU。肝酶γ-谷氨酰转肽酶和碱性磷酸酶也可以升高,但比转氨酶升高得晚。在胆绞痛样症状的24小时内LFT升高没有出现,表明可能不存在CBDS。在内窥镜逆行胰胆管造影术(ERCP)上鉴定出的一组不同的前瞻性CBDS患者发现,在没有胆管炎的情况下,有4.3%的个体患有GSH(定义为转氨酶> 400 IU)。在患有CBDS的个体中,有13.2%的LFT正常。这组作者能够将年龄较小,持续时间较短和更剧烈的腹痛,胆石症和较窄的CBD与GSH相关联。
胆管炎
胆管炎的非特异性实验室检查结果包括白细胞增多,C反应蛋白和红细胞沉降率升高。 LFT总是异常的,但是海拔高度差异很大。胆管炎的胆汁培养阳性率为80-100%。阳性血液培养的报告范围从21%到71%。最常见的分离生物是肠革兰氏阴性菌:肠球菌,克雷伯菌和大肠杆菌。在先前的胆道手术中,老年患者或患有严重疾病的患者中,微生物感染更为常见,培养物可产生厌氧菌,例如梭菌。胆道手术和胆道支架与医院获得性或耐药菌和真菌感染相关。
胆结石性胰腺炎
血清淀粉酶和/或脂肪酶升高了GSP中正常值上限的三倍。初次感染后约24小时,血清脂肪酶水平达到峰值,并持续数天。淀粉酶在受侵害后2–12小时内开始升高,并在3–5天内恢复正常。升高的程度与疾病的严重程度无关,并且每日的趋势值对预测疾病的进展无用。
患有急性胰腺炎的患者的LFT升高应增加对GSP的怀疑。丙氨酸氨基转移酶(ALT)升高至正常上限的三倍,对GSP的阳性预测值为95%。但是,敏感性仅为48%,GSP个体中有10%的LFT正常。
无创成像研究
进行胆道病理检查时鉴定CBDS对于确定适当的治疗方案至关重要。存在多种有效的成像模式,每种都有优点和缺点。成像方式和具体应用如下所述(每种方式的汇总请参见表2.2)。
超声波
鉴于可获得性,便携性和低成本,经腹部超声(US)通常是处理胆源性腹痛时采用的第一项影像学研究。 US对于直接可视化CBDS的敏感性较差,为23–65%,但可有效检测CBD扩张。然而,由于缺乏明确的胆管扩张定义,临界CBD扩张的临床意义有限。已有研究使用5至10毫米作为正常上限,CBD扩张至7毫米对CBDS有92%的特异性。最初的超声检查具有识别胆石症和其他腹内病理的额外好处[5,17]。图2.6显示了使用US直接可视化CBDS的一种相对罕见的实例。图2.7和2.8分别显示了扩张的肝内和肝外胆管。
CT计算机断层扫描,MRCP磁共振胰胆管造影,CBD胆总管,超声
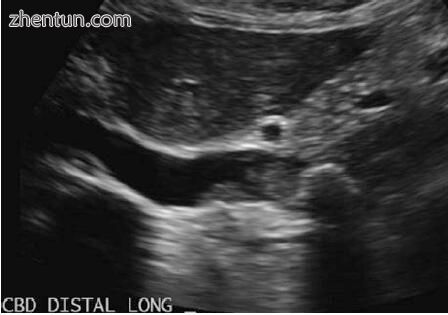
图2.6 CBD的横向超声视图,远端有回声材料(右屏幕)。在后续ERCP期间,清除了多处10–15 mm的石头和淤泥
CT检查
与美国相似,利用静脉和口服造影剂的标准计算机断层扫描(CT)对检测胆道扩张具有良好的敏感性(图2.9),但对CBDS的检测却很差(图2.10)。然而,CT可以有利于区分CBD阻塞的其他原因,例如恶性肿瘤,并评估并发症,例如胰腺炎或肝脓肿。 CT胆管造影术利用胆汁树的三维(3D)重建技术,专门将经口或静脉内造影剂排入胆汁(例如,静脉注射碘化葡糖碘),对胆管树的敏感性为85-97%,特异性为88-96%。检测CBDS。然而,肝内导管可视性差,黄疸背景下的导管乳浊性受阻以及对造影剂的过敏率达15%,限制了其广泛使用。当前,在美国仅可获得静脉胆道造影造影剂。不幸的是,以前在口腔胆囊造影术时代广泛使用并且与静脉内胆管造影剂造影剂相比具有更可接受的安全性的口服胆囊造影剂在超声不再可用。
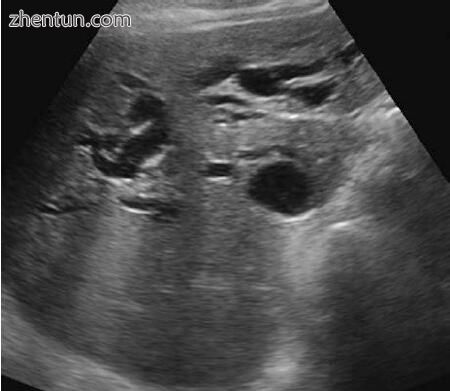
图2.7在超声看到的肝内胆管扩张
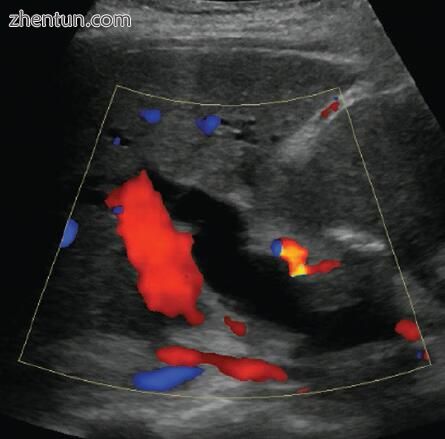
图2.8双侧超声将门静脉(红色)与扩张的13 mm CBD(黑色)区分开
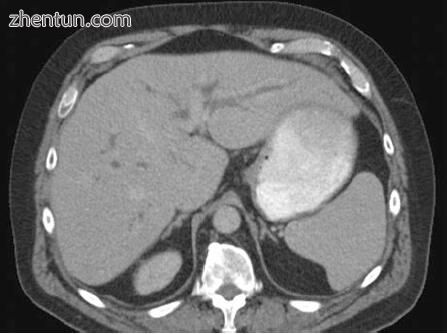
图2.9 CT与IV对比显示肝内胆管扩张。 胆管扩张被视为暗灰色的管状结构(与增强造影的门静脉分支相反)
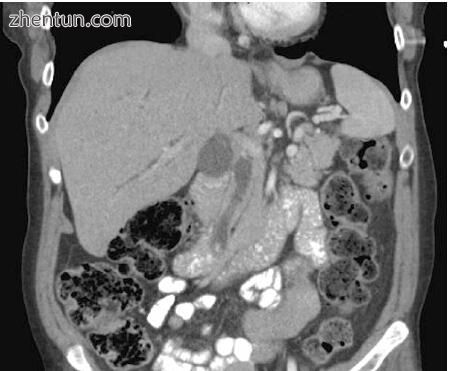
图2.10冠状位CT显示CBD扩张至13 mm(中心,深灰色),远端CBDS钙化
磁共振胰胆管造影
磁共振胰胆管造影(MRCP)是CBDS的一种高效成像方式(图2.11和2.12)。 它是非侵入性的,不需要对比,并且可以在没有麻醉的情况下进行。 主要缺点是成本高昂,而没有实验室证据证明CBDS的胆道疾病常规MRCP并非经济有效。 较小的结石直径(<5 mm)和胰周水肿已显示降低了CBDS识别的准确性[11,16–19]。 MRCP对CBDS的敏感性和特异性分别为93%和96%。

图2.11 MRCP显示远端CBDS的CBD扩张
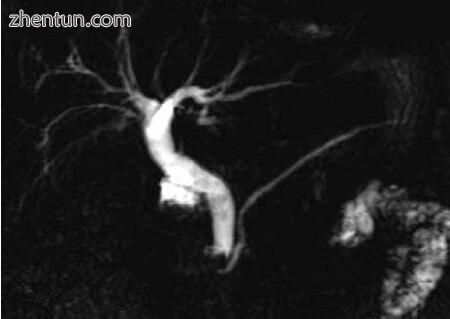
图2.12 MRCP显示了多个CBDS,CBD膨胀了(10毫米)
胆道显像
胆管闪烁显像术通常不用于评估CBDS的存在,但胆道胆石症的体征可从有关胆汁流经胆道的信息中推断出来(图2.13)。 结果表明,CBDS包括2小时后十二指肠缺乏造影剂,造影剂施用90分钟后肝外和肝内导管持续突出。 闪烁法检测CBDS的准确性略高于美国。 闪烁显像仪分析胆汁随时间变化的能力使它能够检测出可能不会引起明显扩张的部分CBD阻塞。
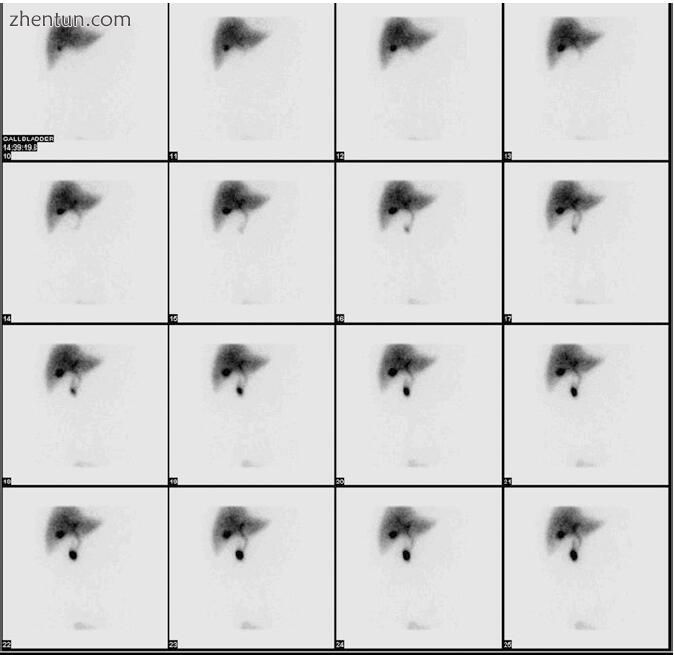
图2.13正常胆管闪烁显像,表明胆汁在胆囊中积聚,并且通过CBD到达十二指肠的流量正常。
术前预测模型及其准确性
在胆道疾病检查过程中预测CBDS风险的能力可以帮助告知适当的术前影像学研究和介入治疗。 从临床,放射学和实验室数据中提出了几个分数。
Lacaine-Huguier分数于1988年开发,并已通过多项前瞻性试验验证。 它仅依赖于结石性胆囊炎患者的临床和超声检查数据,从而提高了易用性。 得分计算如下:
0.04 *(年龄)+
1表示胆绞痛
3.1 for CBD> 12毫米
1.2如果最小胆囊结石<10毫米
0.7用于急性胆囊炎
3.5分或更高的分数表示患CBDS的风险从17%上升到85%,可以提出进一步胆汁评估的理由。 得分低于3.5的个体中只有不到2%的人具有CBDS,并且排除进一步影像学检查可能是合适的。
2010年,美国胃肠道内窥镜检查学会(ASGE)根据临床,实验室和超声检查预测因素,将有症状胆石症患者分为CBDS的低,中或高风险人群:
非常强壮
超声CBDS
临床胆管炎
血清胆红素> 4 mg / dL
强大
CBD> 6毫米
血清胆红素1.8–4 mg / dL
中等
除胆红素外LFT异常
年龄> 55岁
临床GSP
CBDS的风险:
任何非常强的预测指标高
两者都是强预测指标高
无预测值低
所有其他中级
风险类别决定了推荐的治疗和/或影像学方法。对ASGE评分的批评是,它的许多预测因素会导致广泛的中危患者。一项对109位属于中级人群的研究表明,任何一种“强”预测因子的存在都会带来28%的CBDS风险。
结论
胆石症患者中多达20%的人存在胆总管结石。一半无症状,并以正常的胆汁流量进入肠道。胆总管结石的临床表现范围从胆绞痛型症状到胆结石胰腺炎或胆管炎引起的败血症性休克引起的严重上腹痛。胆管炎可预示肝功能检查会发生紊乱,在胆道或胰腺痛的情况下,可很好地预测胆总管结石症。进行胆道疾病检查时,始终宜采用腹部超声检查,并结合临床和实验室数据有助于进一步的检查和管理。
参考文献
1.Internal Clinical Guidelines Team (UK). Gallstone disease: diagnosis and management of cho-lelithiasis, cholecystitis and choledocholithiasis. London: Natl Inst Health Care Excellence (UK). 2014;20(37):13382–401.
2.Goljan EF, editor. Pathology. Philadelphia: Mosby; 2010.
3.Tiderington E, Lee SP, Ko CW. Gallstones: new insights into an old story. F1000Res. 2016;5:1817.
4.Maringhini A, Ciambra M, Baccelliere P, Raimondo M, Orland A, Tine F, Grasso R, Randazzo MA, Barresi L, Gullo D, Musico M, Pagliaro L. Biliary sludge and gallstones in pregnancy: incidence, risk factors, and natural history. Ann Intern Med. 1993;119(2):116–20.
5.Lammert F, Gurusamy K, Ko CW, Miquel JF, Méndez-Sánchez N, Portincasa P, van Erpecum KJ, van Laarhoven CJ, Wang DQ. Gallstones. Nat Rev Dis Primers. 2016;2:16024.
6.Katsika D, Grjibovski A, Einarsson C, Lammert F, Lichtenstein P, Marschall HU. Genetic and environmental influences on symptomatic gallstone disease: a Swedish study of 43,141 twin pairs. Hepatology. 2005;41(5):1138–43.
7.Collins C, Maguire D, Ireland A, Fitzgerald E, O’Sullivan GC. A prospective study of -common bile duct calculi in patients undergoing laparoscopic cholecystectomy: natural history of cho-ledocholithiasis revisited. Ann Surg. 2004;239(1):28–33.
8.Besselink MG, Venneman NG, Go PM, Broeders IA, Siersema PD, Gooszen HG, van Erpecum KJ. Is complicated gallstone disease preceded by biliary colic? J Gastrointest Surg. 2009;13(2):312–7.
9.Kathpalia P, Ahn J. Assessment of jaundice in the hospitalized patient. Clin Liver Dis. 2015;19:155–70.
10.Zimmer V, Lammert F. Acute bacterial cholangitis. Viszeralmedizin. 2015;31(3):166–72.
11.Attasaranya S, Fogel EL, Lehman GA. Choledocholithiasis, ascending cholangitis, and gall-stone pancreatitis. Med Clin North Am. 2008;92(4):925–60. x
12.Demehri FR, Alam HB. Evidence-based management of common gallstone-related emergen-cies. J Intensive Care Med. 2016;31(1):3–13.
13.Kimura Y, Takada T, Strasberg SM, Pitt HA, Gouma DJ, Garden OJ, et al. TG13 current ter-minology, etiology, and epidemiology of acute cholangitis and cholecystitis. J Hepatobiliary Pancreat Sci. 2013;20(1):8–23.
14.Kimura Y, Takada T, Kawarada Y, Nimura Y, Hirata K, Sekimoto M, et al. Definitions, patho-physiology, and epidemiology of acute cholangitis and cholecystitis: Tokyo guidelines. J Hepato-Biliary-Pancreat Surg. 2007;14(1):15–26.
15.Oría A, Cimmino D, Ocampo C, Silva W, Kohan G, Zandalazini H, et al. Early endoscopic intervention versus early conservative management in patients with acute gallstone pancreati-tis and biliopancreatic obstruction. Ann Surg. 2007;245(1):10–7.
16.Huh CW, Jang SI, Lim BJ, Kim HW, Kim JK, Park JS, et al. Clinicopathological features of choledocholithiasis patients with high aminotransferase levels without cholangitis. Medicine. 2016;95(42):e5176.
17.Colletti PM, Ralls PW, Lapin SA, Siegel ME, Halls JM. Hepatobiliary imaging in choledocho-lithiasis: a comparison with ultrasound. Clin Nucl Med. 1986;11(7):482–6.
18.Epelboym I, Winner M, Allendorf JDJ. MRCP is not a cost-effective strategy in the manage-ment of silent common bile duct stones. Gastrointest Surg. 2013;17(5):863–71.
19.Polistina FA, Frego M, Bisello M, Manzi E, Vardanega A, Perin B. Accuracy of magnetic reso-nance cholangiography compared to operative endoscopy in detecting biliary stones, a single center experience and review of literature. World J Radiol. 2015;7(4):70–8.
20.Khalfallah M, Dougaz W, Bedoui R, Bouasker I, Chaker Y, Nouira R, et al. Validation of the Lacaine-Huguier predictive score for choledocholithiasis: prospective study of 380 patients. J Visc Surg. 2012;149(1):e66–72.
21.Maple JT, Ben-Menachem T, Anderson MA, Appalaneni V, Banerjee S, Cash BD, et al. The role of endoscopy in the evaluation of suspected choledocholithiasis. Gastrointest Endosc. 2010;71(1):1–9.
22.Kang J, Paik KH, Lee JC, Kim HW, Lee J, Hwang JH, et al. The Efficacy of clinical predictors for patients with intermediate risk of choledocholithiasis. Digestion. 2016;94(2):100–5. |