概要
ABO血型(BG)与包括妇科癌症在内的癌症发病风险之间的关系已得到广泛研究,显示BG A患者的发病风险增加。由于现有数据不一致,我们研究了BG及其抗聚糖抗体(抗A和抗B)是否在妇科癌症中具有预后价值。我们回顾性评估了1974年至2014年间三个癌症中心(瑞士和澳大利亚)的974例妇科癌症患者的临床病理结果与BG之间的关系。卵巢癌(n = 282)和外阴(n = 67)癌症患者BG的疾病复发时间受到显著影响。与A组相比,BG O或B组患者的卵巢癌复发风险显著增加,分别为59%和82%(p = 0.045; HR O vs A = 1.59(CI 1.01-2.51)和(p = 0.036; HR A) vs B = 0.55(CI 0.32-0.96)。晚期(n = 126)卵巢癌患者复发的中位时间为BG O为18.2个月,A为32.2(p = 0.031; HR O vs A = 2.07(CI 1.07) -4.02))。BG也显著影响外阴癌患者的无复发生存率(p = 0.002),与A相比,BG O的复发风险增加(p = 0.089)。血型因此与卵巢复发有关和外阴癌:患有BG O的女性似乎有较低的卵巢癌发病率,但更有可能更早复发.BG状态作为预后价值的重要性是显而易见的,可能有助于肿瘤学家预测疾病结果并选择适当的治疗。
介绍
人体中的ABO血型(BG)是输血和移植医学中最重要的BG系统。它由两个聚糖定义,即抗原A(GalNAcα1-3(Fucα1-2)Galβ1)和B(Galα1-3(Fucα1-2)Galβ1),由编码A和B等位基因的ABO基因决定,产生两种不同的糖基转移酶活性。这些活性分别向前体H抗原添加N-乙酰半乳糖胺或半乳糖以形成A或B抗原。 BG O中两种抗原的缺失都归因于酶的N末端的移码突变[1]。 ABO BG抗原通常在红细胞和多种其他人类细胞和组织(如胃肠,支气管肺,皮肤和泌尿生殖器上皮细胞[2])上存在的细胞表面糖鞘脂或糖蛋白上表达,也发生在各种体液中和分泌物[3]。
ABO BG参与了几种良性和恶性疾病[4],人类BG与癌症之间的关系是众所周知的[5]。一些研究表明ABO BG与包括卵巢癌在内的各种癌症[5]的发病率和风险[5-7]之间存在关联,并且已经提出了几种合理的解释来解释观察到的ABO BG与癌症之间的关联:这些包括炎症,免疫监视恶性细胞,ABO BG抗原在癌细胞上的表达改变是糖基转移酶活性改变的结果[8],细胞间粘附和膜信号传导[9],单核苷酸多态性和表观遗传学[10]。
卵巢癌(OC),通常在晚期FIGO阶段被诊断出来,是女性癌症死亡的第五大原因,也是女性最致命的妇科癌症,尽管手术技术和药物治疗方案有所改善,但几十年来总生存率没有显著变化[11]。此外,目前使用的筛查方法看起来不够准确:肿瘤标志物CA125和经阴道超声的结合可以测量分类指数,如恶性风险指数(RMI),并促进良性和恶性卵巢肿块之间的区分[12],筛查试验(PLCO-,UKCTOCS-试验)在疾病特异性存活方面没有显示出益处[13,14]。
仍然需要并且正在寻找用于早期疾病检测和疾病预后的新的和高度特异性的生物标志物。我们之前已经表明,P1三糖的血浆衍生抗聚糖抗体水平显著区分了OC患者和健康女性,表明P1是OC相关的碳水化合物抗原[15]。有趣的是,P1碳水化合物抗原属于人类P BG系统,与Pk和P抗原共享寡糖序列[16]。与此相似,正如我们所知,经典血液系统及其抗糖链抗体参与了几种恶性肿瘤的发病机制,我们有兴趣寻找能够识别预后标志的妇科癌症的生存关联。
关于ABO BG与生存之间的关联[17-20],只报告了一小部分数据,而且一般而言,尤其是OC,[21,22]可用于妇科癌症的数据更少且不一致。因此,我们回顾性地评估并比较了大型妇科癌症患者队列(n = 974)的临床病理结果,包括无复发生存期(RFS),疾病特异性生存期(DSS)和总生存期(OS),以及ABO BG状态。
材料和方法
研究队列描述
回顾了1974年至2014年间在瑞士(巴塞尔,苏黎世)和澳大利亚(悉尼)的三个妇科癌症中心的临床病理学数据库。患者的资格标准至少包括组织学证实的妇科癌症,初次治疗后的完全缓解和可用的BG状态。在本研究中,患有癌症以外的原因死亡或发展出与他们最初的癌症不同的第二原发肿瘤的患者进行了审查。在临床基础上(症状)诊断疾病复发和/或增加肿瘤标志物,然后进行放射学确认。根据世界卫生组织定义组织学分级,并通过FIGO分期确定疾病程度。根据跨学科肿瘤会议的建议,除非被拒绝,否则所有患者均接受手术治疗,辅助化疗和/或放疗。这些建议基于国际数据和指南,并根据患者的合并症进行个体化。所有患者的BG状态(ABO系统)在手术前血清学确定。患者在前两年每3个月随访一次,然后每6个月随访一次,直至完成初级治疗后5年,然后每年一次。共分析了974名患者,分为282例卵巢,56例腹膜,23例输卵管,377例子宫内膜,149例宫颈,11例阴道,67例外阴和9例同步卵巢/子宫内膜癌。该研究得到了瑞士医学伦理委员会EKNZ 2015-436的批准。对于回顾性研究而言,无论是书面还是口头同意,数据加入都是匿名的。
统计分析
比较研究组的描述性统计数据报告为计数和百分比,或者视为适当的平均值和标准差(SD)。使用Fisher精确检验(计数)和t检验(序数数据)计算相应的p值。分析了临床病理结果,ABO BG和结果(RFS,DSS和OS)之间的关系。 RFS定义为从诊断日期到疾病复发日期的时期(如上所述)。 DSS从诊断日期到疾病死亡计算。对未知原因或疾病以外的死亡进行了审查。 Kaplan-Meier分析用于计算存活率或事件分析时间(RFS,DSS和OS),置信区间(CI)为95%。还报告了5年OS的数据。 Log-rank检验用于比较生存曲线。另外,进行包括比较每个血型的中心效应的Cox回归分析。对于协变量,分析没有进行调整。报告结果(中值),风险比(HR),相应的95%CI和p值。报告的p值是双侧的,p <0.05被认为具有统计学意义。使用R版3.0.1进行统计分析。
结果
通过血型分类的所有妇科癌症患者的临床病理学特征
该研究包括974名患有各种妇科癌症的患者。 平均年龄为62.8±13.7岁,平均随访时间为4.8±33.7岁。 BG分布为471例BG A(48.4%),94例B(9.6%),375例O(38.5%),34例AB(3.5%),与一般人群相似 在欧洲。 该队列包括卵巢(n = 282),腹膜(n = 56),输卵管(n = 23),宫颈(n = 149),子宫内膜(n = 377),阴道(n = 11)和外阴癌(n) = 67)患者。 表1总结了关于研究队列的这一和其他信息,包括肿瘤类型,组织学,分期,分级,残留疾病,存活状态和BG状态的复发状态。
表格1
妇科癌症队列的临床病理资料按血型分类。
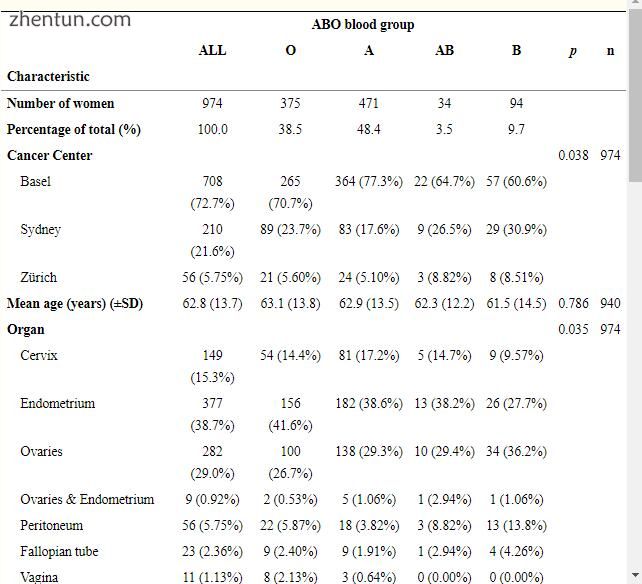
来自妇科癌症中心(瑞士巴塞尔和苏黎世)和悉尼(澳大利亚)的数据在1974年至2014年间收集.P值通过t检验或Fisher精确检验计算。
血型对所有妇科癌症患者的RFS,DSS和OS的影响
对所有7种妇科癌症类型进行了事件时间分析。对于DSS,这些癌症类型与BG没有显著关联:卵巢(p = 0.696),腹膜(p = 0.28),输卵管(p = 0.366),宫颈(p = 0.723),子宫内膜(p = 0.39),阴道(p = 0.26)和外阴(VC,p = 0.29)癌症。在腹膜(p = 0.889),输卵管(p = 0.814),宫颈(p = 0.638),子宫内膜(p = 0.492)或阴道(p = 0.480)癌症中,RFS也未发现与BG的显著相关性。相反,对于OC和VC,发现了RFS和BG的关联。整个队列没有发现OS的重要关联(p = 0.287)。
血型对卵巢癌患者RFS和OS的影响
OC组包括282名患者,平均诊断年龄为60.7±13.7岁,平均随访时间为3.26±4.12岁。 BG分布为100(35.5%),BG为A,138(48.9%)为A,10(3.5%)为AB,34(12.1%)为B.这些和其他临床病理数据在表2中给出。
表2
卵巢癌队列的临床病理资料按血型分类。
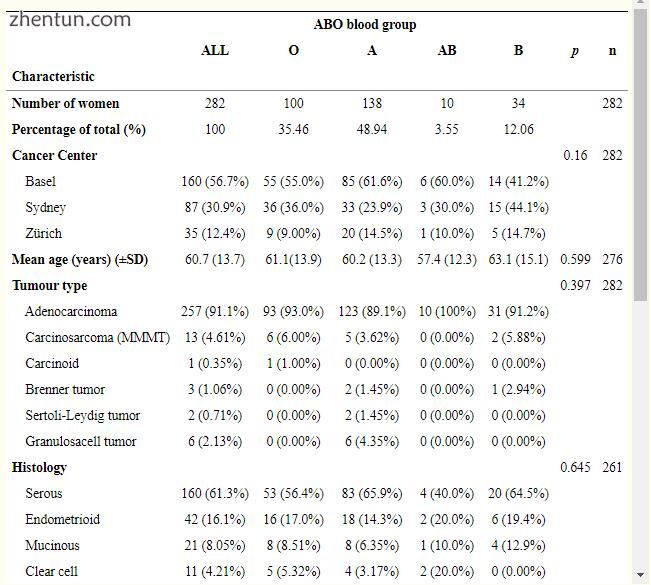
来自妇科癌症中心(瑞士巴塞尔和苏黎世)和悉尼(澳大利亚)的数据在1974年至2014年间收集.P值通过T检验或Fisher精确检验计算得出。
OC患者复发的中位时间为BG O为25.4个月,A为51.1个月,AB为50.0个月,B为24.0个月(图1A和1B),表明BG A患者比患者复发约2年。 BG O.
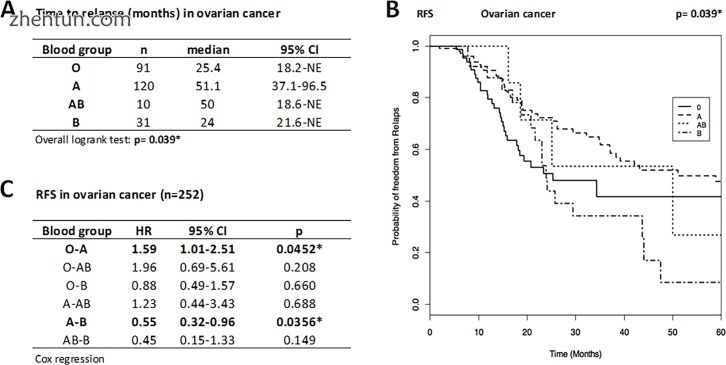
图1
复发时间(A),RFS(B)的Kaplan-Meier曲线和卵巢癌患者的疾病复发率(C)(n = 252)。与A患者相比,BG O和B患者显示复发风险显著增加(分别为59%,p = 0.045和82%,p = 0.036; Cox消退)。因此,BG A患者预后较好,RFS明显长于O和B患者。复发时间以中位数(月数)和95%CI表示,并通过整体因素检测和疾病复发风险进行比较,表现为HR和95%CI 。由星号(*)标记或突出显示的统计显著性。 NE,不值得估计。作为时间(月)的函数,RFS作为无复发的概率给出。
统计分析显示BG对OC复发时间的显著影响(p = 0.039)(图1C):BG O患者显示统计学显著性(p = 0.045)59%(HR O vs A = 1.59) OC复发的风险增加和BG B患者的统计学显著性(p = 0.036)82%(图B中给出的HR B与A = 1.82 = 1 / 0.55)与BG A相比,OC复发的风险增加,表明BG A患者预后较好,无复发生存期明显长于BG O和BG B患者。其他比较未发现复发风险有显著差异。同样,在血型组中没有发现OS的差异(p = 0.665)。 BG O的5年OS为0.694(95%CI:0.531-0.907),BG A为0.734(95%CI:0.624-0.863)(由于病例数较少而未报告BG AB和BG B的值)事件)。
血型对外阴癌患者RFS和OS的影响
VC组包括67例患者,平均诊断年龄为70.0±13.8岁,平均随访时间为5.15±5.5岁。 BG O的BG分布为35.5%,A为52.2%,AB为1.5%,B为10.5%。数据显示(图2A和2B)BG O复发的中位时间为305.6个月(n = 21) ),BG B(n = 7)为21.4个月,BG AB患者为11.7个月,28例BG A患者无评估(60个月内无复发)。尽管病例数和非可估计数据较少,但发现BG与VC复发时间之间存在高度显著(p = 0.0024)的关系。与A相比,BG O患者的Cox回归(图2C)分析显示BG A患者复发时间延长4倍的趋势,而其他组之间的比较已经过时,因为病例数和非可估计的数据。由于案例和事件数量较少,未报告OS数据。
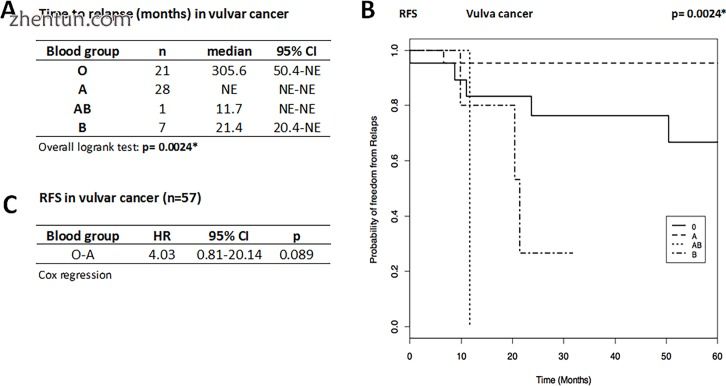
图2
复发时间(A),RFS(B)的Kaplan-Meier曲线和外阴癌患者的疾病复发率(C)(n = 57)。与A患者A相比,BG O患者的复发风险往往增加(HR O vs A = 4.03,95%CI:0.81-20.14,p = 0.089),即A患者预后较好,RFS较患者更长与BG O.复发时间表示为中位数(月)和95%CI,并通过整体Logrank检验进行比较。通过Cox回归将疾病复发风险表示为HR和95%CI(由于AB和B的样本量较小,仅对O和A可能)。由星号(*)标记或突出显示的统计显著性。 NE,不值得估计。作为时间(月)的函数,RFS作为无复发的概率给出。
总之,数据表明BG O与OC和VC中疾病复发的高风险相关。
血型对FIGO III卵巢腺癌的影响
为了消除FIGO阶段的预后效果的贡献,我们确定了FIGO III期卵巢腺癌患者的RFS和OS。在这个更加同质的亚组(n = 108)中,BG O(n = 37)复发的中位时间为18.2个月,A(n = 53)为32.2个月,AB(n = 4)为18.6个月,14 B的月份(n = 14),因此彼此之间没有显著差异(图3A和3B)。 Cox回归分析显示,与BG A相比,具有BG O的FIGO III卵巢癌患者的复发风险具有统计学显著性两倍(HR O vs A = 2.07; 95%CI:1.07-4.02; p = 0.0313),而其他比较没有发现任何显著差异(图3B)。血液组的OS没有差异(p = 0.115)。 BG O的5年OS为0.714(95%CI:0.478-1.000),BG A为0.789(95%CI:0.619-1.000)(由于病例数较少而未报告BG AB和BG B的数据)事件)。
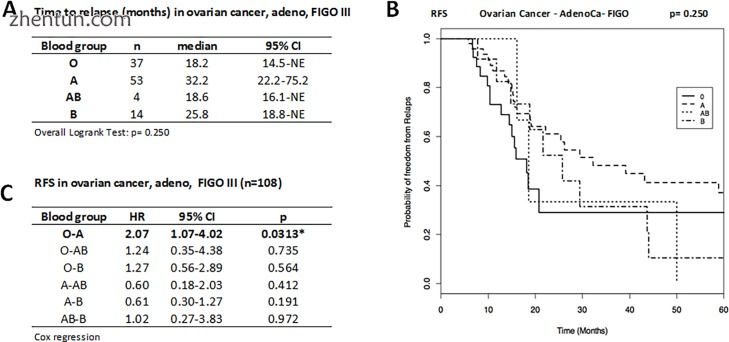
图3
FIGO III腺癌患者亚组(n = 108)的复发时间(A),RFS的Kaplan-Meier曲线(B)和疾病复发的HR(C)。与A患者A相比,BG O患者复发风险增加两倍,即BG A患者预后较好,RFS显著长于O患者。复发时间以中位数(月数)和95%CI表示,并进行比较Logrank测试。通过Cox回归将疾病复发风险表示为HR和95%CI。由星号(*)标记或突出显示的统计显著性。 NE,不值得估计。作为时间(月)的函数,RFS作为无复发的概率给出。
讨论
这项针对各种妇科恶性肿瘤的回顾性研究显示,OC和VC的无复发生存期(RFS)(但不是其他妇科癌症,如腹膜,子宫内膜,子宫内膜,输卵管和子宫内膜癌)对ABO BG状态有显著影响。具体而言,与BG A患者相比,BG O和B卵巢癌患者的复发风险显著增加(即BG A患者预后明显好于复发时间长于BG O和B患者)和BG A外阴与患有BG O的患者相比,癌症患者至少倾向于具有更长的复发时间。对于这两种癌症,DSS和OS没有观察到任何影响。我们的数据表明,OC和VC患者的RFS与ABO血型相关,这表明ABO状态是RFS的重要因素。本研究首次显示了CBO的ABO BG状态,特别是BG A在OC和VC中的预后价值,也是英国文献中关于RFO和ABO BG预后价值的最大数据。 DSS在妇科癌症中的应用。
关于ABO BG与癌症预后之间的关系的文献知道的很少(总结在表3中)。 1995年发表的一项关于妇科癌症的研究(意大利语)[21]报道了与BG O相比,子宫内膜和OC中总生存(OS)和BG A之间的负相关,以及BG A和OS在宫颈癌患者中的正相关性。考虑到这一点,似乎具有BG A的OC患者具有较低的复发风险,没有不同的DSS,但是比BG O患者更差的OS,但是最近在700多名患者的研究中报告了相反的结果,证明了显著更好的OS BG A患者与BG O或非A患者相比[22]。然而,在我们的研究中,对于任何BG,OC患者的OS没有差异。
表3
癌症类型对ABO血型预后的研究。
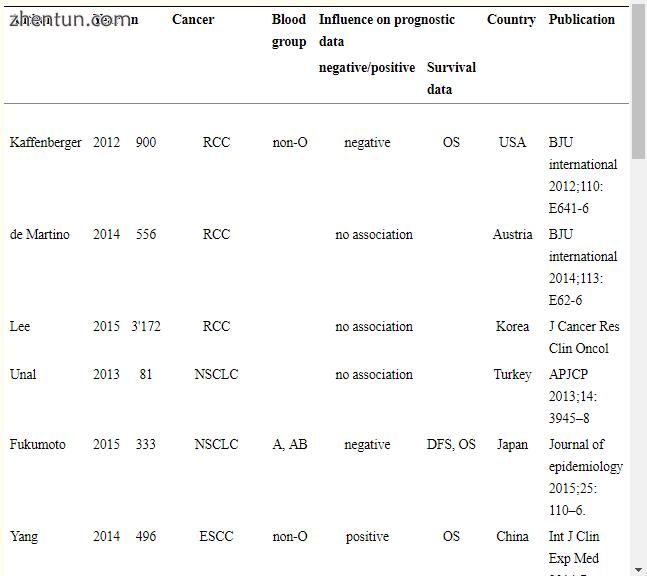
RCC(肾细胞癌),NSCLC(非小细胞肺癌),ESCC(食管鳞状细胞癌),OS(总体存活),DFS(无疾病存活),RFS(复发自由生存)。目前的斜体研究。
然而,最大的可用数据涉及ABO BG与癌症风险和发病率的关联。 BG和癌症风险之间可能存在关联的第一个迹象发表于1953年,报告BG A中胃癌发病率比O增加20%[23]。从那时起,发表了越来越多的经常不一致的数据,表明ABO抗原的生物学作用可能是疾病特异性的。患有BG A和AB的患者胆囊风险增加[24]和鼻咽癌[25],而非O女性血型携带者已被确定患肾细胞癌的风险较高[26]。 BG B与心脏和食管癌显著相关[27,28]。 BG O携带者患基底细胞癌,皮肤鳞状细胞癌的风险降低[29],胰腺癌风险降低[30]。已经报道了其他相关性,但肺[31,32],乳腺[33,34]和结肠直肠癌[35,36]的数据不可重复。最近对来自30个癌症部位的100个554个病例的89个符合条件的研究进行的荟萃分析计算出A与非A组的总体癌症风险为1.12,O与非O组为0.84 [5]。妇科癌症的报告也很少见,主要表明BG A与非A相比OC风险增加,BG O风险降低[5-7]。 8项研究报道了血型与宫颈癌风险没有显著关联[7],两项研究报道子宫内膜癌无明显相关性[7]。仅有两项研究报道了其他妇科癌症,外阴侵袭性鳞状细胞癌没有任何显著差异[37,38]。
所有这些研究都强调了BG对恶性疾病(包括卵巢癌,外阴癌和子宫内膜癌)的发病风险,预后和预后的生物学作用。已经描述了ABO血型与改良免疫应答之间的关联[39,40],但这可能无法完全解释ABO BG如何与癌症风险发生率相关联。 Welshinger等。已经表明,尽管卵巢表面上皮细胞通常不表达BG抗原,但ABO抗原在活化表面上皮的某些区域,包涵体囊肿以及半数卵巢癌中表达[41],但仍然知之甚少BG抗原或BG抗原丰度的改变如何影响癌发生以及BG抗原表达是否是恶性转化的结果。
人们也很难理解BG抗原如何与疾病结果和预后相关。 BG抗原在癌细胞上的表达可以进行遗传和表观遗传修饰,例如, ABO启动子甲基化,反过来可能与肿瘤的侵袭和转移有关[10]。某些肿瘤抗原可以模拟ABO系统的抗原结构。主要在胃和结肠肿瘤中表达的Forssmann抗原在结构上几乎与A抗原决定簇相同:由于识别和攻击表达Forssmann抗原的肿瘤细胞的能力降低,BG A携带者可能具有减少的肿瘤免疫应答[5]。来自通常不表达这些抗原的组织的癌中A和B抗原的丰度可以通过增加细胞运动性,抗凋亡和免疫逃逸来促进癌症侵袭性[2]。
本研究最重要的发现是,与BG O(和B)相比,OC患者和某些程度上具有BG A的外阴癌患者具有显著更长的RFS。这一发现与最近报道的BG患者相比BG O或非A患者的生存期更长[22],并且表明较低的复发风险可以解释这种更好的生存率。该发现提供了关于结果和ABO BG在妇科癌症中的新颖性。但是,开放式问题仍然存在,例如为什么BG A患者有更好的RFS预后,为什么DSS没有反映这种优势,以及为什么没有发现其他妇科癌症的关联。至少我们的数据表明A抗原(或抗B抗体)的丰度延迟复发或B抗原(或抗A抗体)促进这些癌症的复发,但不知道这些免疫分子影响疾病复发的机制。同样有趣的是观察到OC中发病风险和RFS之间的相互关系:患有BG O的女性似乎发病率较低,但更可能更早发生复发。
尽管BG A对OC中延长的RFS具有积极作用的强烈迹象,我们认识到偶尔的小样本数(尽管有近1000名患者的强大队列)可能会限制统计分析的价值,例如对于AB患者(最不常见的血型),罕见的妇科癌症(例如外阴,阴道)和小的亚组(例如组织学,分期,分级),保证进行更大群组的研究。
参考:
ABO blood groups as a prognostic factor for recurrence in ovarian and vulvar cancer
1. Yamamoto F, Clausen H, White T, Marken J, Hakomori S. Molecular genetic basis of the histo-blood group ABO system. Nature. 1990;345(6272):229–33. doi: 10.1038/345229a0 . [PubMed] [Google Scholar]
2. Le Pendu J, Marionneau S, Cailleau-Thomas A, Rocher J, Le Moullac-Vaidye B, Clement M. ABH and Lewis histo-blood group antigens in cancer. APMIS: acta pathologica, microbiologica, et immunologica Scandinavica. 2001;109(1):9–31. Epub 2001/04/12. . [PubMed] [Google Scholar]
3. Seltsam A, Hallensleben M, Kollmann A, Blasczyk R. The nature of diversity and diversification at the ABO locus. Blood. 2003;102(8):3035–42. doi: 10.1182/blood-2003-03-0955 . [PubMed] [Google Scholar]
4. Liumbruno GM, Franchini M. Beyond immunohaematology: the role of the ABO blood group in human diseases. Blood Transfus. 2013;11(4):491–9. doi: 10.2450/2013.0152-13 ; PubMed Central PMCID: PMCPMC3827391. [PMC free article] [PubMed] [Google Scholar]
5. Zhang B-L, He N, Huang Y-B, Song F-J, Chen K-X. ABO Blood Groups and Risk of Cancer: a Systematic Review and Meta-analysis. Asian Pacific Journal of Cancer Prevention. 2014;15(11):4643–50. doi: 10.7314/apjcp.2014.15.11.4643 [PubMed] [Google Scholar]
6. Poole EM, Gates MA, High BA, Chanock SJ, Cramer DW, Cunningham JM, et al. ABO blood group and risk of epithelial ovarian cancer within the Ovarian Cancer Association Consortium. Cancer causes & control: CCC. 2012;23(11):1805–10. Epub 2012/09/11. doi: 10.1007/s10552-012-0059-y ; PubMed Central PMCID: PMC3474344. [PMC free article] [PubMed] [Google Scholar]
7. Yuzhalin AE, Kutikhin AG. ABO and Rh Blood Groups in Relation to Ovarian, Endometrial and Cervical Cancer Risk Among The Population of South-East Siberia. Asian Pacific Journal of Cancer Prevention. 2012;13(10):5091–6. doi: 10.7314/apjcp.2012.13.10.5091 [PubMed] [Google Scholar]
8. Hakomori S. Antigen structure and genetic basis of histo-blood groups A, B and O: their changes associated with human cancer. Biochimica et biophysica acta. 1999;1473(1):247–66. . [PubMed] [Google Scholar]
9. Matsumoto H, Muramatsu H, Shimotakahara T, Yanagi M, Nishijima H, Mitani N, et al. Correlation of expression of ABH blood group carbohydrate antigens with metastatic potential in human lung carcinomas. Cancer. 1993;72(1):75–81. Epub 1993/07/01. . [PubMed] [Google Scholar]
10. Gao S, Worm J, Guldberg P, Eiberg H, Krogdahl A, Liu CJ, et al. Genetic and epigenetic alterations of the blood group ABO gene in oral squamous cell carcinoma. International journal of cancer Journal international du cancer. 2004;109(2):230–7. Epub 2004/01/30. doi: 10.1002/ijc.11592 . [PubMed] [Google Scholar]
11. Bowtell DD, Bohm S, Ahmed AA, Aspuria PJ, Bast RC Jr., Beral V, et al. Rethinking ovarian cancer II: reducing mortality from high-grade serous ovarian cancer. Nat Rev Cancer. 2015;15(11):668–79. doi: 10.1038/nrc4019 ; PubMed Central PMCID: PMCPMC4892184. [PMC free article] [PubMed] [Google Scholar]
12. Manegold-Brauer G, Buechel J, Knipprath-Meszaros A, Schoetzau A, Hacker NF, Tercanli S, et al. Improved Detection Rate of Ovarian Cancer Using a 2-Step Triage Model of the Risk of Malignancy Index and Expert Sonography in an Outpatient Screening Setting. Int J Gynecol Cancer. 2016. doi: 10.1097/IGC.0000000000000718 . [PubMed] [Google Scholar]
13. Jacobs IJ, Menon U, Ryan A, Gentry-Maharaj A, Burnell M, Kalsi JK, et al. Ovarian cancer screening and mortality in the UK Collaborative Trial of Ovarian Cancer Screening (UKCTOCS): a randomised controlled trial. Lancet. 2016;387(10022):945–56. doi: 10.1016/S0140-6736(15)01224-6 ; PubMed Central PMCID: PMCPMC4779792. [PMC free article] [PubMed] [Google Scholar]
14. Buys SS, Partridge E, Black A, Johnson CC, Lamerato L, Isaacs C, et al. Effect of screening on ovarian cancer mortality: the Prostate, Lung, Colorectal and Ovarian (PLCO) Cancer Screening Randomized Controlled Trial. JAMA. 2011;305(22):2295–303. doi: 10.1001/jama.2011.766 . [PubMed] [Google Scholar]
15. Jacob F, Anugraham M, Pochechueva T, Tse BW, Alam S, Guertler R, et al. The glycosphingolipid P(1) is an ovarian cancer-associated carbohydrate antigen involved in migration. British journal of cancer. 2014;111(8):1634–45. Epub 2014/08/29. doi: 10.1038/bjc.2014.455 ; PubMed Central PMCID: PMC4200095. [PMC free article] [PubMed] [Google Scholar]
16. Kaczmarek R, Buczkowska A, Mikolajewicz K, Krotkiewski H, Czerwinski M. P1PK, GLOB, and FORS blood group systems and GLOB collection: biochemical and clinical aspects. Do we understand it all yet? Transfusion medicine reviews. 2014;28(3):126–36. doi: 10.1016/j.tmrv.2014.04.007 . [PubMed] [Google Scholar]
17. Yang X, Huang Y, Feng JF. Is there an association between ABO blood group and overall survival in patients with esophageal squamous cell carcinoma? International journal of clinical and experimental medicine. 2014;7(8):2214–8. Epub 2014/09/19. ; PubMed Central PMCID: PMC4161570. [PMC free article] [PubMed] [Google Scholar]
18. Xu YQ, Jiang TW, Cui YH, Zhao YL, Qiu LQ. Prognostic value of ABO blood group in patients with gastric cancer. J Surg Res. 2016;201(1):188–95. doi: 10.1016/j.jss.2015.10.039 . [PubMed] [Google Scholar]
19. Cao X, Wen ZS, Sun YJ, Li Y, Zhang L, Han YJ. Prognostic value of ABO blood group in patients with surgically resected colon cancer. British journal of cancer. 2014;111(1):174–80. Epub 2014/06/06. doi: 10.1038/bjc.2014.302 ; PubMed Central PMCID: PMC4090745. [PMC free article] [PubMed] [Google Scholar]
20. Cihan YB. Significance of ABO-Rh Blood Groups in Response and Prognosis in Breast Cancer Patients Treated with Radiotherapy and Chemotherapy. Asian Pacific Journal of Cancer Prevention. 2014;15(9):4055–60. doi: 10.7314/apjcp.2014.15.9.4055 [PubMed] [Google Scholar]
21. Marinaccio M, Traversa A, Carioggia E, Valentino L, Coviello M, Salamanna S, et al. [Blood groups of the ABO system and survival rate in gynecologic tumors]. Minerva ginecologica. 1995;47(3):69–76. Epub 1995/03/01. . [PubMed] [Google Scholar]
22. Cozzi GD, Levinson RT, Toole H, Snyder MR, Deng A, Crispens MA, et al. Blood type, ABO genetic variants, and ovarian cancer survival. PloS one. 2017;12(4):e0175119 doi: 10.1371/journal.pone.0175119 ; PubMed Central PMCID: PMCPMC5407760. [PMC free article] [PubMed] [Google Scholar]
23. Aird I, Bentall HH, Roberts JA. A relationship between cancer of stomach and the ABO blood groups. British medical journal. 1953;1(4814):799–801. Epub 1953/04/11. ; PubMed Central PMCID: PMC2015995. [PMC free article] [PubMed] [Google Scholar]
24. Pandey M, Gautam A, Shukla VK. ABO and Rh blood groups in patients with cholelithiasis and carcinoma of the gall bladder. BMJ (Clinical research ed). 1995;310(6995):1639 Epub 1995/06/24. ; PubMed Central PMCID: PMC2550011. [PMC free article] [PubMed] [Google Scholar]
25. Sheng L, Sun X, Zhang L, Su D. ABO blood group and nasopharyngeal carcinoma risk in a population of Southeast China. International journal of cancer Journal international du cancer. 2013;133(4):893–7. Epub 2013/02/08. doi: 10.1002/ijc.28087 . [PubMed] [Google Scholar]
26. Joh HK, Cho E, Choueiri TK. ABO blood group and risk of renal cell cancer. Cancer epidemiology. 2012;36(6):528–32. Epub 2012/07/31. doi: 10.1016/j.canep.2012.07.001 ; PubMed Central PMCID: PMC3717382. [PMC free article] [PubMed] [Google Scholar]
27. Su M, Lu SM, Tian DP, Zhao H, Li XY, Li DR, et al. Relationship between ABO blood groups and carcinoma of esophagus and cardia in Chaoshan inhabitants of China. World journal of gastroenterology: WJG. 2001;7(5):657–61. Epub 2002/01/31. doi: 10.3748/wjg.v7.i5.657 . [PMC free article] [PubMed] [Google Scholar]
28. Wang W, Liu L, Wang Z, Lu X, Wei M, Lin T, et al. ABO blood group and esophageal carcinoma risk: from a case-control study in Chinese population to meta-analysis. Cancer causes & control: CCC. 2014;25(10):1369–77. Epub 2014/07/30. doi: 10.1007/s10552-014-0442-y . [PubMed] [Google Scholar]
29. Xie J, Qureshi AA, Li Y, Han J. ABO blood group and incidence of skin cancer. PloS one. 2010;5(8):e11972 Epub 2010/08/10. doi: 10.1371/journal.pone.0011972 ; PubMed Central PMCID: PMC2915921. [PMC free article] [PubMed] [Google Scholar]
30. Amundadottir L, Kraft P, Stolzenberg-Solomon RZ, Fuchs CS, Petersen GM, Arslan AA, et al. Genome-wide association study identifies variants in the ABO locus associated with susceptibility to pancreatic cancer. Nature genetics. 2009;41(9):986–90. Epub 2009/08/04. doi: 10.1038/ng.429 ; PubMed Central PMCID: PMC2839871. [PMC free article] [PubMed] [Google Scholar]
31. Oguz A, Unal D, Tasdemir A, Karahan S, Aykas F, Mutlu H, et al. Lack of any association between blood groups and lung cancer, independent of histology. Asian Pacific journal of cancer prevention: APJCP. 2013;14(1):453–6. Epub 2013/03/29. . [PubMed] [Google Scholar]
32. Urun Y, Utkan G, Cangir AK, Oksuzoglu OB, Ozdemir N, Oztuna DG, et al. Association of ABO blood group and risk of lung cancer in a multicenter study in Turkey. Asian Pacific journal of cancer prevention: APJCP. 2013;14(5):2801–3. Epub 2013/06/28. . [PubMed] [Google Scholar]
33. Gates MA, Xu M, Chen WY, Kraft P, Hankinson SE, Wolpin BM. ABO blood group and breast cancer incidence and survival. International journal of cancer Journal international du cancer. 2012;130(9):2129–37. Epub 2011/06/03. doi: 10.1002/ijc.26220 ; PubMed Central PMCID: PMC3655700. [PMC free article] [PubMed] [Google Scholar]
34. Miao SY, Zhou W, Chen L, Wang S, Liu XA. Influence of ABO blood group and Rhesus factor on breast cancer risk: a meta-analysis of 9665 breast cancer patients and 244,768 controls. Asia-Pacific journal of clinical oncology. 2014;10(2):101–8. Epub 2013/05/30. doi: 10.1111/ajco.12083 . [PubMed] [Google Scholar]
35. Khalili H, Wolpin BM, Huang ES, Giovannucci EL, Kraft P, Fuchs CS, et al. ABO blood group and risk of colorectal cancer. Cancer epidemiology, biomarkers & prevention: a publication of the American Association for Cancer Research, cosponsored by the American Society of Preventive Oncology. 2011;20(5):1017–20. Epub 2011/03/19. doi: 10.1158/1055-9965.epi-10-1250 ; PubMed Central PMCID: PMC3089692. [PMC free article] [PubMed] [Google Scholar]
36. Urun Y, Ozdemir NY, Utkan G, Akbulut H, Savas B, Oksuzoglu B, et al. ABO and Rh blood groups and risk of colorectal adenocarcinoma. Asian Pacific journal of cancer prevention: APJCP. 2012;13(12):6097–100. Epub 2012/01/01. . [PubMed] [Google Scholar]
37. Redman R, Massoll NA, Wilkinson EJ. Association between invasive squamous cell carcinoma of the vulva and ABO blood group. Journal of lower genital tract disease. 2005;9(2):89–92. Epub 2005/05/05. . [PubMed] [Google Scholar]
38. Rolfe KJ, Nieto JJ, Reid WM, Perrett CW, MacLean AB. Is there a link between vulval cancer and blood group? European journal of gynaecological oncology. 2002;23(2):111–2. Epub 2002/05/16. . [PubMed] [Google Scholar]
39. Paterson AD, Lopes-Virella MF, Waggott D, Boright AP, Hosseini SM, Carter RE, et al. Genome-wide association identifies the ABO blood group as a major locus associated with serum levels of soluble E-selectin. Arteriosclerosis, thrombosis, and vascular biology. 2009;29(11):1958–67. Epub 2009/09/05. doi: 10.1161/ATVBAHA.109.192971 ; PubMed Central PMCID: PMC3147250. [PMC free article] [PubMed] [Google Scholar]
40. Barbalic M, Dupuis J, Dehghan A, Bis JC, Hoogeveen RC, Schnabel RB, et al. Large-scale genomic studies reveal central role of ABO in sP-selectin and sICAM-1 levels. Human molecular genetics. 2010;19(9):1863–72. Epub 2010/02/20. doi: 10.1093/hmg/ddq061 ; PubMed Central PMCID: PMC2850624. [PMC free article] [PubMed] [Google Scholar]
41. Welshinger M, Finstad CL, Venkatraman E, Federici MG, Rubin SC, Lewis JL Jr., et al. Expression of A, B, and H blood group antigens in epithelial ovarian cancer: relationship to tumor grade and patient survival. Gynecologic oncology. 1996;62(1):106–12. Epub 1996/07/01. . [PubMed] [Google Scholar] |