概要
1.萎缩是细胞,组织和/或器官的大小和功能的减少。
临床上,它通常被认为是器官大小或功能的减少。
2.声带萎缩定义为声带大小和功能的减少。因此,声带萎缩也可以定义为层状结构的每个部分的尺寸和声带功能的减小。
3.临床上,萎缩性声带的膜部分变得凹陷,很容易被认为是声门无能。
4.声带褶皱组织的萎缩部分在每种疾病中都有不同的声带萎缩。理解声带的组织结构和声带萎缩的组织病理学对于理解萎缩性声带治疗背后的概念是重要的。
23.1简介
萎缩是细胞,组织和/或器官的大小和功能的减少。临床上,它通常被认为是器官大小或功能的减少。
因此,声带萎缩可以定义为声带的大小和功能的减小。临床上,萎缩性声带的膜部分变得凹陷,并且很容易被认为是声门无能。
声带褶皱组织的萎缩部分在每种疾病中具有不同的声带萎缩。理解声带的组织结构和声带萎缩的组织病理学对于理解萎缩性声带治疗背后的概念是重要的。
23.2声带萎缩的定义
人类声带具有由上皮组成的分层结构;固有层的浅层,中层和深层;和发声肌肉。表层被称为Reinke空间。声带韧带由中间层和深层组成。这种分层结构在振动中非常重要。
因此,声带萎缩也可以定义为层状结构的每个部分的尺寸和声带的功能的减小。
萎缩的声带组织的部分在每种疾病中具有不同的声带萎缩:
(1)声带肌的大小随着喉返神经麻痹而减少。
(2)声带粘膜固有层浅层的大小随着声带的减少而减小。
(3)激光或其他辐射源照射后,声带组织的大小减小。
(4)声带褶皱黏膜和声带肌的固有层均在老年声带中减小,尽管老年性声带萎缩主要与固有层的大小减少有关,尤其是表层。
23.3复发性喉神经麻痹
在喉返神经麻痹引起的声带萎缩的情况下,可以检测到甲状腺肌肉大小的减小(图23.1)。甲状腺肌肉的肌纤维变得萎缩和退化(图23.2)。另一方面,声带粘膜的固有层是完整的(图23.3)。这就是为什么声带褶皱粘膜在甲状腺肌肉增强手术后振动的原因。
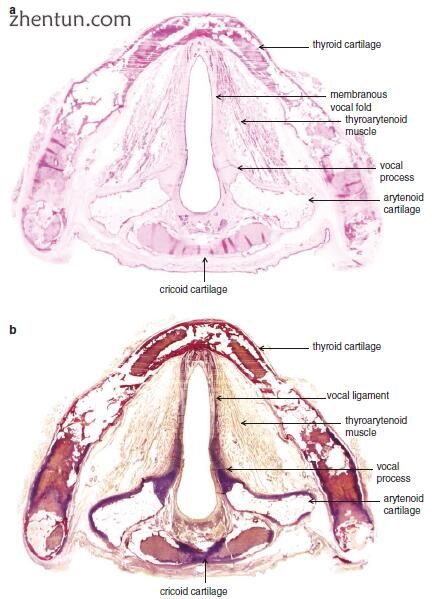
图. 23.1 人喉部横断面,双侧喉返神经麻痹处于声门水平。 可以检测到甲状腺肌肉大小的减少(a,苏木精和伊红染色; b,Elastica van Gieson染色)
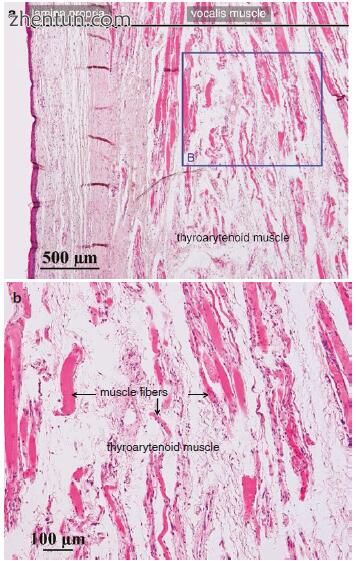
图. 23.2 (a)人体声带的横切面,伴有重复的喉神经麻痹(苏木精和伊红染色)。 (b)甲状腺肌肉的肌纤维已成为萎缩和肌肉纤维(a区域B)
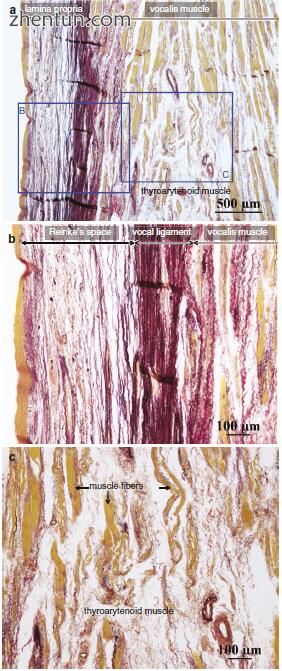
图. 23.3 (a)人体声带的横切面,伴有重复的喉神经麻痹(Elastica van Gieson染色)。 (b)声带粘膜的固有层是完整的。胶原纤维染成红色,弹性纤维用Elastica van Gieson染色(a区域B)染成黑色。 (c)甲状腺肌肉的肌纤维变得萎缩和退化。间隙空间稀疏(a中的区域C)
23.4 声带沟
在由声沟引起的声带萎缩的情况下,可以检测到声带粘膜的固有层(Reinke's空间)的表面尺寸的减小(图23.4)。
声带沟是沿着膜状声带边缘的沟槽。龈沟局限于复层鳞状上皮区域。龈沟位于固有层的浅层。在沟的底部周围,固有层的浅层是薄的。
在声带沟的沟槽中,基底膜厚度显著增加(图23.5和23.6)。厚度约为12.5μm。它由透明层,致密板和网状板层组成。薄层密度是电子致密层,厚度约为40-60nm。它变得多层化。网状纤维网中的胶原纤维增加。
胶原纤维在龈沟底部周围的固有层薄层中致密(图23.7和23.8)。胶原纤维由许多宽度约为50nm的胶原纤维组成。他们向各个方向走行。在龈沟底部周围的椎板原始浅层中观察到纤维状长间距胶原(图23.9)。纤维状长间距胶原的直径约为150nm,具有宽的交叉带,周期为约120nm。可以看到许多平行于纤维长间隔胶原的长轴延伸的内部细丝。常见的胶原纤维存在于纤维状长间隔胶原附近。网状纤维(III型胶原)稀疏。弹性纤维的数量减少了(图23.7和23.8)。一些弹性纤维是碎片(图23.10)。注意到构成声带粘膜的胶原,网状和弹性纤维的质量和数量的变化。
术语“纤维长间隔胶原”已用于表示胶原纤维,其周期性和厚度明显大于普通胶原原纤维。在酸性粘多糖存在下,胶原分子在体外沉淀形成纤维状长间隔纤维。增加的胶原酶活性和胶原的网状纤维(由III型胶原组成)的存在对于体内纤维长间隔胶原的形成是必不可少的。在声带沟底部附近的固有层的浅层中观察到纤维状长间隔胶原。人声带的固有层中主要类型的胶原是网状纤维(III型胶原)。在声带沟的固有层中,胶原酶活性可能会在某个时间增加。
毛细血管在沟的底部周围的固有层的薄表层中是稀疏的。
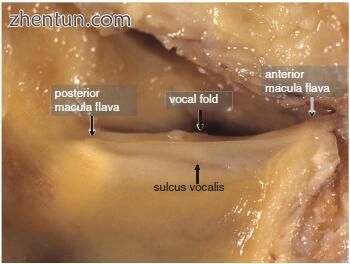
图. 23.4 左侧人声带沟(59岁男性)的肉眼可见结果
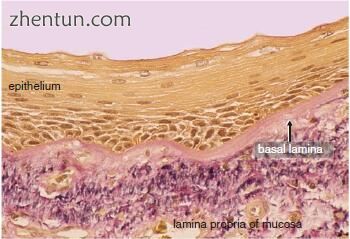
图. 23.5 上颌骨和基底膜区域围绕龈沟(Elastica van Gieson染色)。 基底膜区染成深红色,表明存在胶原纤维
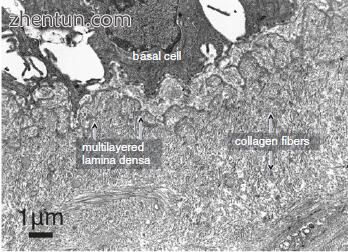
图. 23.6 在沟的底部周围的基底膜区域的透射电子显微照片(乙酸铀酰和柠檬酸铅染色)。 椎板密度变得多层,并且网状层中的胶原纤维增加
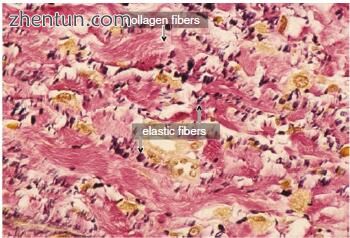
图. 23.7 在声带沟底部周围的固有层的浅层。 (Elastica van Gieson染色,原始×400)。 胶原纤维(染成红色)是密集的,弹性纤维(染成黑色)稀疏在固有层的薄层浅层周围的沟内
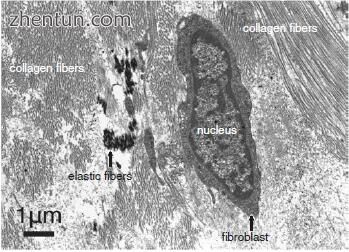
图. 23.8 透明带底部周围固有层浅层的透射电子显微照片(单宁酸染色)

图. 23.9 透明带固有层浅层纤维长间距胶原(箭头)的透射电子显微照片(单宁酸染色)

图. 23.10 透明带固有层浅层弹性纤维的透射电子显微照片(单宁酸染色)
在声带沟的固有层中有一些成纤维细胞(图23.8)。它们是纺锤形或椭圆形。细胞质占据细胞核周围的一小块区域。细胞质的成分,例如粗面内质网和高尔基体,很少。成纤维细胞合成少量胶原蛋白和弹性纤维并处于静止期。
声带沟的声音障碍是由不完全的声门闭合和声带粘膜的硬度显着增加引起的。增加的僵硬是由于在龈沟周围的声带粘膜的固有层的薄表层中细胞外基质的形态变化。
声带沟的原因尚不清楚。可能涉及组织老化,反复炎症和先天因素。越来越多的证据表明人体黄斑中的细胞是人类声带粘膜中的成体多能干细胞,组织干细胞或祖细胞。最新研究证实,人体黄斑中的细胞参与细胞外基质的代谢,这对于人类声带粘膜中的粘弹性是必不可少的,并且它们被认为是生长,发育和衰老中的重要细胞人声带粘膜。因此,人体黄斑中细胞的功能障碍可能是声带沟的原因之一。
23.5辐照声带折叠
在通过激光或其他辐射源照射后,声带组织的尺寸减小。
声音障碍是放射治疗后的并发症之一,它们是由辐射诱导的组织损伤引起的。 放射治疗可能是一把双刃剑,具有治愈肿瘤的能力,但也有可能引起纤维化,坏死,慢性水肿,萎缩甚至继发性癌。 尽管辐射具有有益的杀肿瘤作用,但每当使用足以杀死癌细胞的辐射剂量时,正常组织就会受到永久性影响。
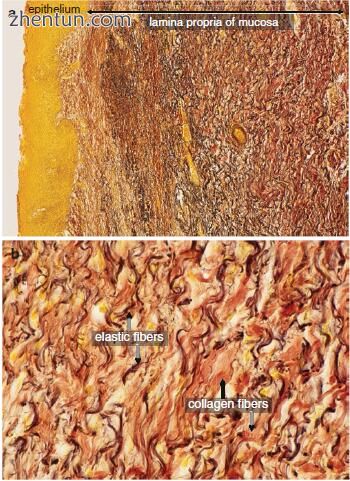
图. 23.11 放射治疗后5个月(66 Gy)照射的声带粘膜的固有层。 (a,原始×50; b,原始×200,Elastica van Gieson染色)。用Elastica van Gieson染色(b)染成红色的胶原纤维是致密的并且数量很多,并且用Elastica van Gieson染色(b)染成黑色的弹性纤维是稀疏的。声带粘膜的固有层变得单调
被照射的声带粘膜的固有层表现为均匀的结构(图23.11a)。胶原纤维是致密的,弹性纤维稀疏(图23.11b)。一些弹性纤维退化(图23.12)。网状纤维稀疏。声带粘膜中几乎没有透明质酸。甲状腺肌纤维之间的间质间隙变得纤维化(图23.13)。
电子显微镜显示胶原纤维的数量在受照射的声带粘膜的固有层中升高,弹性纤维和网状纤维稀疏(图23.14)。声带粘膜中的固有层中的成纤维细胞是纺锤形或椭圆形,没有细胞质过程,并且没有显示出形态变化。成纤维细胞核是椭圆形的。细胞核 - 细胞质比率大,粗糙的内质网和高尔基体显着不良。沿着成纤维细胞的表面,可以看到很少的囊泡。

图. 23.12 放射治疗后5个月(66 Gy)照射的声带粘膜的固有层。 (Elastica van Gieson染色)。 弹性纤维已退化

图. 23.13 放射治疗后5个月(66 Gy)(Elastica van Gieson染色)照射的声带粘膜的声带肌。 肌纤维之间的间隙空间是纤维化的
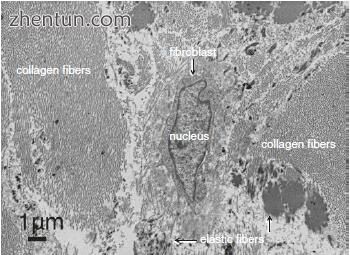
图. 23.14 射治疗后5个月(70 Gy)照射的声带粘膜固有层的透射电子显微照片(单宁酸染色)
放疗后的声音障碍是由辐射引起的组织损伤引起的,并且正常组织受到永久性影响。通常,这些变化是轻微的和自我限制的,但在一定比例的患者中,会发展为慢性水肿,纤维化,萎缩甚至坏死。辐射的影响是通过各种带电粒子通过细胞而在分子水平上产生破坏而产生的。在癌症剂量下的辐射在周围正常组织中产生可预测的变化。粘膜的后期变化包括粘膜下萎缩,血清粘液腺的扩张和萎缩,以及进行性纤维化。
被照射的声带粘膜的固有层表现为均匀的结构,其主要由增加的胶原纤维组成。在声带粘膜的固有层中几乎没有透明质酸。从这个观点来看,照射的声带粘膜的粘弹性不足以振动,并且它们的结构也不适合振动和发声。
辐射诱导胶原纤维,网状纤维,弹性纤维和糖胺聚糖的三维结构的变化。辐射也改变了它们的定性和定量特征,并对Reinke空间中细胞外基质的三维结构产生影响。因此,被照射的声带的组织(Reinke空间)中的粘弹性确实改变,并且这种变化解释了照射后的声音障碍的一个组成部分。
在一些情况下,在照射后长时间后,声带粘膜的固有层与显微声带粘膜在显微镜下是相同的光。在这些情况下,辐射诱导的组织损伤似乎有所改善。
23.6 声襞
老年人声带中声带粘膜固有层和声带肌大小减小。老年性声带萎缩主要与声带固有层(尤其是表层)的尺寸减小有关。
见第17章“人类声带粘膜中细胞和细胞外基质的老年变化。”
23.7喉部扩张手术(注射喉成形术)
通常进行喉成形的声学外科手术以改善患有声带萎缩的患者的喉功能不全。在喉部功能不全引起嗓音障碍和/或误吸的情况下,预期喉部肿瘤声学手术不仅可改善嗓音障碍,还可改善误吸。
注射喉成形术是治疗喉功能不全的方法之一。具有萎缩性的声带组织的部分在每种疾病中具有不同的声带萎缩。理解声带的组织结构和声带萎缩的组织病理学对于理解萎缩性声带治疗背后的概念是重要的。
在传统的注射喉成形术中,在声带的膜部分注射到甲状腺肌腱肌,以改善声带萎缩和声门功能不全(图23.15,23.16和23.17)。在声带的软骨部分(长圆形中央凹或杓状软骨的三角中央凹的侧面)注射到甲状腺肌肉中,产生内收性杓状固定(图23.18)。
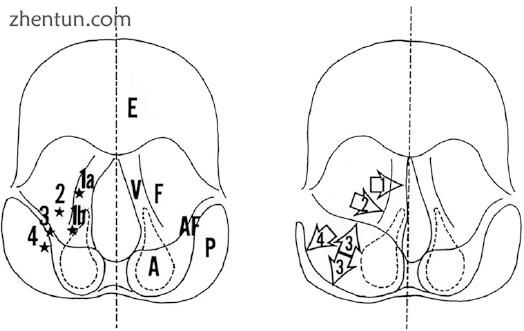
图. 23.15 用于注射喉部成形术的喉部注射部位。 E,会厌; V,声带; F,假声带(室襞); A,杓状; AF,杓会厌襞; P,下咽部的梨状窦。 星号1a:声带膜质部分的甲状腺肌肉。 星号1b:在声带的软骨部分(杓状软骨的长圆形中央凹的侧面)的甲状腺肌腱肌肉。 星号2:室襞(假声带)。 星号3:杓会厌襞。 星号4:下咽部梨状窦的内侧壁
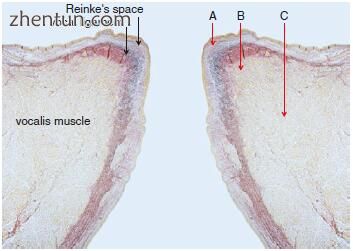
图. 23.16 注射位置的声带的膜部分。 A在Reinke空间。 B就在声带韧带下方。 C在甲状腺肌肉中
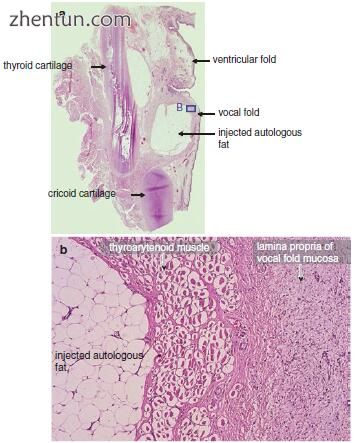
图. 23.17 (a)喉部冠状切除术后16个月喉返神经麻痹,喉部成形术(20岁女性,苏木精和伊红染色)。 (b)甲杓肌肌肉是萎缩的。 注射的自体脂肪被组织很好地耐受,并且不随时间再吸收(a区域B)
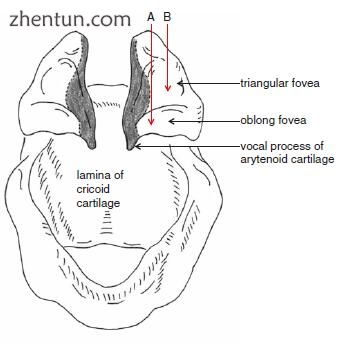
图. 23.18 声带的软骨部分的注射位置。在杓状软骨的长圆形中央侧面的甲状腺肌肉。 B 甲杓肌肌肉和软组织位于杓状软骨三角中央凹的侧面
甲状腺肌肉延伸至上区并在吞咽期间起到保护性括约肌的作用。对伴有声带瘫痪的喉部的全器官连续切片研究表明,心室褶皱和杓状肌中的甲状腺肌腱肌肉变得萎缩(图23.19),并且它们在创建保护性括约肌中的作用减少。在这些观察的基础上,进行室襞和杓状褶皱的注射以强制喉部闭合(图23.20和23.21)。注入下咽部梨状窦内侧壁会降低其容量;因此,保留在其中的残余食物量减少,患侧的咽间隙得到改善(图23.20和23.21)。
了解喉部的三维结构对于进行外科手术和将材料注射到适当的位置和适当的量以改善声音障碍和误吸是至关重要的。
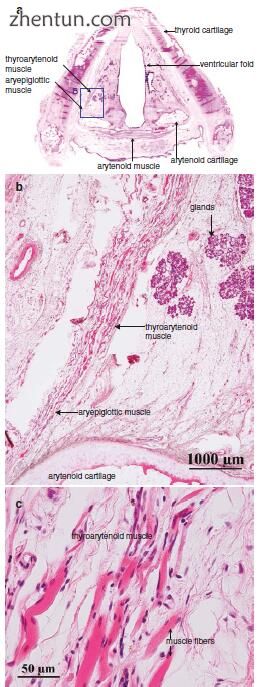
图. 23.19 (a)人喉部的横切面,在声门上层有双侧复发性喉神经麻痹(苏木精和伊红染色)。 (b)可以检测到甲状腺肌肉和杓状肌的大小减小(区域B为a,原始×12.5)。 (c)甲状腺肌肉的肌纤维变得萎缩和退化(原始×200)
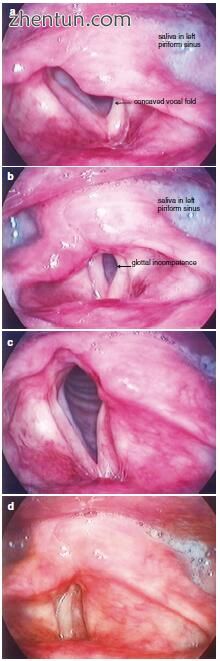
图. 23.20 喉部注射喉部成形术前后喉部的视图。 (a)手术前的呼吸; (b)手术前的发声; (c)手术后呼吸; (d)手术后的发声
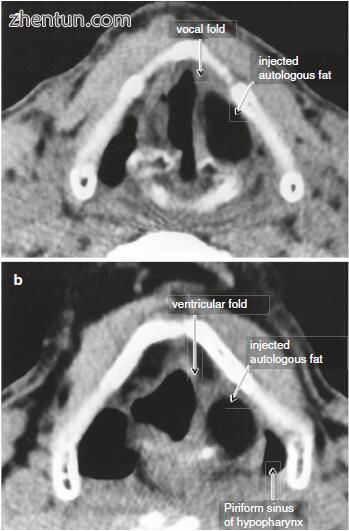
图. 23.21 自体脂肪注射喉成形术后的轴向计算机断层扫描。 (a)声门级别; (b)在上区水平
23.8喉部扩张手术用注射材料(注射喉成形术)
在Bruning于1911年首次使用硬石蜡引入注射喉成形术后,已经报道了许多关于注射方法,注射位置和注射材料的研究。关于注射材料,许多用于注射喉成形术的材料已经使用了几十年。
阿诺德报告了合适的心内注射材料的三项要求。首先,它们必须被组织良好耐受。其次,它们不能随着时间被吸收。第三,它们必须精细地分散在无害的载体中,以便通过长针注射。根据这些要求,最近,一些用于声带增强手术的注射材料已经可用。然而,Reinke空间增强手术很少有理想的注射材料,因为注射材料可以防止声带振动。

图. 23.22 收获的自体脂肪吸脂
有一些可注射的生物材料可用于声带增强手术。 最近,自体脂肪(图23.22)或筋膜已广泛用作注射材料。
自体脂肪注射喉成形术是在20世纪90年代早期引入的。 自体脂肪注射喉成形术的优点如下:外科手术可以在没有外部手术方法的情况下进行。 注射的材料被喉组织很好地耐受,因为它是自体脂肪抽吸脂肪。 注射位置和注射材料的量可以根据在显微镜下看到的喉部的病理状况进行修改。 外科手术在技术上是简单的,涉及最小的手术侵入,并且具有广泛的适用性。 患者的接受程度非常高,因为患者理解注射的材料是他们自己的组织而不是异物。

图. 23.23 通过19号长针后收获的脂肪抽吸脂肪的扫描电子显微照片。收获或显微注射方法不会损害自体脂肪
另一个优点是自体脂肪柔软且柔韧。它具有类似于声带粘膜的正常人固有层的粘性。脂肪细胞的细胞质和基底层在脂肪滴周围形成薄薄的薄膜,并通过细网状纤维的网状物投入(图23.23和23.24)。脂肪抽脂的这种形态特征是自体脂肪具有与人固有层相似的粘性的原因之一。
自体脂肪注射喉成形术的问题之一是注射的脂肪是否保持移植物体积。注射脂肪的命运仍然存在争议。它们周围的脂肪细胞和基质的大小,密度和增殖可能与再吸收和存活移植体积的减少有关。注射自体脂肪的增殖能力也可能在一定程度上与注射喉成形术后的移植物体积有关。
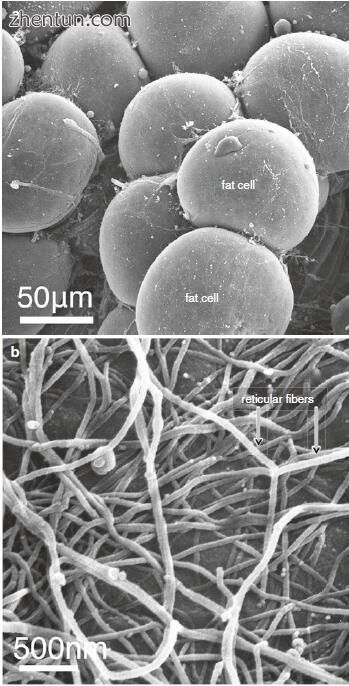
图. 23.24 收获的脂肪抽吸脂肪细胞的扫描电子显微照片。 (a)脂肪细胞。 (b)脂肪细胞周围的细网状纤维网状结构
参考
1.Rubin E, Farber JL. Cell injury. In: Rubin E, Farber JL, editors. Pathology. Philadelphia: Lippincott-Raven Publishers; 1999. p. 1–35.
2.Sato K. Histopathology of vocal fold atrophy. Jpn J Logop Phoniatr. 2002;43:432–7.
3.Hirano M. Phonosurgery. Basic and clinical investigations. Otologia (Fukuoka). 1975;21(Suppl 1):239–440.
4.Hirano M, Sato K. Histological color atlas of the human larynx. San Diego, CA: Singular Publishing Group Inc.; 1993.
5.Sato K, Sakaguchi S, Hirano M. Histologic investigation of bowing of the aged vocal folds. Larynx Jpn. 1996;8:11–4.
6.Sato K, Hirano M. Electron microscopic investigation of sulcus vocalis. Ann Otol Rhinol Laryngol. 1998;107:56–60.
7.Gross J. The behavior of collagen units as a model in morphogen-esis. J Biophys Biochem Cytol. 1956;2(4 Suppl):261–74.
8.Kajikawa K, Nakanishi I, Yamamura T. The effect of collagenase on the formation of fibrous long spacing collagen aggregates. Lab Investig. 1980;43:410–7.
9.Sato K. Reticular fibers in the vocal fold mucosa. Ann Otol Rhinol
Laryngol. 1998;107:1023–8.
10.Sato K, Umeno H, Nakashima T. Vocal fold stem cells and their niche in the human vocal fold. Ann Otol Rhinol Laryngol. 2012;121:798–803.
11.Kurita T, Sato K, Chitose S, Fukahori M, Sueyoshi S, Umeno H. Origin of vocal fold stellate cells in the human macula flava. Ann Otol Rhinol Laryngol. 2015;124:698–705.
12.Sato K, Chitose S, Kurita T, Umeno H. Microenvironment of mac-ula flava in the human vocal fold as a stem cell niche. J Laryngol Otol. 2016;130:656–61.
13.Sato K, Umeno H, Nakashima T. Functional histology of the mac-ula flava in the human vocal fold. Part 1: its role in the adult vocal fold. Folia Phoniatr Logop. 2010;62:178–84.
14.Sato K, Umeno H, Nakashima T. Functional histology of the macula flava in the human vocal fold. Part 2: its role in the growth and devel-opment of the vocal fold. Folia Phoniatr Logop. 2010;62:263–70.
15.Shumrick KA, Shumrick DA, Vietti MJ. Inflammatory diseases of the larynx. In: Fried MP, editor. The larynx. A multidisciplinary approach. 2nd ed. St. Louis, MO: Mosby; 1996. p. 283–306.
16.Sato K, Shirouzu H, Nakashima T. Irradiated macula flava in the human vocal fold mucosa. Am J Otolaryngol. 2008;29:312–8.
17.Laccourreye O, Paczona R, Ageel M, Hans S, Brasnu D, Crevier-- Buchman L. Intracordal autologous fat injection for aspiration after recurrent laryngeal nerve paralysis. Eur Arch Otorhinolaryngol. 1999;256:458–61.
18.Sato K, Umeno H, Nakashima T. Liposuctioned autologous fat injection into the larynx and hypopharynx with aspiration after vagal nerve paralysis. J Jpn Bronchoesophagol Soc. 2002;53:353–7.
19.Sato K, Umeno H, Nakashima T. Injection laryngoplasty according to the pathologic condition. J Otolaryngol Jpn. 2003;106:808–14.
20.Sato K, Umeno H, Nakashima T. Autologous fat injection laryngo-hypopharyngoplasty for aspiration after vocal fold paralysis. Ann Otol Rhinol Laryngol. 2004;113:87–92.
21.Bruning W. Uber eine neue behandlungsmethode der rekurrenslah-mung. Ver Deutsch Laryng. 1911;18:93–151.
22.Arnold GE. Vocal rehabilitation of paralytic dysphonia: VI, fur-ther studies of intracordal injection materials. Arch Otolaryngol. 1962;73:290–4.
23.Mikaelian D, Lowry LD, Sataloff RT. Lipoinjection for unilateral vocal cord paralysis. Laryngoscope. 1991;101:465–8.
24.Brandenburg JH, Kirkham W, Koschkee D. Vocal cord augmenta-tion with autologous fat. Laryngoscope. 1992;102:495–500.
25.Rihkanen H. Vocal fold augmentation by injection of autologous fascia. Laryngoscope. 1998;108:51–4.
26.Tsunoda K, Takanosawa M, Niimi S. Autologous transplantation of fascia into the vocal fold. A new phonosurgical technique for glottal incompetence. Laryngoscope. 1999;109:504–8.
27.Chan RW, Titze IR. Viscosities of injectable biomaterials in vocal fold augmentation surgery. Laryngoscope. 1998;108:725–31.
28.Sato K, Umeno H, Nakashima T. Histological investigation of liposuctioned fat for injection laryngoplasty. Am J Otolaryngol. 2005;26:219–25.
参考:Functional Histoanatomy of the Human Larynx.pdf |