15.1简介
胆管癌(GBC)最早由Maximillian de Stoll在1777年的两个尸检病例中描述。第一个记录的GBC切除术是由Keen在1891年进行的。传统上,晚期表现,有限的治疗选择,不良的预后和生存与这种致命的癌症有关。不到10%的患者在出现时患有限于GB壁的疾病。至少45%的患者有淋巴结受累,超过60%的患者表现出肝脏和/或邻近器官侵袭的局部进展,多达54%的患者存在转移性疾病。无症状的早期阶段,忽视由于疼痛与同一器官更常见的良性疾病(慢性胆囊炎)的相似性,胆囊壁缺乏浆膜层,缺乏医疗保健,特定人群胆囊切除术发生率低以及固有的侵袭性疾病的性质导致疾病的延迟表现。
手术是唯一的治疗选择。最近,在腹腔镜检查出现导致间接早期检测的手术技术,全身化疗和增加的胆囊切除率方面的改进已经改善了结果。
15.2流行病学
GBC是第六种最常见的胃肠道恶性肿瘤。它是最常见的胆道癌,约占所有胆道癌的80-95%[6]。这种恶性肿瘤的发病率在全球和种族之间差异很大。这是由于环境暴露,遗传易感性和风险因素的差异造成的,这些因素在地理上和种族群体之间有所不同。在亚洲检测到超过64%的GBC病例,其中三分之二的病例在发展中国家被发现。智利的年龄人口比例最高,为9.7 / 100,000人口,其次是玻利维亚和韩国(见图15.1,15.2,15.3和15.4)。
虽然与这些高发病率国家相比,印度每10万人口的发病率似乎很低,但由于人口众多,总体疾病负担仍然很高(图15.1)。 印度已经注意到该疾病发病率的显着区域差异。 基于人群的数据显示,印度北部城市(每10万名女性中有5-7名)胆囊癌的发病率非常高,而印度南部的胆囊癌发病率很低(每10万名女性中有0-0.7名)。 北部和东北部的印度妇女以及来自不丹,尼泊尔和巴基斯坦的妇女的胆囊癌发病率特别高。 这是一个活跃的研究领域,其中指出饮食习惯,遗传易感性和不良的医疗保健机会是可能的诱发因素。
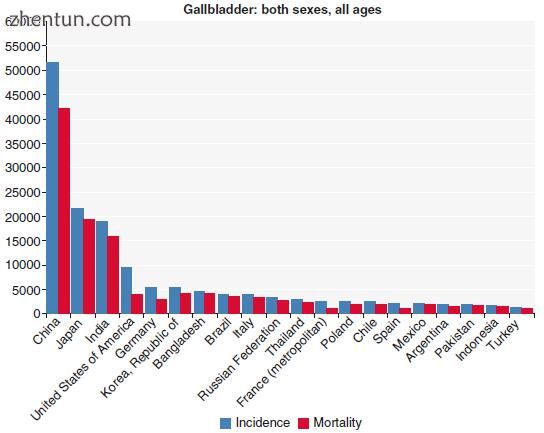
图15.1胆囊癌 - 年发病率和死亡率(转载自来源:Ferlay J,Soerjomataram I,Ervik M,Dikshit R,Eser S,Mathers C,Rebelo M,Parkin DM,Forman D,Bray,F。GLOBOCAN 2012 v1 .1,全球癌症发病率和死亡率:IARC CancerBase No. 11 [互联网]。法国里昂:国际癌症研究机构; 2014年。可从:
15.2.1年龄
发病率随着年龄的增长而逐渐增加,并且是60岁以上的最高值。 患者通常出现在生命的第六和第七十年。 然而,在生命的第二或第三个十年中发现女性患有这种疾病并不罕见。
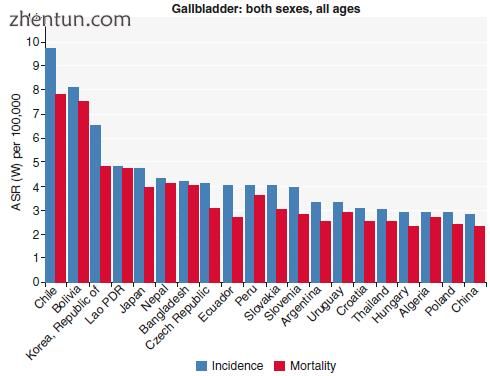
图15.2发病率和死亡率/ 100,000人口(转载自来源:Ferlay J,Soerjomataram I,Ervik M,Dikshit R,Eser S,Mathers C,Rebelo M,Parkin DM,Forman D,Bray,F。GLOBOCAN 2012 v1。 1,癌症发病率和死亡率:IARC CancerBase No. 11 [互联网]。法国里昂:国际癌症研究机构; 2014年。可从:
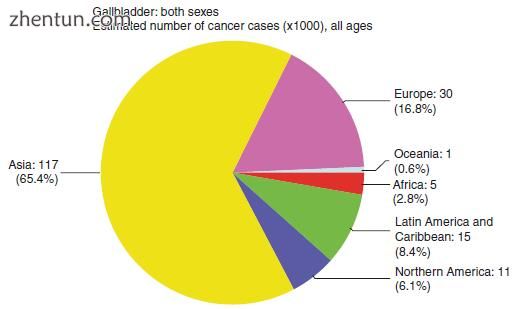
图15.3各大洲的疾病分布估计(转载自来源:Ferlay J,Soerjomataram I,Ervik M,Dikshit R,Eser S,Mathers C,Rebelo M,Parkin DM,Forman D,Bray,F。GLOBOCAN 2012 v1.1 ,全球癌症发病率和死亡率:IARC CancerBase No. 11 [互联网]。法国里昂:国际癌症研究机构; 2014年。可从:
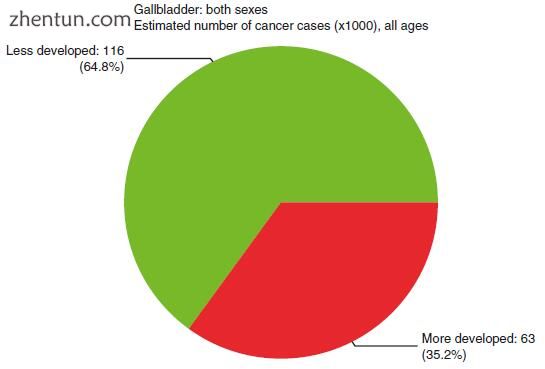
图15.4社会经济分布(转载自来源:Ferlay J,Soerjomataram I,Ervik M,Dikshit R,Eser S,Mathers C,Rebelo M,Parkin DM,Forman D,Bray,F。GLOBOCAN 2012 v1.1,全球癌症发病率和死亡率:IARC CancerBase No. 11 [互联网]。法国里昂:国际癌症研究机构; 2014年。可从:
15.2.2性别
GBC在女性中尤为常见;他们发展GBC的可能性大约是男性的三倍。这一比例在地理上有所不同,在巴基斯坦和哥伦比亚等国家,这一比例高达5:1。
15.2.3肥胖
目前,肥胖及其对各种癌症的易感性正在变得越来越重要,因为它在世界范围内流行病的比例越来越高。在最近的一项荟萃​​分析中,超重和肥胖分别与GBC的14%和56%的过度风险相关。发现肥胖(BMI(体重指数) - > 30)与GBC发展的相对风险(RR)1.54相关。女性的风险较高(RR-1.67)。超重(BMI 25-30)仅与女性的GBC风险相关。 GBC与肥胖的关联是任何癌症部位中最强的一种。
15.3发病机理
15.3.1发病机制
GBC的发展是慢性感染,炎症,环境暴露和遗传易感性综合作用的结果。证据强烈支持慢性,未解决的炎症作为GBC的主要致癌机制,无论最初的病因触发。
已经提出了类似于结肠直肠癌中的腺瘤 - 癌途径的多步骤癌变模型。最近,Barreto等人提出了“胆囊癌发生和传播模型”。考虑通过两种最常见的途径,即化生/增生和发育不良,以及胆囊内局部疾病超出胆囊上皮细胞,从正常上皮粘膜到癌症发展顺序发生的病理变化,包括癌症扩散到区域和远处器官。
胆囊上皮损伤和修复的复发周期导致慢性炎症环境,其通过化生 - 发育异常 - 癌症序列和基因组不稳定性促进进行性形态学损伤。细胞更新和氧化应激增加促进TP53的早期改变,细胞周期失调,细胞凋亡和复制衰老。 TP53的失活是超过50%的GBC中最常见和最早的突变。
虽然研究报道了GBC中雌性激素受体(ER / PR)的表达,但结果并不一致,并且它们在GBC中作为直接病因的作用尚未确定。
15.3.2病因学
15.3.2.1胆石症
许多研究中的流行病学证据支持胆结石作为GBC的病因,并且胆结石患者的GBC发病率更高。相反,研究还表明,在胆结石发病率高的国家,GBC的发病率相对较低。
尽管70-90%的GBC患者伴有胆结石,但胆结石患者低至0.3%可能会发生GBC。这种发病率非常低,不太可能成为主要的致病关系。在胆结石似乎对癌症具有致病作用的研究中,风险随着大小,体积,重量和结石数量的增加而增加。石头的持续时间或其成分的影响尚不清楚。最近一项来自韩国的大规模人口研究表明,肝胆癌的死亡率更高,特别是胆结石患者的GBC,不论其混杂因素如何。最后,此时的证据表明胆结石是胆囊癌的因果关系的辅助因子。它们作为GBC原因的作用的绝对证据是缺乏的。
考虑到与选择性腹腔镜胆囊切除术相关的低发病率,已经提出了预防性胆囊切除术的预防性胆囊切除术以减少GBC风险的重石负荷,大小> 3cm的石头,甚至高风险区域的女性中的无症状结石。考虑到胆结石患者的GBC发生率非常低,很难客观地评估这种方法的精算益处。在智利,筛查和治疗40岁以下无症状胆石症的妇女,表明预防性腹腔镜胆囊切除术可以显着有益于人群,并以非常低的增量成本降低GBC发病率。
15.3.2.2异常胰胆管结(APBDJ)
已知这种先天性异常易患胆道癌。 APBDJ患者在较年轻时发展为GBC,并且更常见地发展为有利于GBC的乳头状变体。建议采用预防性胆囊切除术以避免GBC的风险。
15.3.2.3感染和炎症
已知胆囊的慢性感染和胆囊 - 肠瘘等炎症性疾病会增加GBC的风险。感染可直接或通过胆结石形成促进GBC的发展。经常涉及伤寒沙门氏菌,副伤寒沙门氏菌和螺杆菌属的慢性携带状态。非伤寒沙门氏菌最近也被证明具有致病作用。在癌症流行国家,旨在治疗伤寒和非伤寒沙门氏菌的努力可以减少这些物种的慢性携带状态,这可能有助于致癌过程中的炎症刺激。这种策略可能有助于降低GBC的发病率。华支睾吸虫病与胆管癌相关。它还会导致胆石症和胆囊炎,也可能与GBC有关。感染和炎症状况通过前面描述的机制导致慢性炎症状态和GBC。
15.3.2.4瓷胆囊
胆囊壁瓷胆的钙化与GBC有关。过去风险估计约为10%。 Towfigh等。回顾了1955年至1998年间接受胆囊切除术的10,741例患者的记录和病理幻灯片。瓷胆的发病率为15例(0.14%)。所有标本均显示慢性胆囊炎和胆囊壁部分钙化。没有患者患有胆囊癌。在同一时期,88名(0.82%)患者患有胆囊癌,其中没有一名患者出现钙化。瓷胆患者未发现癌,胆囊癌患者均未钙化胆囊。他们得出结论,瓷器胆囊与GBC风险无关。
同样Khan等人。回顾了七个已发表的系列文章,其中包括60,665例胆囊切除术。瓷胆的总发病率为0.2%,GBC发生在15%的胆囊病例中。大多数这些病例都是在旧文献中报道的。
现在可以理解,过去曾过高估计GBC患有胆囊的风险。点状和不完全钙化可能具有发展GBC的小风险,并且弥漫性钙化与GBC的风险无关。
虽然可以辩论在这种临床情况下用于降低GBC风险的预防性胆囊切除术,但通常认为它可作为胆囊切除术的适应症,伴有或不伴有相关症状或胆结石。
15.3.2.5其他
吸烟与GBC风险增加有关,而且关联似乎与剂量有关。
酒精消费,口服避孕药,职业接触橡胶,甲基多巴,黄曲霉毒素(智利),莱油(北印度)和土壤和水中的高矿物质水平是一些其他提出的风险因素,有不同的支持证据。
15.4病理学和传播方式
15.4.1病理学和组织学
已显示GBC具有腺瘤成分。类似地,已知具有大腺瘤性息肉的患者存在原位癌或腺癌的侵袭性焦点,明确地确定GBC中存在腺瘤 - 癌序列。已知与息肉相关的风险随孤立息肉,大小和年龄而增加。
在Kozuka等人的一项研究中,早在1982年,19%的侵袭性GBCs具有腺瘤成分,并且所有侵入性肿瘤都发生在大于12mm的息肉中。良性腺瘤的平均患者年龄为50.5岁,恶性变化的腺瘤为58.3岁,侵袭性癌为64.8岁。有人建议考虑患有腺瘤,原位癌和浸润性癌的患者的平均年龄,平均癌症进展平均需要15年,中间阶段需要可变时间。肿瘤原位进展的腺瘤应该在5年内发生,原位癌侵袭发生在十年以上。
60%的肿瘤位于胆囊底部,30%位于体内,10%位于胆囊管内。位于胆囊非腹膜侧(即胆囊窝,肝床)的肿瘤在病程早期渗入肝脏。这些肿瘤也可能存在残留的疾病,并且在偶然的GBC中再次切除比在位于胆囊的周围侧的那些肿瘤更有益。
大肿瘤呈灰白色。大肿瘤通常取代胆囊窝,形成肝脏浸润的大块肿块;有时胆囊可能会因肿瘤而扩张,甚至因颈部和身体阻塞而收缩或变形。
超过95%的恶性胆囊肿瘤是癌。大多数胆囊癌是腺癌。在Duffy等人的一项研究中,肿瘤的组织学分布为88%的腺癌,4%的鳞状细胞,3%的神经内分泌和2%的肉瘤。
胆囊乳头状癌应该特别提及与它们相关的有利预后以及它们在不侵入的情况下生长到大尺寸的能力。这可归因于它们的外生生长,延迟侵入胆囊壁以及可能是早期阻塞性症状。然而,侵袭性和淋巴结阳性乳头状肿瘤的预后几乎与其他侵入性GBC相似,因此乳头状肿瘤中的侵入性和非侵入性肿瘤之间的区别也是必要的。
15.4.2传播模式
GBC通过以下途径传播,即:
1.淋巴
2.血源性
3.腹膜内
4.通过胆囊管扩散(导管内)
5.涉及邻近器官的直接解剖扩散
淋巴扩散是最常见和最重要的传播方式。肝十二指肠韧带中的囊性,外胚层的和门静脉淋巴结是排出GB的原发淋巴结。肿瘤通常沿着胰后壁、腹腔和肠系膜途径扩散。这些淋巴结组最终排入左肾静脉下方的交叉 - 窝腔淋巴结。淋巴结扩散到椎体间区域和腹腔和肠系膜上动脉(N2淋巴结)预示着预后不良并具有转移(M1)状态。
通过静脉途径传播是通过胆囊静脉。它们直接排入门静脉的肝内分支,随后进入中肝静脉和右肝静脉。这种静脉扩散形成了切除中肝段(4b和5)的基础,作为根治性胆囊切除术的一部分。
腹膜内扩散是常见的,通常涉及邻近的器官,如肝脏,CBD,结肠,十二指肠,胰腺,网膜和胃。
沿着管腔和导管壁的导管内扩散是罕见的,并且通常见于乳头型GBC中。
15.5临床表现
GBC患者通常出现在老年和晚期。介绍可能是偶然的,这被定义为对明显良性胆结石疾病进行简单胆囊切除术后的组织病理学意外。在0.3-1.87%胆囊切除术后偶然检测到。虽然不同系列的发病率差异很大,但在印度约为1%。随着更多患者可能患有早期疾病,偶然检测增加了治疗意图治疗的机会。这足以强烈建议外科医生在每次胆囊切除术后打开胆囊标本并执行任何可疑病变的冷冻切片,至少在高流行区域。
偶然胆囊癌对整个系列的贡献因研究所而异,从10%到93%不等。在回顾性分析了在Sloan Kettering癌症中心(MSKCC)治疗10年期间治疗的435例GBC患者中,47%的病例是偶然的GBCs。但更常见的是,它在超声波上表现为可疑或明显的胆囊肿块或息肉。患者通常抱怨上消化道(UGI)症状,如消化不良,持续的右上腹疼痛,食欲不振和体重减轻。
可触及的腹部肿块和黄疸是晚期疾病的征兆。尤其是黄疸被认为是不祥的征兆。在Hawkins等人的一项研究中。 82例GBC患者中有82例(34%)出现黄疸。黄疸患者(96%)比非黄疸患者(60%)更可能患有晚期疾病。仅有6例(7%)黄疸患者切除了治愈意图,只有4例(5%)手术切缘阴性。黄疸患者的疾病特异性存活中位数为6个月,与无黄疸患者的16个月相比显着降低。在出现黄疸的组中,2年时没有无病幸存者,而没有黄疸的组中没有21%。较早的研究认为黄疸的存在是手术探查的禁忌症。然而,最近的报告显示出令人鼓舞的结果,特别是对于完全切除的患者和与没有黄疸的患者相当的手术结果。
胆囊癌患者的黄疸是晚期疾病的指标; 然而,这不是手术的禁忌症。 适当的患者选择治疗意图治疗有助于最佳治疗结果,但阻塞性黄疸患者的发病率可能略高。 新辅助治疗结果也可能有助于更好的患者选择。
15.6调查(表15.1)
15.6.1超声检查(USG)
超声检查(USG)是任何患有右上腹疼痛的患者的常规一线调查。 它首先引起怀疑并促使进一步评估疾病过程。 腔内肿块,胆囊置换或侵入性肿块和粘膜回声的不连续性是GBC患者中检测到的一些重要的超声征象,而不是非恶性病变。 GBC患者也更容易患有孤立的,大型的胆结石和移位的结石。
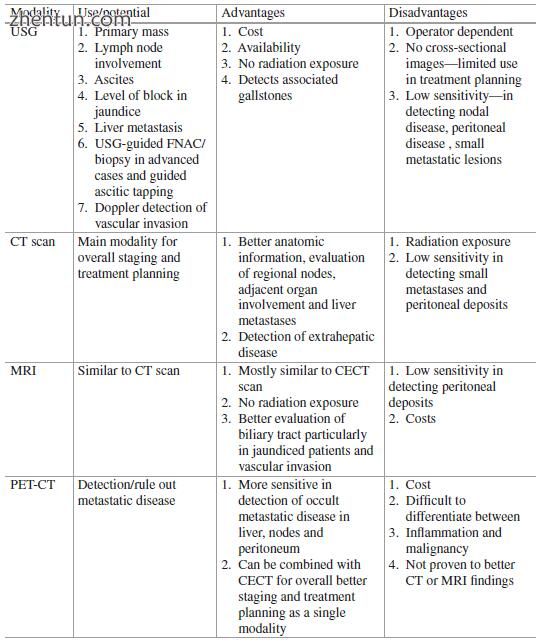
表15.1各种放射学调查方式的潜在用途,优缺点
可以很容易地检测到明显的转移和腹水。 USG在检测淋巴结淋巴结病或腹膜疾病方面的能力有限,未能提供有关治疗计划的任何确切信息。
15.6.2计算机断层扫描(CT)扫描
横断面成像尤其是三相对比增强CT(CECT)扫描是GBC分期和术前计划的重要部分。
CECT可能表现出胆囊窝中的低衰减或等衰减质量以及肝脏的软组织侵袭。肿块可能包含坏死的低衰减区域。肝门水平和淋巴结转移的胆道梗阻是常见的相关发现。可以可靠地证实肝和肺的转移。它对于检测腹腔中甚至少量的自由流体也具有非常好的灵敏度。可以检测到局部疾病程度,淋巴结受累,远处转移,邻近器官和血管受累,敏感性和特异性超过80%。
螺旋CT在诊断GBC的局部范围方面提供了83-86%的准确性,显示出对T2和更高级病变的相当可接受的敏感性和特异性,但对T1病变的敏感性较差。由于节点尺寸大于1厘米且具有环状异质增强,已经报道了N阶段评估的准确率大于80%。假阴性检查结果可能是肿瘤涉及的小尺寸节点的问题。
15.6.3磁共振成像(MRI)
用于评估GBC的MRI分析显示肝脏侵袭的敏感性为70-100%,淋巴结转移的敏感性为60-75%。 “一体化”MR协议,包括MRI,MRCP(磁共振胰胆管造影)和MRA(磁共振血管造影),可以成为胆囊癌术前检查的有效诊断方法。 MRCP和MRA MRI可以对大多数患者进行一站式完整评估,并具有胆道和血管评估的额外优势。 MRI在评估GBC时的总体功效通常等于CT扫描。与CT扫描相比,主要受限于相对较少的可用性,外科医生对MRI解释不熟悉以及对CT扫描的熟悉程度过高(见图15.5)。
15.6.4 PET(正电子发射断层扫描)扫描的作用
大多数GBC是FDG([18 F] -2-脱氧-D-葡萄糖)avid。 因此PET扫描或特别是PET-CT在评估中起作用(图15.6)。 PET-CT已被用于检测转移性疾病,包括腹外转移(肺,纵隔和骨)以及腹腔内转移(腹膜和端口部位)。 最近的一项荟萃分析显示,FDG-PET或PET-CT在评估GBC患者原发肿瘤时具有良好的敏感性(87%)和特异性(78%)。 PET-CT显示出比单独PET更好的诊断准确性。
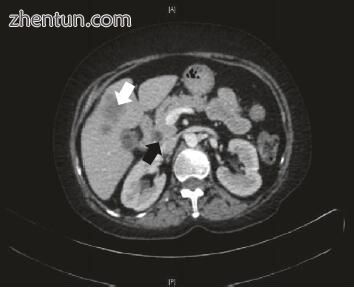
图15.5多检测器计算机断层扫描轴向后对比图像显示胆囊癌伴肝脏浸润(粗箭头)和突出的胆总管(细箭头)
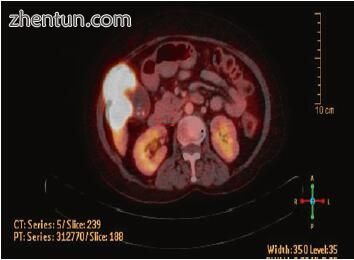
图15.6图15.5中患者的正电子发射断层扫描 - 计算机断层扫描(PET-CT)图像显示胆囊肿块中的FDG摄取
在使用这种方式时,应始终考虑可能的假阳性结果来源(例如胆囊的炎性疾病,例如黄色肉芽肿性胆囊炎)和假阴性结果(例如小尺寸和/或低度恶性肿瘤)。如果在偶然GBC患者的再分期中立即/早期胆囊切除术期间使用PET并且在评估患有局部晚期GBC并且由于这些患者中的可变摄取而具有阻塞性黄疸的患者时,假阳性的风险很高。
执行PET扫描的决定需要考虑其对CECT或MRI等初始模式已经提供的信息的额外贡献,例如在远处检测疾病的可能性。
我们中心的一项研究和Butte等人的类似研究。来自智利提出使用PET-CT在偶然性GBC患者的再分期中使用。
塔塔纪念中心的另一项研究考察了PET-CT在指导GBC治疗策略中的可能作用。我们发现PET-CT阴性的T1b患者肝脏中没有任何残留疾病,并且在重新切除时PET阴性偶然GBC T1b患者实际上可以跳过肝楔形切除。
鉴于每种方式的固有局限性,选择性使用可能会提高产量和效益。 PET-CT的益处可能在患有小息肉原发病灶的患者中有限,患者在CECT扫描中没有显着的淋巴 - 腺病变,或者具有偶然的GBC且在横断面成像中没有残留疾病的证据。类似地,在患有肝脏浸润的大的原发病灶和偶然检测到的肿瘤,大的门静脉周围淋巴结,呈现阻塞性黄疸,可疑的主动脉结节或高CA19-9(碳水化合物抗原)的患有残留疾病的患者中,可能更频繁地检测到其他病变。 19-9)水平(见图15.6)。
15.6.5介入放射学
介入放射学在这些患者的管理中起着重要作用。大多数不能手术和转移的患者在开始任何全身化疗之前需要进行组织学诊断,并且许多患者需要缓解黄疸,无论是作为姑息治疗还是作为术前准备,以防止门周阻滞。通常进行USG或CT引导的病变/转移淋巴结活检,经皮胆管引流和支架置入术。在少数晚期疾病患者中,有时可能需要栓塞出血性肿瘤作为姑息措施。
15.6.6肿瘤标志物
血清CA19-9和癌胚抗原(CEA)通常用于评估疑似胆囊肿块或GBC患者的各个管理阶段。其他标志物,即CA 125和CA 242,在临床实践中不常用。
CA 19-9和CEA作为肿瘤标志物提供关于预后,总体存活和对化学疗法的反应以及术后复发的预测。这些标记物的敏感性和特异性约为70%,并且很明显它们具有有限的诊断价值。
在酗酒者,肝功能障碍者,吸烟者和炎症性疾病中观察到CEA水平增加。 CA 19-9在几种良性疾病中也有非特异性上升。在Lewis-阴性基因型中观察到假阴性,并且在黄疸患者中观察到假阳性结果增加。这限制了这些标记物的使用。它们主要用作基线支持性评估,后续用于治疗后患者。
用于GBC的塔塔纪念医院评分系统(TMHSS)基于放射学,临床和生物化学特征,已于2004年提出并随后得到验证。虽然不常用,但它预测可切除性并在GBC中提供预后。评分系统包括血清CA 19-9水平,血清胆红素和疾病的CT扫描特征。
15.7胆囊癌分期
GBC的分期基于渗透深度和扩散程度。 1976年,Nevin等人。描述了一种结合阶段和组织学分级的方法(表15.2)。自从美国癌症联合委员会(AJCC)TNM(肿瘤,淋巴结,转移)分期在今天被广泛使用和接受以来,Nevin的分期现在只具有历史意义(表15.3)。最重要的预后因素是入侵深度。随着穿透深度的增加,淋巴结和远处转移的发生率逐渐增加。 Fong等。据报道,当肿瘤从T2发展到T4时,远处和淋巴结转移逐渐增加,分别从16%增加到79%,从33%增加到69%。
在最近几个版本的AJCC TNM分期系统中,GBC分期已发生变化和演变。在2002年发表的AJCC第六版中,T1阶段被细分为T1a,用于侵入固有层的肿瘤,T1b用于肿瘤达到肌层。这种划分对于早期和偶然检测到的GBC患者的临床决策具有重要意义。第六版还试图否定与GBC相关的虚无主义,并将节点阳性(T1-3 / N1)患者降至IIb期。这些患者之前被置于III期。它还将区域节点(N1)定义为在肝门,胃肝韧带和十二指肠空间中发现的节点。这些区域外的阳性节点被认为是M1疾病。
AJCC第七版(2010年)在分类方案中包括胆囊管,此版本中未包括类癌和肉瘤。考虑到与淋巴结阳性相关的低预后,该版本将节点阳性患者替换为IIIB期,并且需要将它们与淋巴结阴性的II期患者分开。它还将围周的,主动脉周的,肠系膜上动脉和/或腹腔动脉节点定义为N2节点。 N2类疾病及其相关的惨淡预后被置于IVB期,并被指定为M1状态。
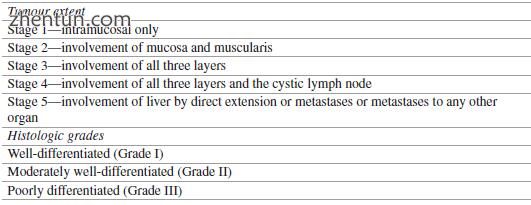
表15.2 Nevin的分期系统

表15.3胆囊癌分期-AJCC第八版(2017年)(经美国伊利诺伊州芝加哥市美国癌症联合委员会(AJCC)许可使用。该信息的原始和主要来源是AJCC癌症分期手册,第8版(2017年) )由斯普林格国际出版社出版。)
阶段分组与当前分期中的手术可切除性和患者结果更好地相关。该疾病明显可以持续到III期(T1-3 / N0-1),任何表明IV期疾病(T4 / N2 / M1)的术前评估都定义了不可操作性。
最近发表的第八版AJCC TNM分期进一步将T2疾病细分为a和b期,这取决于GB壁受累的肝脏或内脏侧,因为它们具有不同的预后。类似地,N阶段现在包括所涉及的节点数量,并且将N2重新定义为四个或更多节点的区域节点参与,这也与预后更好地相关。
15.8术前活检的作用
像GBC这样的侵袭性恶性肿瘤易于传播。 GBCs种子和在端口站点,手术疤痕,胆管镜检查和针管中复发。针道播种和传播是一个真正的风险。在明显可切除的放射学疑似GBC中,强烈建议不要进行术前活检。当临床放射学怀疑很高时,术前细针穿刺细胞学(FNAC)/活组织检查无法帮助/影响可切除病变的决策。由于可能出现假阴性结果,此设置中的否定结果会增加混淆。 GBC患者活检的唯一可能适应症是局部晚期肿瘤,计划用于新辅助治疗的全身治疗。活检以排除或证明疑似或明显的转移性病变将构成另一种适应症。
15.9管理
15.9.1胆囊息肉的处理
胆囊中可发生多种息肉样病变,从纤维瘤和脂肪瘤到血管瘤(表15.4)。 更常见的是,胆囊息肉可以是胆固醇息肉,炎性息肉,增生性息肉,混合型息肉或腺瘤,按发生频率的顺序排列(表15.5)。 腺瘤性息肉具有恶性潜能,并且在检测本身时可能具有非典型增生和/或恶性肿瘤。
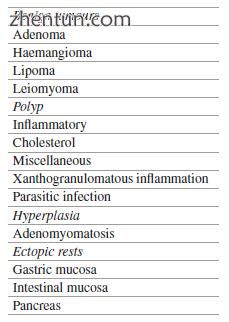
表15.4良性肿瘤胆囊息肉的分类
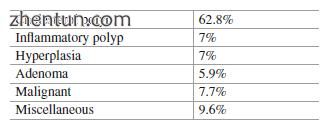
表15.5 172例病例中胆囊息肉样病变的类型
腺肌瘤病是一种获得性的胆囊增生性病变,其特征是表面上皮细胞过度增生,内陷为增厚的固有肌层。 USG可能会发现伴有壁内憩室的增厚的胆囊壁。该病症通常不被认为与恶性潜能相关。
大多数胆囊息肉很容易在美国偶然发现,同时评估非特异性腹部疾病或特别是在评估患有上腹部疼痛的患者时。
胆囊息肉中恶性肿瘤的风险因研究而异。最近一项评估美国检测到的胆囊息肉中恶性肿瘤风险的大型综述包括12项研究和超过5000名胆囊息肉患者。胆囊息肉中恶性肿瘤的总发生率约为0.6%。据报道,腺瘤中恶性肿瘤的发病率约为7%。小于6毫米的腺瘤很少患有侵袭性癌症。腺瘤中恶性肿瘤的风险随着大小而增加。恶性GBP的确定风险因素是大于10毫米(风险随大小增加),随访期间息肉的增长,单息息和印度种族背景。其他假定和重要的危险因素是年龄超过60岁,患有胆结石的息肉,相关的原发性硬化性胆管炎,有症状患者的息肉和伴有胆囊壁增厚的息肉。建议这些患者进行胆囊切除术。
任何怀疑患有恶性肿瘤的大息肉患者都应接受CECT或MRI等横断面研究,以正确评估病变和手术计划。
可以观察到小息肉小于6mm并且没有上述相关危险因素的患者。通常建议大于6 mm的息肉进行6个月的随访扫描,并且尺寸的增加是手术的指征。如果息肉在2年内保持稳定,可以终止随访。
管理GB息肉的另一个重要考虑因素是胆囊切除术,因为GBC患者在胆囊切除术中胆汁溢出可能具有潜在的危险性。通常,每当术前评估指出可能存在恶性肿瘤风险时,外科医生一直采用开放式方法进行胆囊切除术。当息肉大小(> 10 mm)时,一些外科医生选择性地使用开放手术,或者美国或CECT评估认为恶性肿瘤风险较高。如前所述,胆囊息肉样病变的恶性肿瘤总体风险约为0.6%。因此,恰好在患有癌症的患者中发生的巧合胆汁溢出的可能性也非常低。这不应该不必要地阻止所有患者受益于腹腔镜方法的优点。对于胆囊癌常规进行腹腔镜胆囊切除术的外科医生来说,这一争议最近变得更加多余。
在对患者进行胆囊切除术以确定恶性肿瘤的可能性之前,需要对患者进行咨询。手术期间冰冻切片的可用性至关重要。如果检测到侵袭性癌症,它可以促进根治性切除。
15.9.2顺便检测GBC的方法
在假定良性病症的1%选择性胆囊切除术后,检测到偶然的GBC。如果发现任何可疑病变,建议打开所有胆囊切除标本并送去进行冷冻切片分析。术中检测到的GBC如果不是术前疑似,也可归类为偶然性GBC。通常将偶然GBC定义为纯粹的组织病理学惊喜应该是罕见的。实际上在印度由于无法获得冰冻切片,外科医生缺乏认识以及普通人群的疾病发病率总体较低(印度北部除外),偶然的GBC作为纯粹的组织学意外仍然是最常见的表现。虽然偶然检测到的GBC更可能是早期肿瘤,但患者可能患有属于任何病理性T,N或M期的疾病,并且可能不一定是早期疾病。大多数偶然的GBC患者都有pT2 / pT3原发性。在Pawlik等人的一项研究中。对于切除患者的病理分析,T分期T1为7.8%,T2为67.0%,T3为25.2%。残留疾病的发病率随着疾病的pT阶段而增加。再次切除标本的病理学指出46.4%的患者残留/额外疾病。在那些分别为T1,T2和T3的患者中,0,10.4和36.4%分别在肝脏内具有残留疾病(P = 0.01)。 T分期还与局部淋巴结转移的风险相关(淋巴结转移:T1 12.5%; T2 31.3%; T3 45.5%; P = 0.04)。残留疾病的存在与T分期相关,并且已经发现在治愈性切除术治疗的患者中存活的最相关的预后因素。偶然性GBC的重新切除提供了治愈的唯一机会,但其疗效取决于重复手术中发现的疾病程度。在Butte等人的一项研究中,残留病在肝脏中占主导地位(29%),与T分期密切相关,并且是治疗性切除术患者生存中最相关的预后因素。
重新评估组织学标本是重新分期的重要组成部分,特别是pT分期,边缘和胆囊管残端的评估,如果可能的话,肿瘤和囊性淋巴结受累。这些发现影响了进一步的临床决策。
回顾USG的主要报告,与之前的外科医生讨论特定的术中发现,胆汁溢出等不能再强调。
需要完成局部和转移性检查,包括CECT和偶尔PET-CT。 PET-CT在该临床情况中的作用尚未确定。虽然不是常规且尚未推荐,但它经常用于评估这些患者。
在术中发现GBC的情况下,如果没有在胆囊切除术时进行根治性切除的专业知识,那么在专科中心进行选择性根治性再切除术后的原发性胆囊切除术已被证明是可接受的方法。
完成分期检查后,排除转移性疾病并评估疾病是可切除的,应该计划根治性切除。一般认为,简单的胆囊切除术是T1a肿瘤的适当治疗方法。这种粘膜疾病到达固有层,实际上从未与淋巴结受累有关。在这种情况下,如果没有残留疾病的可能性,重新切除既不合理也不必要。
对于偶然发现胆囊切除术标本的T1b癌症患者,根治性手术的效用仍存在争议。目前推荐并通常进行再切除术。
在Abramson等人的一项研究中,创建了一个决策分析马尔可夫模型来估计和比较与偶然发现的T1b胆囊癌患者的简单胆囊切除术或根治性切除相关的预期寿命。在基础病例分析中,根本没有进一步手术切除,根治性切除是有利的。它为接受根治性切除术的患者提供了3。43年的生存获益。年龄较小的患者有更多的益处,随着患者年龄的增长逐渐减少。决策分析表明,根治性切除与大多数T1b胆囊癌患者的生存率增加有关。总体而言,共有18项研究(包括157名患者)和7项研究(包括40名患者)分别用于计算单纯和根治性胆囊切除术组的基线概率。对于单纯的胆囊切除术组,他们计算出加权平均5年癌症特异性生存率为61.3%。对于那些接受根治性切除的患者,平均5年生存率为87.5%。
对于T2和T3,GBC根治性再切除显然是必要的。在这种情况下,简单的胆囊切除术不能是肿瘤手术。大量患者可能有残留病变和淋巴结转移,根治性再切除是这组患者实现R0切除和长期生存的唯一途径。
R0切除,淋巴结清扫,分化良好的肿瘤和无神经和血管侵犯是总体生存的重要预后因素。
对于在重新评估中发现患有T4疾病的患者,应探索姑息治疗方法。
15.9.3胆囊癌的外科治疗原则
GBC管理的手术选择从简单的胆囊切除术到扩展的多脏器切除术,如肝胰十二指肠切除术(HPD)。在没有有效的辅助治疗的情况下,R0切除是治愈和长期存活的唯一机会。
根治性胆囊切除术,GBC的肿瘤切除术通常包括:
1.腹腔镜分期/剖腹探查术以排除转移性疾病。
2.腔内淋巴结取样以排除具有M1状态的N2淋巴结受累。
3.采用某种形式的肝切除术整块切除GB肿块。肝切除的程度通常是实现边缘阴性切除所需的最小量,并且可能从肿瘤外的2/3 cm楔形肝脏组织变化到达到负边缘(图15.7),正式的IVB部分, V切除或扩大肝切除术。
4.完成肝十二指肠韧带,门静脉和十二指肠淋巴结切除术(图15.8)。
5.如果涉及相邻器官和/或肝外胆道切除术。
命名方式因可能被视为激进而有所不同。根据肿瘤的位置和阶段,切除范围从早期T1a肿瘤的简单胆囊切除术到延长的肝切除术和少数晚期肿瘤的多脏囊切除术。术语“扩展胆囊切除术”用于描述某些中心对GBC的肿瘤切除术,其中“扩展”一词提供了包含各种程序的范围。偶然GBC的根治性再切除术被称为我们研究所的胆囊切除术。偶然GBC的修复手术也称为完成扩展胆囊切除术。
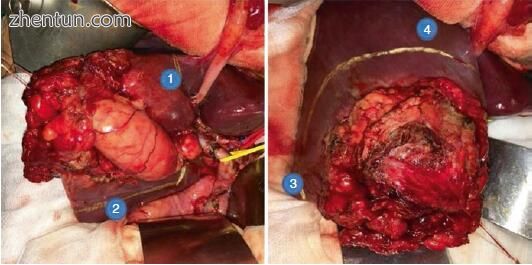
图15.7图15.5中患者的术中照片,描绘了肝脏表面标记的楔形切除边缘(编号1-4)
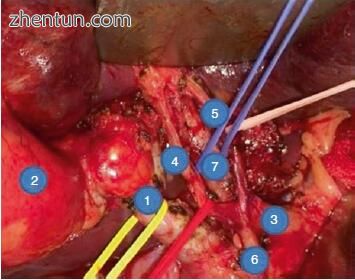
图15.8术中照片显示完整的门静脉淋巴结切除术(1,胆总管; 2,胆囊; 3,肝总动脉; 4,右肝动脉; 5,左肝动脉; 6,胃十二指肠动脉; 7,门静脉)
15.9.3.1分期腹腔镜检查的作用
分期腹腔镜检查旨在检测腹膜和肝脏表面转移,是评估胃肠道恶性肿瘤的重要工具。它可以防止非治疗性剖腹手术并降低相关的发病率。减轻疼痛,早期康复,减少住院时间和早期服用全身治疗是相关的益处。
显着比例的GBC患者在出现时患有晚期疾病。局部晚期不能手术和转移的胆囊癌患者通常不需要任何姑息性手术。可接受的产量总是证明在这种侵袭性恶性肿瘤中常规使用这种方法是合理的。
评估分期腹腔镜检查在GBC中的作用的研究已经报道了在38-62%的患者中预防非手术手术探查的益处。最近的一项荟萃​​分析显示,27.6%的GBC患者可以通过分期腹腔镜检查避免不必要的剖腹手术。
在最近一个来自北印度中心的409名患者的大型系列中,分期腹腔镜检查发现94.1%的可检测(表面)转移性病变,从而避免了55.9%无法切除的患者的非治疗性剖腹手术;这占GBC患者总数的23.2%。它在局部晚期肿瘤中具有更高的产量。一些外科医生认为,增加腹腔镜超声和腹腔镜子宫腔内淋巴结活检有可能进一步提高GBC分期腹腔镜检查的产量。
建议在所有GBC切除术中常规进行分期腹腔镜检查,包括偶然GBC患者的修复手术。
15.9.3.2肝切除范围
GBC手术的基本原则是R0切除术,最小肝切除术。肝切除的程度取决于原发肿瘤的肝脏浸润程度,流入血管结构的参与以及1-2cm阴性边缘的需要。对于有明显肝脏浸润或无明显肝脏浸润的许多患者,以及在偶然检测到GBC后进行翻修手术的患者,在评估或探查时没有残留疾病或微小残留病的证据,简单的2-3 cm楔形到阴性边缘可能是足够的。在这种方法中,保持统一的边际可能很困难,导致地方的边缘锥形和边缘受损。这也是非解剖切除术可能有更高的胆漏和出血机会。必须特别注意在过度切除大楔形物的同时实现均匀的边缘并防止对肺门结构的伤害。一些外科医生首选正式IVB / V切除术治疗肝脏浸润受限或无肝脏疾病。虽然这种方法具有解剖切除的优点,但对于许多外科医生而言,这可能是一种具有潜在挑战性的切除术。
胆囊癌导致继发于胆道浸润的黄疸阻滞和黄疸,同侧主要流入结构受累和超出IVB / V段切除范围的肝脏浸润程度是延长肝切除的指征,条件是可以实现R0切除并且患者具有良好的表现这种大手术的状态。在发生门周阻滞的患者中,切除类型与肺门周围胆管癌类似,其中包括改良的右侧扩大肝切除术保留段IVA(如果可能),有或没有尾状叶切除术,肝外胆管切除术和完全淋巴结切除术。据报道,扩大肝切除术的主要发病率超过50%,死亡率高达25-30%,涉及GBC的血管和多脏切除术。最近报道了主要肝切除术的改善结果,其具有改进的外科专业知识和肝脏手术技术以及门静脉栓塞等技术的实施。必须仔细选择患有这种广泛疾病的手术患者,因为不到10%的患者有可操作的疾病,长期存活是疾病阶段的反映,而不是切除的程度。
沿胆道横向扩散的GBC患者,包括胆管下段,十二指肠浸润,胰腺浸润和胰周淋巴结肿大,可能是HPD等广泛切除的指征。
包括胰十二指肠切除术(PD)在内的扩大切除术的结果存在争议,因为PD尤其与发病率显着增加有关。建议不要在GBC中进行淋巴结清除。在胆囊癌的治疗中,最小的生存率增加可能不合理。
15.9.3.3淋巴结切除术的范围
GBC根治性切除术中的完整淋巴结切除术包括沿肝十二指肠韧带的节点,左右门静脉节,外胚层的节和胰周和十二指肠淋巴结。根据AJCC第七版,这些节点形成N1组节点。沿着主动脉外节点,腹腔淋巴结和肠系膜上节点传播超出这些节点的疾病,现在根据AJCC分期标记为N2,具有转移状态并且包括在IV期中。通过冷冻切片分析推荐疾病扩散到主动脉淋巴结的早期评估,并且可以终止手术,因为在这种情况下根治性切除不可能提供任何生存益处。必须采取谨慎的系统方法来实现完整的淋巴结切除术和足够的淋巴结产量。
淋巴结转移是生存的最强预测因子之一。淋巴结总数和淋巴结阳性率与无病生存率和总生存率相关。如果在解剖期间收获六个或更多淋巴结,则认为淋巴结切除术是足够的。
15.9.3.4肝外胆管切除术
在GBC患者的管理中进行肝外胆管切除是作为原发疾病切除的一部分进行的。这种情况的实例是患有胆囊管残端或胆道受累的患者。一些作者建议在根治性胆囊切除术中常规进行胆道切除,认为它可以增加淋巴结产量并简化淋巴结清扫。在有或没有胆管切除的情况下,收获的淋巴结数量可能没有差异,并且胆管切除可能增加与手术相关的发病率,需要额外的胆道重建手术。因此,不推荐常规胆管切除作为根治性胆囊切除术的一部分。
在一个不常见的情况下,笨重的外胚层的淋巴结或门静脉炎症使得很难从胆管切开淋巴结,试图避免胆管切除实际上可能导致胆管损伤,胆漏和淋巴结切除术不足。在没有胆管切除的情况下,在这种情况下实现完整的淋巴结切除术可能是困难的,并且胆管切除可能是可接受的决定。 Barreto和Shukla全面总结了GBC肝外胆管切除的适应证。
在疾病的所有阶段切除EHBT的适应症包括:
1.涉及EHBT的肿瘤 - 术前表现为阻塞性黄疸。
2.肿瘤/大淋巴结肿大接近或累及肝总管或肺门。
3.发炎或脂肪肝十二指肠韧带导致淋巴结清扫困难。
4.接受再次切除的患者(因为术后炎症使得肿瘤和瘢痕的分化变得困难)。根据作者自己的经验,这种指示是可选的;肝十二指肠韧带炎症和纤维化的程度并不总是排除完全清除。
5.术中冰冻切片阳性胆囊管边缘。
6.胆囊管癌。
7.患有EHBT的相关APBDJ /胆总管囊肿的患者 - 这些患者胆管树的进一步异时性恶性肿瘤的风险增加,因此应当在治疗GBC时进行EHBT切除。
8.如果需要相关的血管切除/重建。
15.9.3.5端口站点复发和端口站点切除的作用
腹腔镜切除偶然GBC后,端口部位转移的风险先前估计为14-30%。最近的一项系统评价指出,过去二十年来端口转移的发生率呈下降趋势。本综述分析了GBC中端口部位转移发生率的27篇论文,并指出发病率已从2000年前的18.6%下降至此后的10.3%。提取位点的风险显着高于非提取位点。
Palousi等。提出在GBC中分别进行腹腔镜胆囊切除术和开腹胆囊切除术后的端口部位复发和腹壁复发的发生率均比其他癌症更常见。这种现象更多地与GBC及其侵入性相关,而不是与胆囊切除术相关。
推测腹腔镜胆囊切除术后门诊部位复发的发生率较高,这促使外科医生在根本性重新切除偶然性GBC期间预防性切除端口部位而没有证实有益效果。
现在已经知道,端口部位复发通常与腹膜复发和预后不良有关。常规端口部位切除无法减少疾病复发,不能提高生存率,导致高达8%的患者出现切口疝。
已报道切除孤立的端口部位复发。在塔塔纪念中心,偶尔有无疾病间隔超过一年的GBC患者出现延迟的孤立性部位复发而没有任何全身或腹膜复发的证据被认为是端口部位切除的候选者。即使在这些患者中,疾病稳定性或对化学疗法的反应在开始进行端口部位切除之前也是一个很好的测试。
15.9.3.6腹腔镜GBC切除术的现状
目前大多数GI(胃肠)癌症通过微创方法进行手术。端口部位复发的风险以及胆汁溢出对复发和存活的可能不良影响使得许多外科医生无法采用微创方法进行GBC切除。没有前瞻性研究比较开放式和腹腔镜式GBC方法。尽管很少有回顾性报告在良好的中心专家手中证明了可行性。早在2010年就发表了一项韩国研究,对早期GBC的36例早期GBC患者进行了术前评估,并且在2004年至2007年期间进行了术前评估。该研究证明了腹腔镜治疗至少早期GBC无肝脏侵犯的可行性,围手术期相似结果,中位随访27个月无复发。 Palanisamy等。公布了14例早期GBC根治性胆囊切除术患者的结果。所有患者主要患有T2疾病,只有一名患者患有T3疾病,另一名患者患有淋巴结阳性疾病。中位数淋巴结产量为8。来自高容量北印度中心(2015)的另一项研究比较了开腹和腹腔镜根治性胆囊切除术,并证实了类似的围手术期结果,腹腔镜根治性胆囊切除术的安全性和可行性。腹腔镜GBC切除术是一种先进的腹腔镜手术。进行腔内LN取样,完整和充分的门静脉淋巴结切除术和边缘阴性肝切除术需要大量的外科专业知识。根据目前的证据,在没有关于复发和生存的长期数据的情况下,不建议将腹腔镜GBC切除作为常规或标准治疗。
15.9.4系统治疗的作用
15.9.4.1辅助治疗
GBC是一种侵袭性恶性肿瘤,术后复发很常见。大约40%的复发是全身性的,表现为肝,肺,骨或腹膜转移。腹膜后淋巴结和远端淋巴结是另外40%复发的复发部位。 局部的复发,即。 20%的患者出现肝脏,肺门,吻合部位和切除边缘的切除床。
GBC是一种罕见的疾病,尚未确定辅助化疗的确切适应症,组合和方案。
单纯胆囊切除术的T1a患者和再次切除的T1b患者的生存率接近100%,并且复发在这些患者中并不常见。在这些患者中,化疗的益处是不合理的,并且不在该患者的子集中使用。
复发通常发生在≥T2,淋巴结阳性疾病或边缘阳性切除的患者中。这些患者可能会受益于辅助治疗。 NCCN指南建议考虑对患有pT2疾病及其他疾病的患者以及所有T1,N0期以外疾病的淋巴结阳性患者进行辅助治疗。辅助治疗选择是化疗和放化疗。 ABC 02试验表明,吉西他滨与顺铂联合治疗晚期胆道癌的疗效优于单用宝石 - 西酞普兰。单药吉西他滨或更常见的与额外铂药物的组合方案是辅助治疗中的优选药剂(表15.6)。
放射治疗可减少局部复发,但在随机试验中未证实其对生存的影响。不同研究所的辅助放化疗方案各不相同。应理解,与辐射一起使用的化学治疗剂主要起作用以增强和改善放射效应,并且作为辅助化疗是不充分的。在开始化放疗期间,患者应至少接受一些辅助全强度化疗周期。这有利于早期施用适当的全身化学疗法,并防止在一些可能在辅助治疗过程中早期复发的患者中使用放射线。
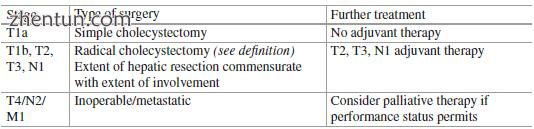
表15.6按阶段推荐的治疗方案
15.9.4.2新辅助治疗
在GBC患者中评估新辅助化疗(NACT)的研究很少,并且没有RCT(随机对照试验)或前瞻性研究。对于固有的侵袭性肿瘤生物学,NACT作为一种方法肯定需要使用具有可接受的反应率的方案在精心挑选的患者中进行评估。塔塔纪念中心的一项研究,关于我们在37名患者中使用这种方法的初步经验,其中包括18名治愈性切除的GBC患者,证明了可行性和可接受的反应率以及新辅助治疗的降期。 Selvakumar等人在一项对21名患者进行的类似研究中证实,在NACT后,切除率为66.67%。加藤等人。报告用NACT缩小了36.4%的胆道癌。
由于没有关于这种方法的标准指南,为NACT定义指示是必要的步骤。我们根据GBC患者的临床放射学表现定义了某些标准(TMH标准),其中疾病扩散超过GB,T3 / T4疾病和淋巴结阳性,并且某些不良预后因素被用作NACT的适应症,因为大多数这些患者会根据术前评估,在可能的外科手术后进行全身治疗(表15.7)。
我们在这种方法方面的经验现已扩展到NACT后的85例治愈性意图切除术(未发表的数据)。总体反应率为70%,病理学完全反应率为13%。基于吉西他滨的不同方案(GEMCIS / GEMOX)的反应率相似。中位随访时间为24个月。中位OS在2年时为61%,在3年时为53%。接受治愈性意向切除术(R0 / R1)的患者的中位OS在2年时为77%,在3年时为66%。该研究需要进行前瞻性验证。
15.9.5 GBC中的缓和
大多数GBC患者处于晚期阶段,许多病例在治愈性治疗后复发。 因此,症状缓解是诊断患有该疾病的患者的管理中的必要和重要方面。

表15.7边缘可切除/局部晚期GBC的TMH标准和新辅助化疗的适应症
原发性GB病变或既往非治愈性单纯胆囊切除术患者,具体如下:
1. GB质量,连续肝脏受累≥3cm
2. GB窝/肝床中的残余肿块,既往非治疗性单纯胆囊切除术
3.胆管受累引起阻塞性黄疸(I型,II型,III型肺门周围阻滞)
4.放射学/内窥镜怀疑/确认肝外器官的参与/浸润,如胃/十二指肠的窦[与]幽门的区域/结肠/肠的肝曲
5.放射学怀疑门静脉,胰十二指肠,右侧腹腔,胃肠和胰周节(任何N1组)的累及
6.对CHA / RHA / MPV / RPV <180°的主要流入血管侵犯 - 撞击/受累的等效放射学怀疑
7.在外部中心切除术后可疑的边缘状态/阳性边缘,可能进行未来的根治性再切除术
8.在没有先前的化疗或GBC的确定治疗的情况下,非转移性GBC中的孤立的端口部位复发
梗阻性黄疸伴有瘙痒,胆管炎,肝功能失代偿和呕吐;继发于肿瘤浸润的邻近幽门十二指肠区域的幽门十二指肠梗阻;和痛苦是需要姑息治疗的三个主要重要主诉。
患者有时可能发生继发于结肠浸润或粘连到腹膜转移沉积物的肠梗阻。
浸润邻近器官的大肿瘤引起腔内或很少腹膜内出血。
大多数患有这些表现的患者具有局部晚期不可切除或转移性疾病,并且姑息性措施处于中心阶段。
具有可接受的性能状态的患者是用于缓解的有效干预/治疗的候选者,以改善生活质量。
一般情况显着恶化和ECOG(东部肿瘤协作组)表现状态差(ECOG> 2)的患者仅为最佳支持治疗的候选人,除非一般情况可以通过支持治疗进行修改。
已经描述了段3旁路,并且在内窥镜和介入放射学专业知识的流行和支架置入以缓解黄疸之前的时代中定期使用。内窥镜或经皮方法侵入性较小,同样有效且病态较少,显然是姑息治疗的首选方式。
经皮入路(PTBD)与内镜入路相比具有更好的治疗成功率和更低的胆管炎发生率,因为大多数阻滞是肝门周围,但与这两种手术相关的总体并发症发生率和30天死亡率是相似的。
在黄疸缓解后,生活质量得到改善,如果通过支持性护理和营养康复改善表现状态,患者可在胆红素正常化后进行姑息治疗。
当胆囊附近的这些器官与肿瘤有关时,胃十二指肠或结肠支架是一种有效的措施。对于预期寿命有限且储备不良的患者,很少进行姑息性内部旁路,导流管和切除术。
专业疼痛管理团队对癌症疼痛管理的帮助不能再强调了。腹腔神经丛阻滞是缓解与晚期UGI恶性肿瘤相关的疼痛的可接受方法。
对于具有良好表现状态的患者,局部晚期和转移性GBC的姑息性化疗是合适的选择。吉西他滨仍然是胆胰腺癌全身治疗的主要支柱。吉西他滨与顺铂或奥沙利铂是这种情况下常用的药物,有时用5FU或口服卡培他滨代替。尚未确定最佳方案,应鼓励患者参与临床试验。 Erlotinib,一种表皮生长因子受体(EGFR)阻断剂,bevacizumab,一种血管内皮生长因子(VEGF)受体阻滞剂和拉帕替尼(EGFR和HER2 / NEU阻断剂)已被用于全身化学疗法并具有一些益处,但研究结果表明主要针对胆管癌进行。
在胆管癌中使用放射线是一种常见的做法,它已被用于R +切除术和更好的黄疸缓解术。具有类似预测益处的类似用途可以在接受边缘切除术或包含局部晚期不可切除疾病的GBC患者中实施。辐射通常与致敏化疗剂组合使用。它可以减少肿瘤生长,实现局部控制,可能减少局部肿瘤相关并发症,甚至可以提高这些患者的生存率。
15.10生存
T1a GBC单纯胆囊切除术后5年生存率极佳,为97%至99%(图15.9)。 T1a肿瘤的复发率很低,据报道其范围为0.6%至3.4%,这些患者不应进一步切除。 现在常规地进行再次切除并推荐T1b患者,因为它可以提高生存率并减少这些患者的复发。 重新切除后,他们的5年生存率为70-80%。
T2和T3患者的5年生存率从70%到30%不等。 T4和M1患者的长期存活率很低。 转移患者的中位生存期为数月。
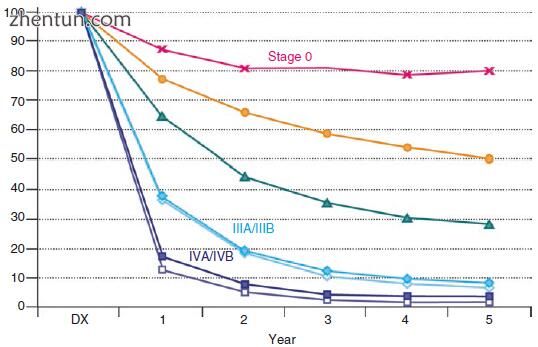
图15.9观察到10,705个胆囊癌的存活率。来自美国国家癌症数据库(美国外科医师学会癌症委员会和美国癌症协会)的数据在1989年至1996年间被诊断出来。经美国伊利诺伊州芝加哥市美国癌症联合委员会(AJCC)。该信息的原始和主要来源是Springer Science + Business Media出版的AJCC癌症分期手册,第七版(2010)
15.11未来方向
GBC易感性的个别基因研究不足以证实关联。未来的研究应侧重于更全面的方法和多阶段的发病机制,因为疾病似乎是多个连续事件的结果。确定高发区的易感个体,通过筛选美国或生化标志物以及预防性胆囊切除术的作用来早期发现疾病需要进行定义。 GBC缺乏围绕围手术期治疗的随机对照试验。确定围手术期(新辅助)治疗的候选人和这种方法的前瞻性研究需要进行。 GBC仍然是具有相对较差预后的侵袭性癌症,并且如今的全身治疗还有很多不足之处。
参考:Surgical Diseases of the Pancreas and Biliary Tree |