宫颈癌筛查是宫颈癌发生前检测和清除子宫颈中异常组织或细胞的过程。[1] 旨在早期发现和治疗宫颈瘤,宫颈癌筛查旨在宫颈癌的二级预防。[2] 宫颈癌的几种筛查方法是巴氏试验(也称为子宫颈抹片检查或常规细胞学检查),基于液体的细胞学检查,HPV DNA检测和用醋酸进行目视检查。 巴氏试验和基于液体的细胞学检查有效降低了发达国家宫颈癌的发病率和死亡率,但在发展中国家却没有。[3] 可用于发展中国家资源匮乏地区的前瞻性筛查方法是HPV DNA检测和目视检查。[4]
目录
1 建议
2 筛选类型
2.1 常规细胞学
2.2 液基单层细胞学
2.3 人乳头瘤病毒检测
3 筛选过程
3.1 去除异常细胞
3.2 在资源贫乏地区进行测试
3.3 其他选择
3.4 目视检查以检测癌症前期或癌症
3.4.1 用乙酸目视检查
4 参考文献
建议
不同国家有不同的宫颈筛查建议。
在欧洲,大多数国家建议或提供年龄在25至64岁之间的筛查。[5]根据2010年欧洲宫颈癌筛查指南,开始筛查的年龄范围在20-30岁之间,“但优选不在25岁或30岁之前”,取决于人群中疾病的负担和可用资源。[6]在英格兰,NHS子宫颈检查计划适用于25至64岁的女性; 25至49岁的女性每3年接受一次邀请,50至64岁的女性每5年接受一次邀请。[7]
在美国,建议对年龄在21-65岁之间的女性进行筛查,无论性行为年龄或其他高风险行为如何。[8] [9] [10]对于从未接受过子宫颈抹片检查异常的21-29岁健康女性,宫颈细胞学(子宫颈抹片检查)的宫颈癌筛查应每3年进行一次,无论HPV疫苗接种状况如何[11]。 30-65岁女性的首选筛查是“共同检测”,其中包括每5年进行一次宫颈细胞学检查和HPV检测。[11]然而,每3年一次用巴氏涂片筛查这个年龄组是可以接受的。[11]对于65岁以上的女性,在过去10年内没有异常筛查结果且没有高级病变史的情况下,可以停止筛查宫颈癌。[11]
在澳大利亚,每两年对18至70岁的女性进行一次筛查。这是通过子宫颈抹片检查,而不论性史。[12]在加拿大,省级安排筛查方案,一般建议不要在没有具体原因的情况下开始例行检查,直到25岁,然后每隔三年筛查一次直到69岁。[13]但是,例如,安大略省的“安大略省子宫颈普查计划建议,从21岁开始,从事性活动或从事性活动的女性每3年进行一次巴氏试验。”[14]
在资源匮乏的国家,有关宫颈癌筛查的决定是基于现有资源做出的,因此通常不可能经常提供子宫颈筛查。对宫颈癌减少的最大影响似乎是筛查30至39岁的女性,因此可以将资源用于该年龄组。[15]
筛选类型
有许多不同类型的筛选方法可供选择。在美国,宫颈癌筛查通常使用巴氏试验(或“涂片试验”)进行[16],尽管英国筛查计划在2008年将筛查方法改为液基细胞学。[17]
常规细胞学
主要文章:巴氏试验
在传统的巴氏涂片中,收集细胞的医生将它们涂在显微镜载玻片上并涂上固定剂。通常,将载玻片送到实验室进行评估。
研究传统细胞学报告的准确性:[18]
灵敏度72%
特异性94%
液基单层细胞学
自20世纪90年代中期以来,越来越多地使用基于将样品放入含有保存细胞的液体培养基的小瓶中的技术。其中两种类型是Sure-Path(TriPath Imaging)和Thin-Prep(Cytyc Corp)。该介质主要是乙醇为Sure-Path,甲醇为ThinPrep。一旦放入小瓶中,样品在实验室处理成细胞薄层,染色并通过光学显微镜检查。液体样本具有适用于高风险HPV检测的优点,并且可以将不令人满意的样本从4.1%减少到2.6%。[19]正确的样品采集对于测试的准确性至关重要,因为无法评估样品中不存在的细胞。
液基单层细胞学报告的准确性研究报告:
敏感性为61%[20]至66%,[18](尽管一些研究报告液体涂片的敏感性增加[19])
特异性82%[20]至91%[18]
人乳头瘤病毒检测
人乳头瘤病毒(HPV)感染是几乎所有宫颈癌病例的原因。[21]大多数女性将在18个月内成功清除HPV感染。由于HPV对DNA的影响,那些长期感染高风险类型的患者[22](例如16,18,31,45型)更容易发生宫颈上皮内瘤变。
1995年,英国研究人员Anne Szarewski和Jack Cuzick表示,在宫颈筛查期间检测细胞中HPV DNA的存在将检测到常规检测遗漏的癌前病例。[23]
英国国家健康服务中心现在在其筛查计划中包括“HPV分诊”。这意味着如果初始筛查测试显示临界结果或低级异常细胞,则对样品进行HPV的进一步测试。如果这表明存在HPV,则要求患者进行进一步检查,但如果没有HPV,患者将恢复通常的筛查时间表,就好像没有发现异常一样。[24]
关于HPV检测报​​告准确性的研究:
灵敏度88%至91%(用于检测CIN 3或更高)[20]至97%(用于检测CIN2 +)[25]
特异性73%至79%(用于检测CIN 3或更高)[20]至93%(用于检测CIN2 +)[25]
通过添加更敏感的HPV检测,特异性可能会下降。[26]如果特异性确实下降,结果是假阳性测试的数量增加,并且对于许多没有疾病的女性,阴道镜检查,侵入性手术[27]和不必要的治疗的风险增加。有价值的筛查试验需要在敏感性和特异性之间取得平衡,以确保患有疾病的人被正确识别为患有疾病并且没有疾病的患者没有被确定患有疾病。
关于HPV检测的作用,随机对照试验将HPV与阴道镜检查进行了比较。 HPV检测似乎与即时阴道镜检查一样敏感,同时减少了所需的阴道镜检查数量。[28]随机对照试验表明HPV检测可能遵循异常细胞学[20]或可能先于宫颈细胞学检查。[25]
2007年发表的一项研究表明,进行子宫颈抹片检查的行为会产生炎性细胞因子反应,这可能会启动HPV的免疫清除,从而降低宫颈癌的风险。在他们的病史中甚至有一次子宫颈抹片检查的女性患癌症的发生率较低。 “HPV阳性率的统计学显著下降与接受的子宫颈抹片检查的终身数量相关。”[29]
根据一项随机对照试验,HPV检测可以降低​​32-38岁女性随后的筛查试验检测到的2级或3级宫颈上皮内瘤变或宫颈癌的发生率。[30]相对风险降低41.3%。对于与本研究中风险相似的患者(63.0%患有CIN 2-3或癌症),这导致绝对风险降低26%。 3.8患者必须接受治疗才能获益(需要治疗的人数= 3.8)。点击此处为CIN 2-3风险较高或较低的患者调整这些结果。 HPV检测的一个有希望的前景是自我取样的可能性。现在可以建议对自我样本进行HPV检测,作为一种额外的策略,以帮助未参加常规筛查计划的妇女以及将来作为可能的筛查策略。[31]
筛选进程
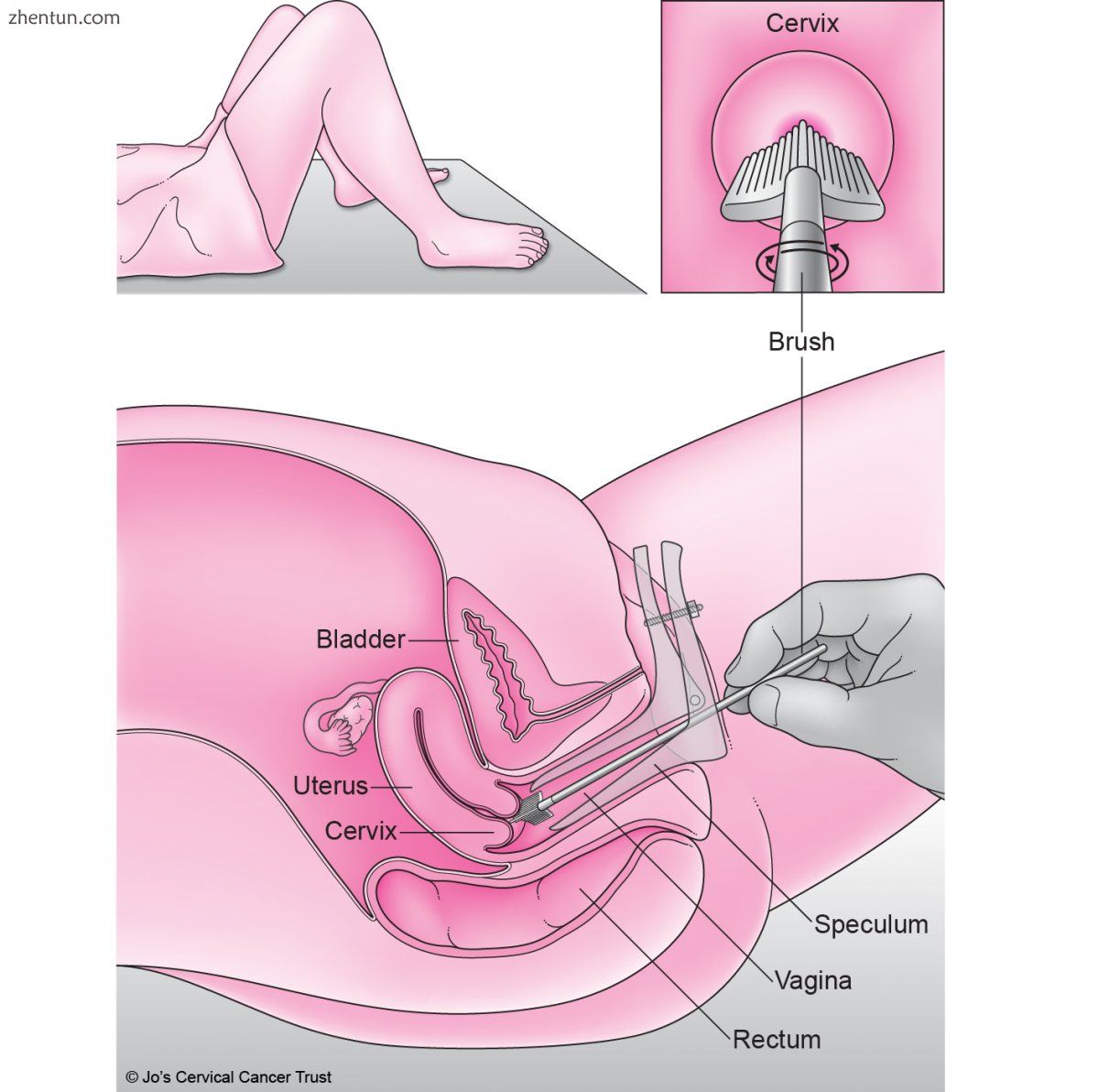
使用子宫颈抹片检查,基于液体的细胞学检查或HPV检测来测试女性的程序是相似的。使用刮刀或小刷子从子宫颈收集细胞样品。然后检查细胞是否有任何异常。
为了获取细胞样本,医疗保健临床医生在阴道内插入称为窥器的器械。窥器具有两个臂,将阴道壁分开以便看到子宫颈。然后,他们用刮刀或小刷子刮擦子宫颈表面。这收集了来自子宫颈外层的细胞样本。
用子宫颈抹片检查,将用刮刀收集的细胞涂抹在载玻片上,在显微镜下检查。在基于液体的细胞学中,使用小刷子取细胞样品。将细胞放入液体容器中,分析异常情况。以类似的方式收集待测HPV的宫颈细胞。
去除异常细胞
女性可能被告知患有CIN(宫颈上皮内瘤变)或CIS(原位癌) - 这些术语描述了宫颈细胞中发现的不同程度的异常。可以使用几种不同程序之一去除或破坏异常细胞。
激光消融和冷冻疗法仅治疗包含异常细胞的子宫颈部分。激光消融使用激光烧掉异常细胞,而冷冻疗法使用冷探针将细胞冷冻掉。这些程序允许正常细胞在它们的位置生长。循环电切除程序(称为LLETZ或英国的“转换区大环切除”),宫颈锥切术(或锥形活检)和子宫切除术切除了包含可能变为癌前期或发展为宫颈癌的细胞的整个区域。
在资源贫乏地区进行测试
许多资源贫乏地区无法提供定期筛查,必须依靠不频繁的筛查。一项针对印度农村地区131,746名妇女宫颈癌筛查的研究发现,单次DNA检测可减少8年内晚期宫颈癌和死亡人数,而单次乙酸检查或单次宫颈癌筛查则没有。然而,DNA测试花费30-40美元,这在许多地区是无法承受的,这是耗时的,并且需要复杂的实验室基础设施。中国和其他国家正在评估一项简单,经济,准确的测试。[33] [34] [35]新测试可能会在2010年上市,成本远低于目前的测试成本。
通过HPV检测,与未经筛查的女性相比,宫颈癌死亡人数减少了50%[36] [37]。与其他方法相比,该研究显示HPV检测报​​告的假阴性最少。[38]
其他选择
比尔和梅林达盖茨基金会资助了一项为期八年的关于导致宫颈癌的病毒DNA测试的研究。 Qiagen制造的测试每次测试成本低,结果仅在几个小时内可用,可以减少每年Pap涂片的使用。该测试已经证明对于自己采取棉签而不是允许医生进行测试的女性来说“可以接受”。这可能会增加因不舒服或谦虚而不愿接受筛查的妇女早期诊断的机会。[39]
目视检查以检测癌症前期或癌症
用宫颈醋酸进行阴性目测检查
用宫颈乙酸对CIN-1进行阳性目视检查
在无法获得或负担得起子宫颈抹片检查的地区,已经评估了其他测试方法。
使用醋酸(白醋; VIA)或Lugol碘(VILI)目视检查宫颈,以突出癌前病变,以便用“肉眼”观察它们,将癌前病变的鉴定从实验室转移到诊所。这样的程序消除了对实验室和标本运输的需要,只需要很少的设备并为妇女提供即时的检测结果。一系列医疗专业人员 - 医生,护士或专业助产士 - 只要接受充分的培训和监督,就能有效地执行手术。作为一项筛查测试,VIA在准确鉴别癌前病变方面的表现可能与宫颈细胞学一样好或更好。[40]在各种研究中已经证明了这一点,在这些研究中,受过训练的医生和中层提供者正确地确定了45%至79%的女性患宫颈癌的高风险。[41]相比之下,细胞学的敏感性已显示在47%和62%之间。细胞学提供比VIA更高的特异性(更少的假阳性)。与细胞学一样,VIA的一个局限性是结果高度依赖于个体解释的准确性。这意味着初始培训和持续的质量控制至关重要。在筛选和治疗环境中,假阳性增加尤为重要,因为过度治疗和生育能力受损的可能性更大。
在资源匮乏的环境中,VIA可以提供超过Pap的显著优势,特别是在增加筛查覆盖率,改善后续护理和整体计划质量方面。由于需要较少的专业人员和较少的基础设施,培训和设备,VIA公共卫生系统可以在更偏远(和设备较少)的医疗保健环境中提供宫颈癌筛查,并可以实现更高的覆盖率。此外,医疗服务提供者可以立即与患者分享VIA的结果,从而可以在同一次就诊期间对女性进行筛查和治疗。这有助于确保在现场提供后续护理,并减少可能因为无法在其他时间返回诊所而错过治疗的妇女人数。例如,在秘鲁的“筛查和治疗”项目中,只有9%的筛查阳性的妇女未能通过一次就诊方式接受治疗,而使用多次访问模式治疗的妇女中有44%未能接受治疗。 [42]。
VIA已成功配合冷冻疗法,这是一种治疗宫颈病变的相对简单且廉价的方法,可由初级保健医生和中层提供者进行。[43]
用乙酸目测检查
另见:醋测试
如果考虑用于公共卫生计划,还必须分析用乙酸(VIA)进行目视检查的有前景的方法。与细胞学检查相比,VIA已经证明在几项研究中具有较低的特异性和较高的假阳性率[44] [45] [46] [47]。炎症,宫颈湿疣和白斑等实体可以给出VIA试验的假阳性结果。[48]它还具有低阳性预测值,导致过度诊断和过度治疗。 VIA对子宫颈管上方的病变有严重的局限性,无法观察到;这对于宫颈内交界处退缩的绝经后妇女来说是一个主要问题。[49]没有永久性的测试记录供以后审查。在社区中心之间已经观察到高度可变性,甚至在2013年的尼日利亚研究中,VIA也不具有可再现性和敏感性;这导致该国的方法令人沮丧。[50]
另见:
CervicalCheck
参考:
"What is cervical screening". National Screening Unit, Government of New Zealand. 27 November 2014.
Module 13: Levels of Disease Prevention. (2007, April 24). Retrieved March 16, 2014, from Centers for Disease Control and Prevention website: "Archived copy". Archived from the original on 2014-02-26. Retrieved 2015-08-23.
Quinn, M; Babb, P; Jones, J; Allen, E (1999). "Effect of screening on incidence of and mortality from cancer of cervix in England: evaluation based on routinely collected statistics". BMJ. 318 (7188): 904–8. doi:10.1136/bmj.318.7188.904. PMC 27810. PMID 10102852.
World Health Organization (2014). Comprehensive Cervical Cancer Control: A Guide to Essential Practice. WHO.
"Everything about cervical cancer prevention". www.ecca.info. Retrieved 2015-05-09.
Arbyn, M; Anttila, A; Jordan, J; Ronco, G; Schenck, U; Segnan, N; Wiener, H; Herbert, A; von Karsa, L (Mar 2010). "European Guidelines for Quality Assurance in Cervical Cancer Screening. Second edition--summary document". Annals of Oncology. 21 (3): 448–58. doi:10.1093/annonc/mdp471. PMC 2826099. PMID 20176693.
"Cervical screening: programme overview". GOV.UK. Public Health England.
"SEER Stat Fact Sheets: Cervix Uteri Cancer". Retrieved 8 April 2014.
Karjane, N; Chelmow, D (June 2013). "New cervical cancer screening guidelines, again". Obstetrics and Gynecology Clinics of North America. 40 (2): 211–23. doi:10.1016/j.ogc.2013.03.001. PMID 23732026.
Center for Disease Control. "Cervical Cancer Screening Guidelines for Average-Risk Women" (PDF). Retrieved 17 April 2014.
Committee on Practice, Bulletins—Gynecology (Nov 2012). "ACOG Practice Bulletin Number 131: Screening for cervical cancer". Obstetrics and Gynecology. 120 (5): 1222–38. doi:10.1097/AOG.0b013e318277c92a (inactive 2019-08-20). PMID 23090560.
"Cervical cancer screening", Cancer Council Australia, accessed 14 November 2015
"Screening for Cervical Cancer (2013)" Archived 2015-11-17 at the Wayback Machine, Canadian Task Force for Preventive Health Care, accessed 14 November 2015
"Cervical Cancer Screening", Cancer Care Ontario, accessed 14 November 2015
Sankaranarayanan R, Esmy PO, Rajkumar R, Muwonge R, Swaminathan R, Shanthakumari S, Fayette JM, Cherian J (2007). "Effect of visual screening on cervical cancer incidence and mortality in Tamil Nadu, India: a cluster-randomised trial". Lancet. 370 (9585): 398–406. doi:10.1016/S0140-6736(07)61195-7. PMID 17679017.
Screening: Cervical cancer, US Preventive Services Task Force (accessed 28/01/2011)
Liquid Based Cytology (LBC), NHS cervical screening programme (accessed 28/03/2011)
Coste J, Cochand-Priollet B, de Cremoux P, et al. (2003). "Cross sectional study of conventional cervical smear, monolayer cytology, and human papillomavirus DNA testing for cervical cancer screening". BMJ. 326 (7392): 733. doi:10.1136/bmj.326.7392.733. PMC 152633. PMID 12676841. ACP Journal Club
Ronco G, Cuzick J, Pierotti P, et al. (2007). "Accuracy of liquid based versus conventional cytology: overall results of new technologies for cervical cancer screening randomised controlled trial". BMJ. 335 (7609): 28. doi:10.1136/bmj.39196.740995.BE. PMC 1910655. PMID 17517761.
Kulasingam SL, Hughes JP, Kiviat NB, et al. (2002). "Evaluation of human papillomavirus testing in primary screening for cervical abnormalities: comparison of sensitivity, specificity, and frequency of referral". JAMA. 288 (14): 1749–57. doi:10.1001/jama.288.14.1749. PMID 12365959.
Walboomers JM, Jacobs MV, Manos MM (1999). "Human papillomavirus is a necessary cause of invasive cervical cancer worldwide". J. Pathol. 189 (1): 12–9. doi:10.1002/(SICI)1096-9896(199909)189:1<12::AID-PATH431>3.0.CO;2-F. PMID 10451482.
Cuschieri KS, Cubie HA, Whitley MW, et al. (2005). "Persistent high risk HPV infection associated with development of cervical neoplasia in a prospective population study". J. Clin. Pathol. 58 (9): 946–50. doi:10.1136/jcp.2004.022863. PMC 1770812. PMID 16126875.
"Human papillomavirus testing in primary cervical screening", Lancet 17 June 1995
"HPV triage and test of cure in the cervical screening programme in England". Public Health England. Retrieved 28 July 2014.
Cuzick J, Szarewski A, Cubie H, et al. (2003). "Management of women who test positive for high-risk types of human papillomavirus: the HART study". Lancet. 362 (9399): 1871–6. doi:10.1016/S0140-6736(03)14955-0. PMID 14667741.
Arbyn M, Buntinx F, Van Ranst M, Paraskevaidis E, Martin-Hirsch P, Dillner J (2004). "Virologic versus cytologic triage of women with equivocal Pap smears: a meta-analysis of the accuracy to detect high-grade intraepithelial neoplasia". J. Natl. Cancer Inst. 96 (4): 280–93. doi:10.1093/jnci/djh037. PMID 14970277.
Colposcopy and Treatment of Cervical Intraepithelial Neoplasia: A Beginner's Manual
ASCUS-LSIL Traige Study (ALTS) Group (2003). "Results of a randomized trial on the management of cytology interpretations of atypical squamous cells of undetermined significance". Am. J. Obstet. Gynecol. 188 (6): 1383–92. doi:10.1016/S0002-9378(03)00418-6. PMID 12824967.
Passmore JA, Morroni C, Shapiro S, Williamson AL, Hoffman M (2007). "Papanicolaou smears and cervical inflammatory cytokine responses". J Inflamm (Lond). 4: 8. doi:10.1186/1476-9255-4-8. PMC 1868022. PMID 17456234.
Naucler P, Ryd W, Törnberg S, et al. (2007). "Human papillomavirus and Papanicolaou tests to screen for cervical cancer". N. Engl. J. Med. 357 (16): 1589–97. doi:10.1056/NEJMoa073204. PMID 17942872.
Arbyn M, Verdoodt F, Snijders PJ, et al. Accuracy of human papillomavirus testing on self-collected versus clinician-collected samples: a meta-analysis. The Lancet Oncology. 2014 Feb;15(2):172-83. PubMed PMID 24433684.
Solomon, C. G.; Solomon, M.; Solomon, D. (2013). "Cervical-Cancer Screening with Human Papillomavirus and Cytologic Cotesting". New England Journal of Medicine. 369 (24): 2324–2331. doi:10.1056/NEJMcp1210379. PMID 24328466.
Sankaranarayanan R, Nene BM, Shastri SS, et al. (April 2009). "HPV screening for cervical cancer in rural India". N. Engl. J. Med. 360 (14): 1385–94. doi:10.1056/NEJMoa0808516. PMID 19339719.
Emery, Gene (2009-04-01). "Reuters- QIAGEN virus test cuts death from cervical cancer". Reuters.com. Retrieved 2010-08-29.
Donald G. McNeil Jr. (April 6, 2009). "New DNA Test Outperforms the Pap Smear". The New York Times.
Chase, Marilyn (2009-04-01). "Bloomberg – Cervical cancer deaths halved by HPV Test, Treatment". Bloomberg.com. Retrieved 2010-08-29.
"The Guardian – NHS under pressure for new cervical cancer test provision". Sarah Boseley, health editor. London: Guardian. 2009-04-02. Retrieved 2010-08-29.
Sharples, Tiffany (2009-04-02). "Time – HPV Test Screens Best for Cervical Cancer". Time.com. Retrieved 2010-08-29.
McNeil Jr, Donald G. (2009-04-07). "DNA Test Outperforms Pap Smear". The New York Times. Retrieved 2010-05-21.
Sherris J, Wittet S, Kleine A, et al. (September 2009). "Evidence-based, alternative cervical cancer screening approaches in low-resource settings". Int Perspect Sex Reprod Health. 35 (3): 147–54. doi:10.1363/ifpp.35.147.09. PMID 19805020.
Sankaranarayanan, R; Gaffikin, L; Jacob, M; Sellors, J; Robles, S (2005). "A critical assessment of screening methods for cervical neoplasia". International Journal of Gynecology & Obstetrics. 89: S4–S12. doi:10.1016/j.ijgo.2005.01.009. ISSN 0020-7292. PMID 15823266.
Luciani S, Winkler J. Cervical Cancer prevention in Peru: Lessons learned from the TATI demonstration project. Washington, DC: Pan American Health Organization; 2006.
Gage, J; Ferreccio, Catterina; Gonzales, Miguel; Arroyo, Raul; Huivı́n, Militza; Robles, Sylvia C (2003). "Follow-up care of women with an abnormal cytology in a low-resource setting". Cancer Detection and Prevention. 27 (6): 466–471. doi:10.1016/j.cdp.2003.09.004. ISSN 0361-090X. PMID 14642555.
Jeronimo J, et al. (Mar 2014). "A multicountry evaluation of careHPV testing, visual inspection with acetic acid, and papanicolaou testing for the detection of cervical cancer". Int J Gynecol Cancer. 24 (3): 576–85. doi:10.1097/igc.0000000000000084. PMC 4047307. PMID 24557438.
Longatto-Filho A, et al. (Jun 2012). "Performance characteristics of Pap test, VIA, VILI, HR-HPV testing, cervicography, and colposcopy in diagnosis of significant cervical pathology". Virchows Arch. 460 (6): 577–85. doi:10.1007/s00428-012-1242-y. PMID 22562132.
Labani S et al. CareHPV cervical cancer screening demonstration in a rural population of north India. Eur J Obstet Gynecol Reprod Biol. 2014 May;
Gravitt, Patti E.; Paul, Proma; Katki, Hormuzd A.; Vendantham, Haripriya; Ramakrishna, Gayatri; Sudula, Mrudula; Kalpana, Basany; Ronnett, Brigitte M.; Vijayaraghavan, K.; Shah, Keerti V. (2010). "Effectiveness of VIA, Pap, and HPV DNA Testing in a Cervical Cancer Screening Program in a Peri-Urban Community in Andhra Pradesh, India". PLoS ONE. 5 (10): e13711. Bibcode:2010PLoSO...513711G. doi:10.1371/journal.pone.0013711. PMC 2965656. PMID 21060889.
International Agency for Research on Cancer. A practical manual on visual screening for cervical neoplasia. Lyon, France: IARC; 2003.
Rahatgaonkar W. VIA in cervical cancer screening. Journal of Dental and Medical Sciences (IOSRJDMS) ISSN 2279-0861 Volume 1, Issue 1 (July–August 2012), PP 01-04
Ajenifuja KO, et al. (Mar 2013). "A population-based study of visual inspection with acetic acid (VIA) for cervical screening in rural Nigeria". Int J Gynecol Cancer. 23 (3): 507–12. doi:10.1097/igc.0b013e318280f395. PMC 3580031. PMID 23354369. |