生殖受精,授精,授粉,[1]受精,合成和浸渍,[2]是配子的融合,以启动新的个体生物或后代的发育。[3]] 这种受精和新个体发育的循环被称为有性生殖。 在被子植物双受精过程中,单倍体雄性配子与两个单倍体极核结合,通过营养受精过程形成三倍体初级胚乳核。
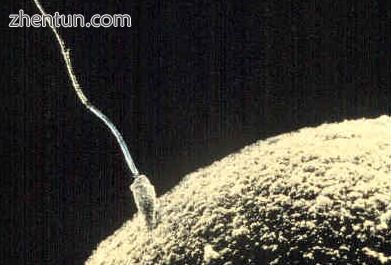
精子和卵子融合
目录
1 历史
2 进化
3 植物受精
3.1 苔藓植物
3.2 蕨类植物
3.3 裸子植物
3.4 开花植物
3.5 自花授粉
4 动物受精
4.1 内部与外部
4.2 海胆
4.3 哺乳动物
4.3.1 人类
4.4 昆虫
5 真菌受精
6 原生生物受精
6.1 原生动物的受精
6.2 藻类施肥
6.3 真菌样原生生物的受精
7 受精和基因重组
8 单性生殖
9 异体受精和自体受精
10 双性生殖的其他变种
11 交叉受精的好处
12 参考资料
历史
在古代,亚里士多德通过融合男性和女性的流体构思了新的个体,形式和功能逐渐出现,他称之为表观遗传。[4]
1784年,Spallanzani确定了雌性卵子和雄性精子之间相互作用的需要,以形成青蛙的受精卵。[5] 1827年,冯巴尔第一次观察到了一个哺乳动物的卵。[4]德国的Oscar Hertwig(1876)描述了精子细胞核和海胆卵子的融合。[5]
演化
受精的进化与减数分裂的起源有关,因为两者都是有性生殖的一部分,起源于真核生物。 关于夫妻减数分裂受精如何产生,有两个相互矛盾的理论。 一个是它是从原核生殖(细菌重组)进化而来的,因为真核生物是从原核生物进化而来的。[6] 另一种是有丝分裂起源于减数分裂。[7]
植物受精
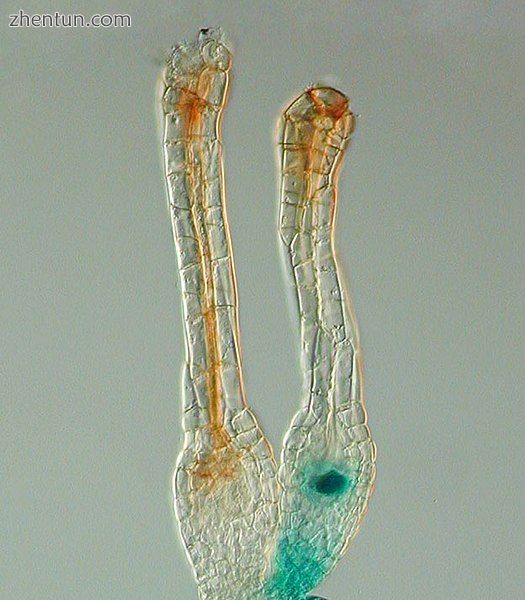
在苔藓植物陆地植物中,受精发生在颈卵器内。这种苔藓已经过基因改造,因此在颈卵中的未受精卵产生蓝色。
参与植物受精的配子是花粉(雄性)和卵(雌性)细胞。各种植物家族具有不同的方法,雌性配子体受精。在苔藓植物的陆地植物中,受精在子宫内进行。在开花植物中,第二次受精事件涉及另一个精子细胞和中央细胞,其是第二雌性配子。在开花植物中,每个花粉粒有两个精子。
在种子植物中,授粉后,花粉粒发芽,花粉管生长并通过称为微孔的小孔穿透胚珠。精子从花粉通过花粉管转移到胚珠。
花粉管生长
与运动的动物精子不同,植物精子是不动的,依靠花粉管将其带到精子释放的胚珠。[8]花粉管穿透柱头并在到达卵巢之前通过该样式的细胞外基质伸长。然后在容器附近,它通过微孔(胚珠壁上的开口)突破胚珠,花粉管“爆裂”进入胚囊,释放出精子。[9]花粉管的生长被认为取决于雌蕊的化学信号,然而这些机制直到1995年才被人们所了解。在烟草植物上完成的工作揭示了一类称为TTS蛋白的糖蛋白,它们促进了花粉管的生长。[9]无糖花粉萌发培养基中的花粉管和含有纯化TTS蛋白的培养基均生长。然而,在TTS培养基中,管的生长速度是无糖培养基的3倍。[9]还将TTS蛋白置于半veve授粉的雌蕊的不同位置,观察到花粉管立即向蛋白质延伸。缺乏产生TTS蛋白能力的转基因植物表现出较慢的花粉管生长和降低的繁殖力。[9]
花粉管破裂
已显示花粉管在拟南芥中释放精子的破裂取决于来自雌配子体的信号。称为FER蛋白激酶的特定蛋白质存在于胚珠中,控制着高活性氧衍生物的产生,称为活性氧(ROS)。[10]通过GFP显示ROS水平在花期阶段最高,此时胚珠最容易接受花粉管,在发育期和受精后最低[8]。大量的ROS激活花粉管中的钙离子通道,导致这些通道大量吸收钙离子。这种钙摄取的增加导致花粉管破裂,并将精子释放到胚珠中。[8]雌蕊饲养试验,其中植物饲喂二苯基氯化碘(DPI)抑制拟南芥中的ROS浓度,从而防止花粉管破裂。[8]
苔藓植物
苔藓植物是一种传统名称,用于指所有没有真正血管组织的胚胎植物(陆地植物),因此被称为“非维管植物”。一些苔藓植物确实有专门的组织用于运输水;然而,由于它们不含木质素,因此它们不被认为是真正的血管组织。
蕨类植物
蕨类植物是大约12,000种维管植物的成员,这些植物通过孢子繁殖,既没有种子也没有花。它们与苔藓的不同之处在于血管(即具有导水血管)。像其他维管植物一样,它们有茎和叶。大多数蕨类植物都有所谓的蕨类植物,它们会扩展成叶状,每个叶状物都被精细地分开。
裸子植物
裸子植物是一组种子生产植物,包括针叶树,苏铁,银杏和Gnetales。术语“裸子植物”来自希腊语复合词γυμνόσπερμος(γυμνόςbymnos,“naked”和σπέρμαperma,“种子”),意思是“裸种子”,在它们的种子未被封闭的条件下(称为未受精状态的胚珠)。它们的裸露状态与开花植物(被子植物)的种子和胚珠形成鲜明对比,开花植物被种植在卵巢中。裸子植物种子在鳞片或叶子的表面上发育,经常被修饰形成锥体,或者在银杏的短茎末端发育。
开花植物
主要文章:双重受精
受精后,卵巢开始膨胀并发育成果实。[11]对于多种子的果实,多粒花粉对于每个胚珠的合成是必需的。花粉管的生长受营养(或管)细胞质的控制。水解酶由花粉管分泌,当管沿着柱头和花柱向下生长时,消化雌性组织;消化的组织在花粉管生长时用作花粉管的营养源。在花粉管向卵巢生长期间,生殖核分裂产生两个独立的精子核(染色体的单倍体数量)[12] - 生长的花粉管因此包含三个独立的细胞核,两个精子和一个细胞管。[13]精子相互连接并且是二态的,在许多植物中,大的精子也与管核相连,相互连接的精子和管核形成“雄性胚芽单位”。[14]
双受精是被子植物(开花植物)中的过程,其中来自每个花粉管的两个精子在胚珠内的雌配子体(有时称为胚囊)中使两个细胞受精。花粉管进入配子体后,花粉管核解体,两个精子细胞释放;两个精子细胞中的一个使卵细胞受精(在微孔附近的配子体底部),形成二倍体(2n)受精卵。这是受精实际发生的时候;授粉和施肥是两个独立的过程。另一个精子细胞的细胞核与配子体中心的两个单倍体极核(包含在中央细胞中)融合。得到的细胞是三倍体(3n)。这种三倍体细胞通过有丝分裂分裂并在种子内部形成营养丰富的组织胚乳。
对胚乳有贡献的两个中央细胞母核(极核)是由单一减数分裂产物的有丝分裂产生的,这种减数分产物也产生了卵子。因此,母体对三倍体胚乳遗传构成的贡献是胚胎的两倍。
一种原始的开花植物,Nuphar polysepala,具有二倍体的胚乳,由精子与一个而不是两个母体核融合而产生。据信,在被子植物细胞发育的早期,这种繁殖方式存在重复,产生七细胞/八核雌性配子体,三倍体胚乳具有2:1的母体与父本基因组比例。[15]
在许多植物中,果实的果肉发育与受精胚珠的百分比成正比。例如,对于西瓜,必须将大约一千粒花粉递送并均匀地分布在柱头的三个叶片上,以制成正常大小和形状的果实。
交叉受精和自我受精代表不同的策略,具有不同的收益和成本。估计有48.7%的植物物种是雌雄异株或自交不亲和的专性外胚。[16]据估计,约42%的开花植物在自然界中表现出混合交配系统。[17]
在最常见的混合交配系统中,单个植物产生单一类型的花,并且果实可以包含自花受精,外交或后代类型的混合物。从交叉受精到自体受精的过渡是植物中最常见的进化过渡,并且在许多独立的谱系中反复发生。[18]大约10-15%的开花植物主要是自花受精。[18]
自花授粉
主要文章:自花授粉
另见:闭花受精y和自体受精
在传粉媒介和/或配偶很少的情况下,自体受精提供了生殖保障的优势。[18]因此,自体受精可以提高定植能力。在一些物种中,自我受精持续了许多代。 Capsella风疹是一种自我受精的物种,在5万到10万年前就已经自我兼容了。[19]拟南芥(Arabidopsis thaliana)是一种以自花授粉为主的植物,在野外的交叉率低于0.3%; [20]一项研究表明,自然受精在大约一百万年前进化到拟南芥中。[21]在长期建立的自花授粉植物中,有害突变的掩蔽和遗传变异的产生是罕见的,因此不可能提供超过许多代的足够益处来维持减数分裂装置。因此,人们可能期望自然受精在自然界中被一种成本较低的无生殖无性繁殖形式所取代。然而,在长期建立的自花受精植物中,减数分裂和自体受精作为一种繁殖形式的实际持续存在可能与每代中由减数分裂形成的生殖细胞形成期间DNA损伤的有效重组修复的直接益处有关。 22]
动物受精
另见:动物的性繁殖和动物的性行为
受精的机制已经在海胆和小鼠中进行了广泛的研究。这项研究解决了精子和适当的卵子如何相互找到的问题,以及一个精子如何进入卵子并传递其内容的问题。受精有三个步骤确保物种特异性:
趋化作用
精子激活/顶体反应
精子/卵子粘连
内部与外部
考虑动物(更具体地说是脊椎动物)是否使用内部或外部受精通常取决于出生方法。产卵较厚的钙壳(例如鸡或厚皮革壳)的卵生动物通常通过内部受精繁殖,使得精子使卵子受精而不必穿过鸡蛋的厚的保护性三层。卵胎生和胎生动物也使用内部受精。值得注意的是,虽然有些生物通过复合体繁殖,但它们仍然可以使用内部受精,就像一些火蜥蜴一样。内部施肥的优点包括:最少的配子浪费;个体卵子受精的机会更大,卵子保护时间相对“更长”,选择性施肥;许多女性有能力长时间储存​​精子,并可根据自己的意愿使卵子受精。
另一方面,产生具有薄三级膜或根本没有膜的卵的卵产动物使用外部施肥方法。 外部受精的优点包括:体液的接触和传播最小化; 降低疾病传播的风险,以及更大的遗传变异(特别是在产卵外部受精方法期间)。
海胆
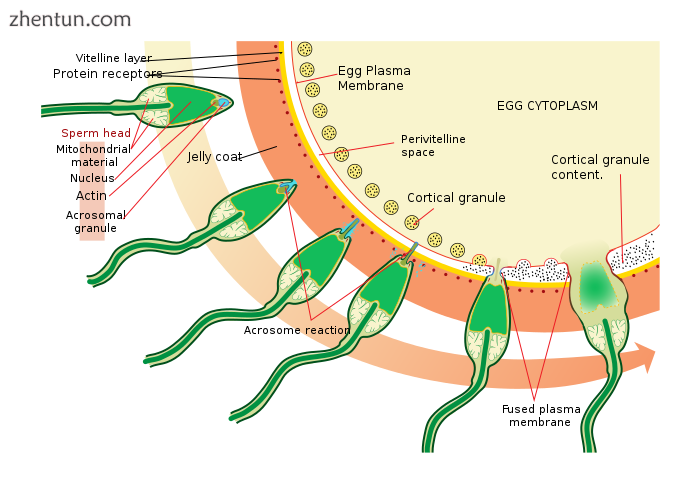
海胆细胞上的顶体反应。
精子通过趋化性(一种配体/受体相互作用)发现卵子。 Resact是从A. punctulata的果冻外壳中纯化的14个氨基酸的肽,其吸引精子的迁移。
在找到卵子后,精子通过称为精子激活的过程穿透果冻外壳。在另一种配体/受体相互作用中,卵的寡糖成分结合并激活精子上的受体并引起顶体反应。精子的顶体囊泡与质膜融合并被释放。在该过程中,与顶体囊泡膜结合的分子,例如结合蛋白,暴露在精子表面上。这些内容物消化果冻涂层并最终消化卵黄膜。除了顶体囊泡的释放之外,还存在肌动蛋白的爆炸性聚合,以在精子的头部形成称为顶体过程的薄尖峰。
精子通过卵黄膜上的受体之间的另一个配体反应与卵结合。精子表面蛋白结合蛋白与卵黄膜上的受体结合,被鉴定为EBR1。
精子和卵子的质膜融合可能是由结合蛋白介导的。在接触部位,融合导致形成受精锥。
哺乳动物
哺乳动物通过交配在内部受精。在男性射精后,许多精子通过子宫颈移动到阴道上部(通过阴道收缩)并穿过子宫长度以与卵子相遇。在发生受精的情况下,雌性通常在交配前几小时到几天后排卵;因此,在大多数哺乳动物中,射精在排卵之前比反之亦然。
当精子细胞沉积到阴道前部时,它们不能受精(即,无能力)并且以慢线性运动模式为特征。这种运动模式与肌肉收缩相结合,使精子能够向子宫和输卵管输送。[23]在雌性生殖道的微环境中存在pH梯度,使得阴道口附近的pH比输卵管(约8.0)低(约5.0)。[24]精子特异性pH敏感的钙转运蛋白称为CatSper,当它进一步进入生殖道时,会增加精子细胞对钙的渗透性。细胞内钙流入有助于精子获能和过度活化,当精子接近卵母细胞时,导致更剧烈和快速的非线性运动模式。获能的精子和卵母细胞在输卵管的壶腹部相遇并相互作用。 Rheotaxis,thermotaixs和趋化性是在精子迁移的最后阶段将精子引向卵子的已知机制。[25]精子响应(见精子趋热性)至输卵管与壶腹之间〜2°C的温度梯度,[26]并且黄体酮的趋化性梯度已经被确认为从兔和人卵母细胞周围的卵丘卵细胞发出的信号。 27]容量和过度活跃的精子通过改变它们的行为并向卵丘 - 卵母细胞复合体移动来响应这些梯度。其他趋化信号如甲酰基Met-Leu-Phe(fMLF)也可能指导精子[28]。
透明带(zona pellucida)是一层厚厚的细胞外基质,围绕着卵子,类似于海胆中卵黄膜的作用,与精子结合。与海胆不同,精子在顶体反应前与卵子结合。 ZP3是透明带中的一种糖蛋白,负责小鼠的卵/精子粘附。受体半乳糖基转移酶(GalT)与ZP3上的N-乙酰葡糖胺残基结合,对于与精子结合并激活顶体反应非常重要。虽然精子/卵子结合不必要,但ZP3是足够的。存在两种额外的精子受体:与输卵管分泌的蛋白质结合的250kD蛋白质和独立结合透明带的SED1。在顶体反应后,认为精子通过暴露的ZP2受体保持与透明带结合。这些受体在小鼠中是未知的,但已在豚鼠中鉴定。
在哺乳动物中,精子与GalT的结合引发顶体反应。该过程释放透明质酸酶,其消化卵母细胞周围的透明质酸基质。此外,肝细胞糖胺聚糖(GAGs)在卵母细胞附近释放,促进顶体反应。[29]卵母细胞质膜和精子之间的融合随之而来,并允许精子核,典型的中心粒和附着在鞭毛上的非典型中心粒,而不是线粒体,进入卵母细胞。[30]蛋白质CD9可能在小鼠中介导这种融合(结合同源物)。卵子在与单个精子细胞融合后“激活”自身,从而改变其细胞膜以防止与其他精子融合。在这种激活过程中释放出锌原子。
有与哺乳动物受精有关的媒体。
该过程最终导致形成称为受精卵的二倍体细胞。 受精卵分裂形成胚泡,进入子宫后,子宫内膜植入,开始怀孕。 不在子宫壁中的胚胎植入导致可以杀死母亲的异位妊娠。
在像兔子这样的动物中,性交通过刺激垂体激素促性腺激素的释放诱导排卵; 这个版本大大增加了怀孕的可能性。
人类
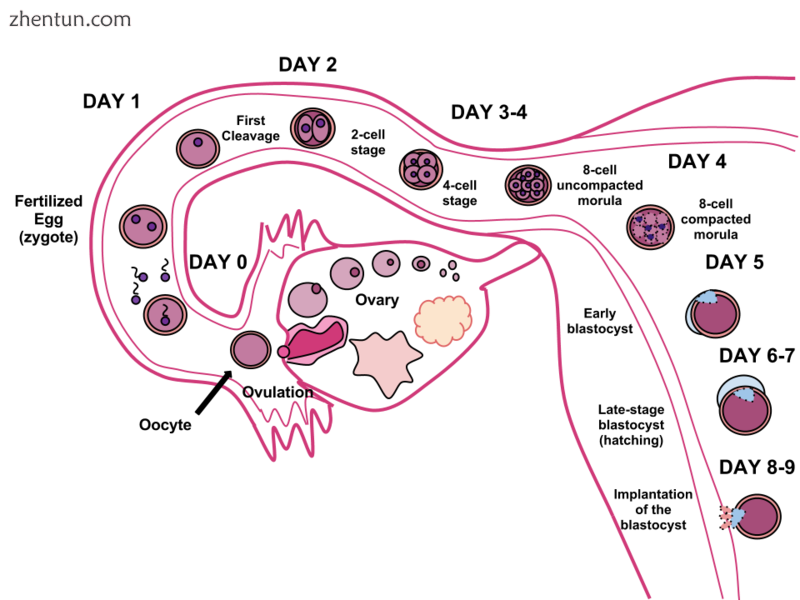
人体受精。精子和卵子通过受精结合在一起,形成一个受精卵(在8-9天的过程中)植入子宫壁,在那里居住9个月。
主要文章:人类受精
人体受精是人类卵子和精子的结合,通常发生在输卵管的壶腹部,产生合子细胞或受精卵,引发产前发育。科学家在十九世纪发现了人类受精的动态。
术语概念通常指的是“怀孕涉及受精或植入或两者兼有的过程”。[31]它的使用使其成为关于怀孕开始的语义论证的主题,通常是在堕胎辩论的背景下。在受精后大约16天发生原肠胚形成时,植入的胚泡形成三个胚层,即内胚层,外胚层和中胚层,并且父亲的遗传密码完全参与胚胎的发育;后来结对是不可能的。此外,种间杂种仅在原肠胚形成后存活,不能进一步发育。然而,一些人类发育生物学文献提到了概念,而这种医学文献将“受孕产品”称为植入后胚胎及其周围的膜[32]。由于其概念和内涵的不同,“概念”一词在科学文献中通常不被使用。
昆虫

红脉镖(Sympetrum fonscolombii)飞行“在警察”(雄性前方),使雄性能够阻止其他雄性交配。卵子在铺设时受精,一次一个。
不同群体的昆虫,包括蜻蜓(蜻蜓和豆娘)和膜翅目(蚂蚁,蜜蜂和黄蜂)实施延迟施肥。在蜻蜓目中,雌性可以与多个雄性交配,并储存精子直到产卵。在产卵(产卵)期间,雄性可能会在雌性上方盘旋,以防止她与其他雄性交配并更换其精子;在一些群体中,例如突击者,男性在产蛋期间继续用抓手抓住女性,两人一起飞来飞去。[33]在社会膜翅目昆虫中,蜜蜂皇后只在交配的飞行中交配,在短时间内持续几天;女王可以与八个或更多的交配。然后她将精子存放在她的余生中,可能是五年或更长时间。[34] [35]
真菌受精
在许多真菌(除了chytrids),如在一些原生生物中,受精是一个两步过程。首先,两个配子细胞的细胞质融合(称为plasmogamy),产生具有多个细胞核的双核或异核细胞。然后该细胞可以分裂以产生双核或异核菌丝。受精的第二步是核配,核的融合形成二倍体受精卵。
在壶菌属真菌中,与配子融合的一步发生受精,如在动物和植物中。
原生生物受精
原生动物受精
原生动物有三种受精过程:[36]
配子结合;
自花授粉; [37] [38]
配子母体配合。
藻类受精
藻类受精通过二元裂变发生。首先撤回伪足,并且核开始分裂。当细胞质分裂时,细胞质也被分成两个相等的部分用于每个子细胞。两个子细胞由一个亲本细胞产生。它涉及有丝分裂的过程。
在真菌样的原生生物中受精
真菌受精。在许多真菌(除了chytrids),如在一些原生生物中,受精是一个两步过程。 ...在壶菌真菌中,受精与配子融合在一起发生,如在动物和植物中。
受精和基因重组
减数分裂导致每个亲本贡献的基因的随机分离。除了一小部分基因外,每个亲本生物通常都是相同的;因此,每个配子都具有遗传独特性。受精时,父母的染色体结合在一起。在人类中,(222)= 17.6x1012染色体不同的受精卵可能用于非性染色体,即使假设没有染色体交叉。如果交叉发生一次,那么平均(422)2= 309x1024每对夫妇都可能存在遗传上不同的受精卵,而不考虑交叉事件可能发生在每条染色体的大多数点上。 X和Y染色体不经历交叉事件,因此被排除在计算之外。线粒体DNA仅遗传自母本。
单性生殖
主要文章:孤雌生殖
通常通过性生殖繁殖的生物也可以通过孤雌生殖繁殖,其中未受精的雌性配子产生可存活的后代。这些后代可能是母亲的克隆,或者在某些情况下与她遗传不同,但仅遗传了她的部分DNA。孤雌生殖发生在许多植物和动物中,并且可以通过对卵细胞的化学或电刺激在其他植物和动物中诱导。 2004年,由Tomoiro Kono领导的日本研究人员在457次尝试通过阻断某些通常会阻止这种可能性的蛋白质合并两只小鼠的卵子后成功了。由此产生的胚胎通常发育成小鼠。[39]
异体受精和自体受精
异体受精,也称为交叉受精,是指来自一个人的卵细胞与另一个人的雄性配子的受精。
自然配偶,也称为自体受精,发生在诸如植物和扁虫的雌雄同体生物体中;其中,来自一个独立保险丝的两个配子。
双性生殖的其他变种
一些相对不寻常的复制形式是:[40] [41]
雌核发育:精子刺激卵子发育而不受精或合成。精子可能进入卵子。
杂交发生:消除一个基因组以产生单倍体卵。
Canina减数分裂 有时称为“永久性多倍多倍性”)一个基因组以孟德尔方式传播,其他基因组传播克隆。 有时称为“永久性多倍多倍性”)一个基因组以孟德尔方式传播,其他基因组传播克隆。
交叉受精的好处
主要文章:异体受精和杂种优势
通常认为交叉受精的主要好处是避免近交衰退。查尔斯·达尔文在他1876年的著作“蔬菜王国中的交叉和自我受精的影响”(第466-467页)中总结了他的研究结果。[42]
“在本卷中已经证明,来自两个不同个体的联合的后代,特别是如果他们的祖先受到非常不同的条件,在自我受精的身高,体重,体质活力和生育能力方面具有巨大的优势。来自同一个父母的后代。而这一事实足以说明性元素的发展,即两性的起源。“
此外,一些人认为,[43]认为外在性的长期优势是增加遗传变异性,促进适应和/或避免灭绝(见遗传变异)。
另见:
Cell fusion
Conception cap
Conception device
Female sperm
Fetal development
In vitro fertilisation
Kaguya (mouse)
Parthenogenesis, a type of reproduction that does not involve fertilisation
Pollination
Proembryo
Pronucleus
Superfecundation
Superfetation
Symmetry breaking and cortical rotation
参考:
"Fertilization". Merriam-Webster. Retrieved July 10, 2018.
http://www.oxfordlearnersdiction ... nglish/impregnation[full citation needed][permanent dead link]
{], or outside (external fertilisation)
Maienschein J. 2017. The first century of cell theory: From structural units to complex living systems. In: Stadler F. (eds.), Integrated History and Philosophy of Science. Vienna Circle Institute Yearbook. Institute Vienna Circle, University of Vienna, Vienna Circle Society, Society for the Advancement of Scientific World Conceptions, vol 20. Springer, Cham. link.
Birkhead, T.R. & Montgomerie, R. (2009). Three centuries of sperm research, pp 1-42 in: Birkhead, T. R., Hosken, D. J. & Pitnick, S. Sperm Biology: An Evolutionary Perspective. Elsevier/Academic Press, Amsterdam. 642 pp., [1].
Bernstein H, Bernstein C, Michou RE (2011). "Meiosis as an Evolutionary Adaptation for DNA Repair". In Kruman I (ed.). DNA repair. InTech. doi:10.5772/1751. ISBN 978-953-307-697-3.
Wilkins AS, Holliday R (January 2009). "The evolution of meiosis from mitosis". Genetics. 181 (1): 3–12. doi:10.1534/genetics.108.099762. PMC 2621177. PMID 19139151.
Duan, Qiaohong; Kita, Daniel; Johnson, Eric A; Aggarwal, Mini; Gates, Laura; Wu, Hen-Ming; Cheung, Alice Y (2014). "Reactive oxygen species mediate pollen tube rupture to release sperm for fertilization in Arabidopsis". Nature Communications. 5: 3129. Bibcode:2014NatCo...5.3129D. doi:10.1038/ncomms4129. PMID 24451849.
Cheung, Alice Y; Wang, Hong; Wu, Hen-Ming (1995). "A floral transmitting tissue-specific glycoprotein attracts pollen tubes and stimulates their growth". Cell. 82 (3): 383–93. doi:10.1016/0092-8674(95)90427-1. PMID 7634328.
Maejima, Yasuhiro (2012). "Reactive oxygen species". Science Direct. Retrieved April 25, 2018.
Johnstone, Adam (2001). Biology: facts & practice for A level. Oxford University Press. p. 95. ISBN 0-19-914766-3.
Handbook of plant science. Chichester, West Sussex, England: John Wiley. 2007. p. 466. ISBN 978-0-470-05723-0.
Kirk, David; Starr, Cecie (1975). Biology today. Del Mar, Calif.: CRM. p. 93. ISBN 978-0-394-31093-0.
Raghavan, Valayamghat (2006). Double fertilization: embryo and endosperm development in flowering plant. Berlin: Springer-Verlag. p. 12. ISBN 978-3-540-27791-0.
Friedman, William E; Williams, Joseph H (2003). "Modularity of the Angiosperm Female Gametophyte and Its Bearing on the Early Evolution of Endosperm in Flowering Plants". Evolution. 57 (2): 216–30. doi:10.1111/j.0014-3820.2003.tb00257.x. PMID 12683519.
Igic B, Kohn JR (2006). "The distribution of plant mating systems: study bias against obligately outcrossing species". Evolution. 60 (5): 1098–103. doi:10.1554/05-383.1. PMID 16817548.
Goodwillie C, Kalisz S, Eckert CG (2005). "The evolutionary enigma of mixed mating systems in plants: Occurrence, theoretical explanations, and empirical evidence". Annu. Rev. Ecol. Evol. Syst. 36: 47–79. doi:10.1146/annurev.ecolsys.36.091704.175539.
Wright, S. I; Kalisz, S; Slotte, T (2013). "Evolutionary consequences of self-fertilization in plants". Proceedings of the Royal Society B: Biological Sciences. 280 (1760): 20130133. doi:10.1098/rspb.2013.0133. PMC 3652455. PMID 23595268.
Brandvain, Yaniv; Slotte, Tanja; Hazzouri, Khaled M; Wright, Stephen I; Coop, Graham (2013). "Genomic Identification of Founding Haplotypes Reveals the History of the Selfing Species Capsella rubella". PLoS Genetics. 9 (9): e1003754. arXiv:1307.4118. Bibcode:2013arXiv1307.4118B. doi:10.1371/journal.pgen.1003754. PMC 3772084. PMID 24068948.
Abbott, RJ; Gomes, MF (1989). " opulation genetic structure and outcrossing rate of Arabidopsis thaliana (L.) Heynh". Heredity. 62 (3): 411–418. doi:10.1038/hdy.1989.56. opulation genetic structure and outcrossing rate of Arabidopsis thaliana (L.) Heynh". Heredity. 62 (3): 411–418. doi:10.1038/hdy.1989.56.
Tang C, Toomajian C, Sherman-Broyles S, Plagnol V, Guo YL, Hu TT, Clark RM, Nasrallah JB, Weigel D, Nordborg M (2007). "The evolution of selfing in Arabidopsis thaliana". Science. 317 (5841): 1070–2. Bibcode:2007Sci...317.1070T. doi:10.1126/science.1143153. PMID 17656687.
Bernstein, Harris; Bernstein, Carol; Michod, Richard E. (2011). "Meiosis as an Evolutionary Adaptation for DNA Repair". In Kruman, Inna (ed.). DNA Repair. doi:10.5772/25117. ISBN 978-953-307-697-3.
Suarez, S.S.; Pacey, A. A. (2006). "Sperm transport in the female reproductive tract". Human Reproduction Update. 12 (1): 23–37. doi:10.1093/humupd/dmi047. PMID 16272225.
Cheong, Ying; MacKlon, Nick; Morgan, Hywel; Mingels, Roel; Ng, Ka Ying Bonnie (January 2018). "In vivo oxygen, temperature and pH dynamics in the female reproductive tract and their importance in human contraception: a systemic review". Human Reproduction Update. 24 (1): 15–34. doi:10.1093/humupd/dmx028. PMID 29077897.
Li, Shuai; Winuthayanon, Wipawee (2016). "Oviduct: Roles in fertilization and early embryo development". Journal of Endocrinology. 232 (1): R1–R26. doi:10.1530/JOE-16-0302. PMID 27875265.
Bahat, Anat; Eisenbach, Michael (2006). "Sperm thermotaxis". Molecular and Cellular Endocrinology. 252 (1–2): 115–9. doi:10.1016/j.mce.2006.03.027. PMID 16672171.
Teves, Maria E; Guidobaldi, Hector A; Uñates, Diego R; Sanchez, Raul; Miska, Werner; Publicover, Stephen J; Morales Garcia, Aduén A; Giojalas, Laura C (2009). "Molecular Mechanism for Human Sperm Chemotaxis Mediated by Progesterone". PLoS ONE. 4 (12): e8211. Bibcode:2009PLoSO...4.8211T. doi:10.1371/journal.pone.0008211. PMC 2782141. PMID 19997608.
Gnessi L, Fabbri A, Silvestroni L, Moretti C, Fraioli F, Pert CB, Isidori A (1986). "Evidence for the presence of specific receptors for N-formyl chemotactic peptides on human spermatozoa". J Clin Endocrinol Metab. 63 (4): 841–846. doi:10.1210/jcem-63-4-841. PMID 3018025.
Ax, R. L.; First, N. L.; Bushmeyer, S. M.; Clayton, M. K.; Lee, C. N. (1986-09-01). "Glycosaminoglycans in Ewe Reproductive Tracts and Their Influence on Acrosome Reactions in Bovine Spermatozoa in Vitro". Journal of Animal Science. 63 (3): 861–867. doi:10.2527/jas1986.633861x. ISSN 0021-8812. PMID 3759713.
Fishman, Emily L; Jo, Kyoung; Nguyen, Quynh P. H; Kong, Dong; Royfman, Rachel; Cekic, Anthony R; Khanal, Sushil; Miller, Ann L; Simerly, Calvin; Schatten, Gerald; Loncarek, Jadranka; Mennella, Vito; Avidor-Reiss, Tomer (2018). "A novel atypical sperm centriole is functional during human fertilization". Nature Communications. 9: 2210. Bibcode:2018NatCo...9.2210F. doi:10.1038/s41467-018-04678-8. PMC 5992222. PMID 29880810.
"Conception". Merriam-Webster. Retrieved January 27, 2019.
Moore, K. L.; T. V. M. Persaud (2003). The Developing Human: Clinically Oriented Embryology. W. B. Saunders Company. ISBN 0-7216-6974-3.
Dijkstra, Klaas-Douwe B. (2006). Field Guide to the Dragonflies of Britain and Europe. British Wildlife Publishing. pp. 8–9. ISBN 0-9531399-4-8.
Waldbauer, Gilbert (1998). The Birder's Bug Book. Harvard University Press.
Agriculture and Consumer Protection. "Beekeeping in Africa: Colony life and social organization". FAO.
Fertilization in protozoa and metazoan animals: cellular and molecular aspects. Juan J. Tarín; Antonio Cano (eds.). Springer-Verlag, 2000.
Reproduction#Autogamy
"Autogamy | biology".
Kono, Tomohiro; Obata, Yayoi; Wu, Quiong; Niwa, Katsutoshi; Ono, Yukiko; Yamamoto, Yuji; Park, Eun Sung; Seo, Jeong-Sun; Ogawa, Hidehiko (2004). "Birth of parthenogenetic mice that can develop to adulthood". Nature. 428 (6985): 860–4. Bibcode:2004Natur.428..860K. doi:10.1038/nature02402. PMID 15103378. Lay summary – National Geographic (2004-04-21).
Stenberg, P; Saura, A (2013). "Meiosis and Its Deviations in Polyploid Animals". Cytogenetic and Genome Research. 140 (2–4): 185–203. doi:10.1159/000351731. PMID 23796636.
Stock, M; Ustinova, J; Betto-Colliard, C; Schartl, M; Moritz, C; Perrin, N (2011). "Simultaneous Mendelian and clonal genome transmission in a sexually reproducing, all-triploid vertebrate". Proceedings of the Royal Society B: Biological Sciences. 279 (1732): 1293–1299. doi:10.1098/rspb.2011.1738. PMC 3282369. PMID 21993502.
Darwin CR (1876). The effects of cross and self fertilisation in the vegetable kingdom. London: John Murray. http://darwin-online.org.uk/conv ... 249/1876-F1249.html[permanent dead link] see page 466-467
Otto, S.P; Gerstein, A.C (2006). "Why have sex? The population genetics of sex and recombination". Biochemical Society Transactions. 34 (4): 519–22. doi:10.1042/BST0340519. PMID 16856849. |