肿瘤是组织的一种异常和过度生长,称为瘤形成。 肿瘤的生长与正常周围组织的生长不协调,并且即使原始触发因素被消除,它也会持续异常生长。[1] [2] [3] 这种异常增长通常(但并不总是)形成一个肿块。[4] 当它形成肿块时,它可以被称为肿瘤。
ICD-10将肿瘤分为四大类:良性肿瘤,原位肿瘤,恶性肿瘤和不确定或未知行为的肿瘤。[5] 恶性肿瘤也简称为癌症,是肿瘤学的焦点。
在组织异常生长之前,如瘤形成,细胞通常会出现异常的生长模式,如化生或发育异常。[6] 然而,化生或发育不良并不总是发展为瘤形成。[1] 这个词来自古希腊语νέος-neo(“新”)和πλάσμα等离子体(“形成”,“创造”)。
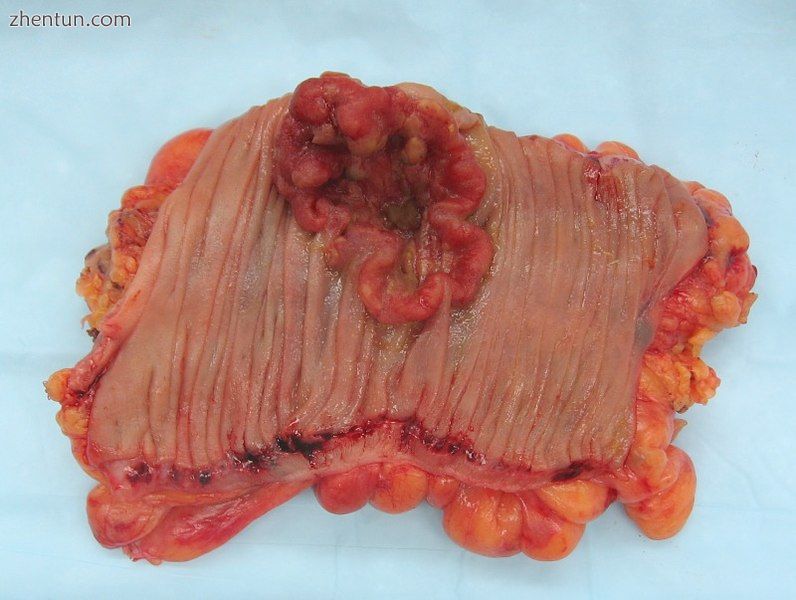
包含恶性肿瘤的结肠切除标本,即结肠直肠癌的侵袭性实例(类似火山口,带红色,不规则形状的肿瘤)
目录
1 类型
1.1 克隆
1.2 瘤形成与肿瘤的关系
2 原因
3 恶性肿瘤
3.1 DNA损伤
3.2 视野缺陷
3.3 基因组不稳定
4 词源
5 参考
类型
- 发作和萎缩
退行发育(细胞或细胞群内的结构分化丧失)。
发育不全(器官或部分器官缺失)
发育不全(先天性低于平均细胞数,特别是当不足时)
增生(细胞增殖)
瘤变(异常增生)
发育异常(细胞或组织表型改变)
组织变形(细胞类型的转换)
分化异常(新细胞功能的开发)
发育不全(结缔组织生长)
萎缩(器官功能降低,细胞数量或体积减少)
肥大(细胞体积增加)
营养不良(细胞体积减少)
营养性衰竭(器官或组织活力丧失)
营养不良(营养不良或营养不良引起的任何退行性疾病)
VTE
肿瘤可以是良性的,可能是恶性的,也可能是恶性的(癌症)。[7]
良性肿瘤包括子宫肌瘤,骨赘和黑素细胞痣(皮肤痣)。它们受到局限和局部化,不会转化为癌症。[6]
潜在的恶性肿瘤包括原位癌。它们是局部的,不会侵入和破坏,但是及时,可能会变成癌症。
恶性肿瘤通常被称为癌症。它们侵入并破坏周围组织,可能形成转移,如果不治疗或对治疗无反应,将证明是致命的。
继发性肿瘤是指一类癌症肿瘤中的任何一种,其是原发性肿瘤的转移性分支,或者是在某些癌症治疗例如化学疗法或放射疗法之后频率增加的明显不相关的肿瘤。
很少有转移性肿瘤,没有已知原发癌的部位,这被归类为原发癌未知的癌症
克隆
肿瘤性肿瘤通常是异质性的并且包含一种以上类型的细胞,但它们的起始和持续生长通常依赖于单个肿瘤细胞群。这些细胞被认为是克隆的 - 也就是说,它们来自相同的细胞,[8]并且都具有相同的遗传或表观遗传异常 - 显然是克隆性的。对于淋巴肿瘤,例如淋巴瘤和白血病,通过扩增其免疫球蛋白基因(用于B细胞损伤)或T细胞受体基因(用于T细胞损伤)的单一重排来证明克隆性。现在认为克隆性的证明有必要将淋巴细胞增殖鉴定为肿瘤。[9]
将肿瘤定义为克隆性细胞增殖是很有诱惑力的,但克隆性的证明并不总是可行的。因此,在瘤形成的定义中不需要克隆性。
瘤形成与肿瘤
肿瘤(美国英语)或肿瘤(英国英语),拉丁语,肿胀,炎症的主要征兆之一,最初意味着任何形式的肿胀,肿瘤或非肿瘤。然而,目前的英语,无论是医学还是非医学,都使用肿瘤作为肿瘤的同义词(肿瘤细胞可能或可能不是由肿瘤细胞的异常生长形成的固体或充满液体的囊性病变),其尺寸看起来更大。 [10] [11]有些肿瘤不会形成肿瘤;这些包括白血病和大多数形式的原位癌。肿瘤也不是癌症的同义词。虽然癌症根据定义是恶性的,但肿瘤可以是良性的,癌前的或恶性的。
术语质量和结节通常与肿瘤同义使用。然而,一般而言,术语肿瘤一般使用,而不考虑病变的物理尺寸。[1]更具体地,当病变在最大方向上具有至少20毫米(mm)的最大直径时经常使用术语质量,而当病变的尺寸在其最大尺寸上小于20mm时通常使用术语结节。 (25.4毫米= 1英寸)。[1]
原因
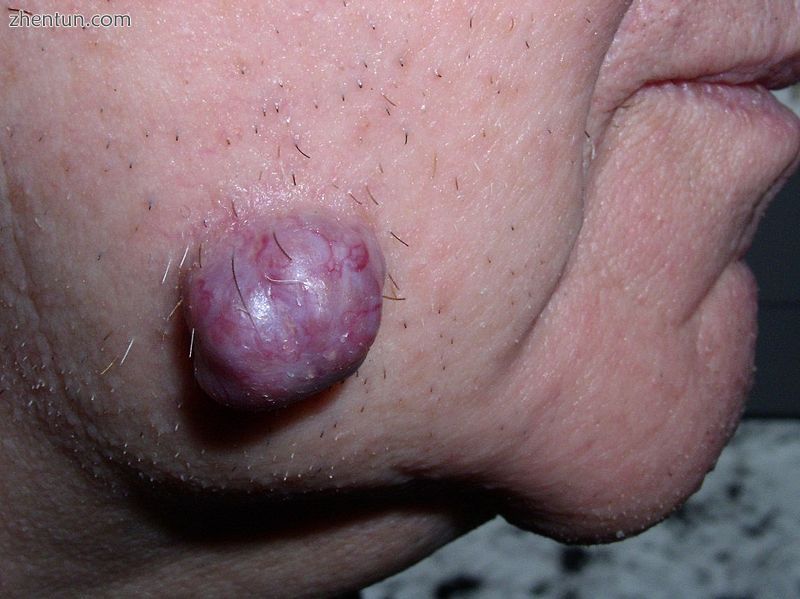
颊部皮肤的肿瘤,这里是汗腺的良性肿瘤,称为汗腺腺瘤,不是固体,而是充满液体的
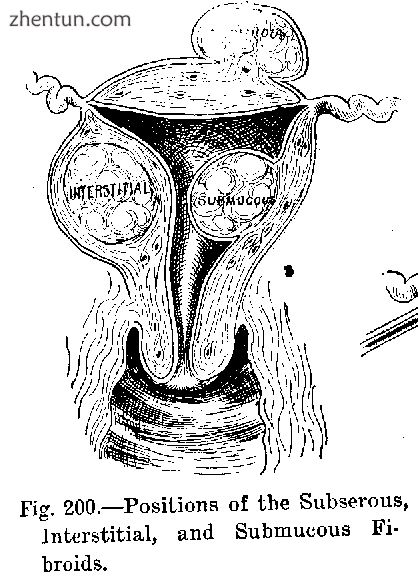
图解说明良性肿瘤,即子宫肌瘤
肿瘤可由组织的异常增殖引起,其可由基因突变引起。然而,并未指出所有类型的肿瘤都会导致组织肿瘤过度生长(例如白血病或原位癌),以及肿瘤生长和再生过程之间的相似性,例如去分化和快速细胞增殖[12]。
最近,使用数学和连续介质力学研究了肿瘤生长。因此,血管肿瘤(由血管形成)被视为由粘性细胞和填充细胞可以生长的空间的有机液体形成的固体骨架的汞齐。[13]在这种类型的模型下,可以处理机械应力和应变,并且阐明它们对肿瘤生长和周围组织和脉管系统的影响。使用该模型的实验的最新发现表明,肿瘤的活跃生长局限于肿瘤的外缘,并且潜在的正常组织的硬化也抑制了肿瘤的生长[14]。
然而,与组织的异常增殖无关的良性病症(例如皮脂腺囊肿)也可以作为肿瘤存在,但是没有恶性潜能。乳腺囊肿(通常在怀孕期间和其他时间发生)是另一个例子,其他囊封腺体肿胀(甲状腺,肾上腺,胰腺)也是如此。
包裹的血肿,包裹的坏死组织(来自昆虫叮咬,异物或其他有害机制),瘢痕疙瘩(瘢痕组织的离散过度生长)和肉芽肿也可以作为肿瘤存在。
由于流出阻塞或狭窄或异常连接导致的正常结构(输尿管,血管,肝内或肝外胆管,肺内含物或胃肠复制)的离散局部扩大也可能表现为肿瘤。实例是动静脉瘘或动脉瘤(有或没有血栓形成),胆瘘或动脉瘤,硬化性胆管炎,囊尾蚴病或包虫囊肿,肠复制,以及囊性纤维化所见的肺内含物。对多种类型的肿瘤进行活组织检查可能是危险的,其中其内容物的泄漏可能是灾难性的。当遇到这种类型的肿瘤时,在活组织检查或手术探查/切除之前(或期间)采用诸如超声,CT扫描,MRI,血管造影和核医学扫描的诊断方式,以试图避免这种严重的并发症。
通过成像,通过手术探查或由病理学家在检查来自活组织检查或手术标本的组织后确定肿瘤的性质。
恶性肿瘤
DNA损伤
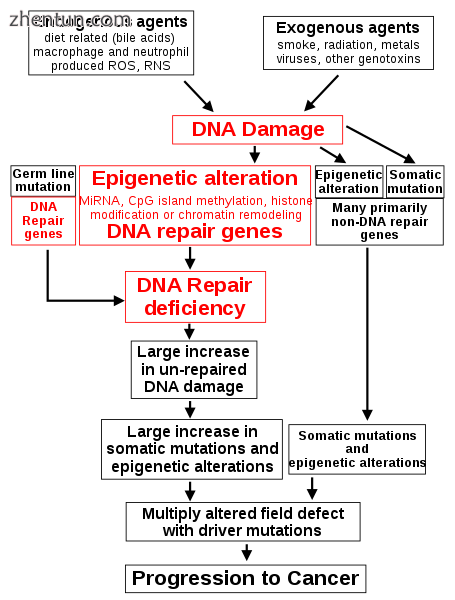
DNA损伤和表观遗传缺陷在恶性肿瘤DNA修复基因中的核心作用
DNA损伤被认为是被称为癌症的恶性肿瘤的主要根本原因。[15] [16]其在癌症发展中的核心作用在本节的图中,顶部附近的框中说明。 (DNA损伤的中心特征,表观遗传改变和癌症进展中缺乏的DNA修复以红色显示。)DNA损伤非常常见。自然发生的DNA损伤(主要是由于细胞代谢和体温下水中DNA的特性)以每天每个人类细胞超过60,000个新损伤的速度发生[15] [也见文章DNA损伤(自然发生) ]。暴露于外源性药剂可能导致额外的DNA损伤。烟草烟雾导致外源DNA损伤增加,这些DNA损伤可能是吸烟导致肺癌的原因。[17]来自太阳辐射的紫外线会导致DNA损伤,这在黑素瘤中很重要。[18]幽门螺杆菌感染会产生高水平的活性氧,会破坏DNA并导致胃癌。[19]高脂肪饮食的人体结肠中胆汁酸含量很高,也会导致DNA损伤并导致结肠癌。[20] Katsurano等。表明发炎的结肠上皮细胞中的巨噬细胞和中性粒细胞是活性氧的来源,导致DNA损伤引发结肠肿瘤发生。[21]本节顶部的方框中显示了一些DNA损伤来源。
具有导致34个DNA修复基因缺陷的种系突变的个体(参见文章DNA修复缺陷症)患癌症的风险增加。 DNA修复基因中的一些种系突变导致癌症的终生几率高达100%(例如,p53突变)。[22]这些种系突变显示在图左侧的方框中,箭头表示它们对DNA修复缺陷的贡献。
大约70%的恶性肿瘤没有遗传性成分,被称为“散发性癌症”。[23]由于DNA修复基因的突变,只有少数散发性癌症缺乏DNA修复。然而,由于表观遗传改变减少或沉默DNA修复基因表达,大多数散发性癌症缺乏DNA修复。例如,在113个连续的结肠直肠癌中,只有4个在DNA修复基因MGMT中具有错义突变,而由于MGMT启动子区域的甲基化(表观遗传改变),大多数具有降低的MGMT表达[24]。五份报告提供证据表明,由于MGMT启动子区域的甲基化,40%至90%的结肠直肠癌已降低MGMT表达[25] [26] [27] [28] [29]。
同样,在缺乏DNA修复基因PMS2表达的119例错配修复缺陷型结直肠癌中,由于PMS2基因突变,PMS2缺失6例,而103例PMS2表达缺乏,因为其配对伴侣MLH1被抑制到期启动子甲基化(PMS2蛋白在没有MLH1的情况下不稳定)。[30]在另外10例中,PMS2表达的丧失可能是由于microRNA-miR-155的表观遗传过度表达,miR-155下调MLH1 [31]。
在进一步的实例中,对于DNA修复基因BRCA1,WRN,FANCB,FANCF,MGMT,MLH1,MSH2,MSH4,ERCC1,XPF,NEIL1和ATM,在13%-100%的频率下发现表观遗传缺陷。这些表观遗传缺陷发生在各种癌症(例如乳腺癌,卵巢癌,结肠直肠癌和头颈癌)中。在Facista等人评估的49种结肠癌的大多数中,ERCC1,XPF或PMS2的表达中有两到三个缺陷同时发生[32]。导致DNA修复基因表达降低的表观遗传改变显示在本节中图的顶部第三级的中央框中,并且随后的DNA修复缺陷显示在第四级。
当DNA修复基因的表达降低时,DNA损伤在细胞中以高于正常水平积累,并且这些过量损伤导致突变或表观突变的频率增加。 DNA错配修复[33] [34]或同源重组修复(HRR)缺陷细胞的突变率强烈增加[35]。
在修复DNA双链断裂或修复其他DNA损伤期间,未完全清除的修复位点可导致表观遗传基因沉默。[36] [37] DNA修复缺陷(图中的4级)导致DNA损伤增加(图中的5级),导致体细胞突变和表观遗传改变增加(图中的6级)。
现场缺陷,具有多种改变的正常出现的组织(并在下面的部分中讨论)是在恶性肿瘤中发展组织的无序和不正常增殖克隆的常见前体。这种田间缺陷(图中底部的第二层)可能具有多个突变和表观遗传改变。
一旦癌症形成,它通常具有基因组不稳定性。这种不稳定性可能是由于DNA修复减少或DNA损伤过度造成的。由于这种不稳定性,癌症继续发展并产生亚克隆。例如,在9个区域取样的肾癌有40个无处不在的突变,表明肿瘤异质性(即存在于癌症的所有区域),59个突变由一些(但不是所有区域)共享,仅29个“私人”突变目前在癌症的一个领域。[38]
视野缺陷
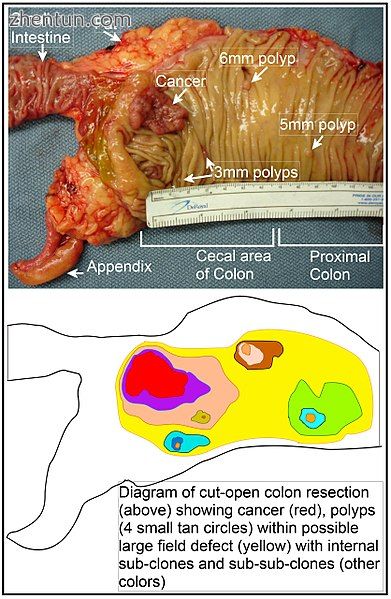
纵向打开的新切除的结肠段显示癌症和四个息肉,加上示意图,表明在该结肠段中可能的视野缺陷(在癌症发展之前和易于发生癌症的组织区域)。该图显示了作为肿瘤前体的亚克隆和亚亚克隆。
已经使用各种其他术语来描述这种现象,包括“场效应”,“场致癌”和“场癌发生”。 1953年首次使用术语“野外癌症”来描述已被(当时)大部分未知过程预处理的上皮区域或“区域”,以使其易于发展为癌症。[39]从那时起,术语“场致癌”和“场缺陷”已被用于描述可能出现新癌症的恶变前组织。
视野缺陷对于癌症的发展很重要。[40] [41]然而,在大多数癌症研究中,正如Rubin所指出[42]“绝大多数癌症研究的研究都是在体内定义明确的肿瘤或体外离散的肿瘤病灶上完成的。然而有证据表明,在终末克隆扩增开始之前,突变体表型人类结肠直肠肿瘤中发现的超过80%的体细胞突变发生[43]。同样,Vogelstein等[44]指出在肿瘤中发现的超过一半的体细胞突变发生在肿瘤前期(在外在缺陷中),在明显正常细胞的生长期间。同样地,肿瘤中存在的表观遗传改变可能发生在肿瘤前区域缺陷中。
扩大的视野效应被称为“病因场效应”,其不仅包括肿瘤前细胞的分子和病​​理变化,还包括外源环境因素和局部微环境中的分子变化对从肿瘤起始到患者的肿瘤演变的死亡影响。[45]
在结肠中,可能通过在结肠内表面上的一个肠隐窝的基部的干细胞中自然选择突变体或表观遗传改变的细胞来产生缺陷。突变或表观遗传改变的干细胞可通过自然选择取代附近的其他干细胞。因此,可能出现一片异常组织。本节中的图包括一张新切除的纵向开放的结肠段照片,显示结肠癌和四个息肉。在照片下方是一个示意图,显示了大片突变体或表观遗传学改变的细胞是如何形成的,如图中黄色的大面积所示。在该图中的第一个大片(细胞的大克隆)中,可能发生第二次这样的突变或表观遗传改变,使得给定的干细胞与贴剂内的其他干细胞相比具有优势,并且这种改变的干细胞可以扩展克隆地在原始补丁内形成二级补丁或亚克隆。这在图中由大黄色原始区域内的四个不同颜色的较小块补偿表示。在这些新的贴片(亚克隆)中,该过程可以重复多次,由四个二级贴片内的更小的贴片(图中仍然具有不同的颜色)指示,这些贴片克隆地扩展,直到干细胞出现产生小的息肉或恶性肿瘤(癌症)。
在照片中,这段结肠中的明显视野缺陷产生了四个息肉(标记为息肉的大小,6mm,5mm和两个3mm,以及最长尺寸约3cm的癌症)。这些肿瘤也在照片下方的图中用4个小的棕褐色圆圈(息肉)和较大的红色区域(癌症)表示。照片中的癌症发生在结肠的盲肠区域,其中结肠连接小肠(标记的)和阑尾发生的位置(标记)。照片中的脂肪位于结肠外壁的外部。在此处所示的结肠段中,将结肠纵向切开以暴露结肠的内表面并显示在结肠的内上皮衬里内发生的癌症和息肉。
如果出现散发性结肠癌的一般过程是形成肿瘤前克隆,通过自然选择传播,然后在初始克隆内形成内部亚克隆,并在其中形成亚亚克隆,然后结肠癌通常应该与反映恶化前事件的连续性的异常增加的领域相关联,并且在其之前。最广泛的异常区域(图中最外面的黄色不规则区域)将反映最早形成恶性肿瘤的事件。
在对癌症中特定DNA修复缺陷的实验评估中,还显示许多特定的DNA修复缺陷发生在围绕这些癌症的视野缺陷中。下面的表格给出了一个实例,其中显示癌症中的DNA修复缺陷是由表观遗传改变引起的,并且在周围的田间缺陷中发现相同的表观遗传学引起的DNA修复缺陷的频率稍低。
在打开的结肠段的照片中显示的视野缺陷中的一些小息肉可能是相对良性的肿瘤。在结肠镜检查中发现小于10mm的息肉,随后重复结肠镜检查3年,25%的大小没有变化,35%的大小退化或缩小,40%的大小增加。[53]
基因组不稳定
已知癌症表现出基因组不稳定性或突变体表型。[54]核内的蛋白质编码DNA约占总基因组DNA的1.5%。[55]在这种蛋白质编码DNA(称为外显子组)中,乳腺或结肠的平均癌症可以有大约60到70个蛋白质改变突变,其中大约3或4个可能是“驱动”突变,其余的可能是“乘客“突变[44]然而,乳腺癌组织样本中整个基因组(包括非蛋白质编码区)的DNA序列突变平均数约为20,000。[56]在平均黑色素瘤组织样本中(其中黑色素瘤具有更高的外显子组突变频率[44]),DNA序列突变的总数约为80,000。[57]相比之下,人类世代(父母与孩子)之间整个基因组中约70个新突变的极低突变频率。[58] [59]
癌症中总核苷酸序列中的高频率突变表明,导致癌症的田间缺陷的早期改变(例如本节图中的黄色区域)是DNA修复的缺陷。 Facista等人[32]显示了围绕结肠癌的大视野缺陷(延伸到癌症每侧约10厘米)。经常在田间缺陷的整个区域中有2或3个DNA修复蛋白(ERCC1,XPF或PMS2)的表观遗传缺陷。 DNA修复的缺陷导致突变率增加。[33] [34] [35] DNA修复缺陷本身可以使DNA损伤积累,并且容易出错的跨部分合成超过其中一些损伤可能会导致突变。此外,这些累积的DNA损伤的错误修复可能会导致表观突变。这些新的突变或表观突变可以提供增殖优势,产生田间缺陷。尽管DNA修复基因中的突变/表观突变本身不具有选择性优势,但当细胞获得确实提供增殖优势的额外突变/表观突变时,它们可以作为细胞中的携带者携带。
词源
术语“肿瘤”是“肿瘤”的同义词。 “瘤形成”表示肿瘤/肿瘤形成的过程,该过程被称为“肿瘤”过程。 “neoplastic”这个词本身来自希腊语neo(“new”)和塑料(“形成,塑造”)。
术语“肿瘤”来自拉丁名词肿瘤,“肿胀” - 最终来自动词tumēre“膨胀”。在英联邦,通常使用拼写“肿瘤”,而在美国,这个词通常拼写为“肿瘤”。
在其医学意义上,“肿瘤”传统上意味着肉体的异常肿胀。罗马医学百科全书Celsus(公元前30年 - 公元38年)描述了急性炎症的四个主要征兆,如肿瘤,白斑,嗜血和红肿(肿胀,疼痛,发热和发红)。 (他的论文De Medicina是继可移动式印刷机发明后于1478年印制的第一本医学书籍。)
在当代英语中,“肿瘤”一词通常被用作囊性(液体充满)生长或实体肿瘤(癌性或非癌性)的同义词,[60]其他形式的肿胀通常被称为“肿胀”。[61]
相关术语通常出现在医学文献中,其中名词“肿胀”和“肿胀”(源自形容词“肿胀”[62])是非肿瘤性肿胀的当前医学术语。 这种类型的肿胀通常由外伤,感染和其他因素引起的炎症引起。
然而,肿瘤可能由肿瘤细胞过度生长以外的病症引起。 囊肿(如皮脂腺囊肿)也被称为肿瘤,即使它们没有肿瘤细胞。 这是医疗账单术语的标准(特别是在对尚未确定病理的增长进行时)。
另见:
icon Biology portal
icon Medicine portal
Somatic evolution in cancer
List of biological development disorders
Epidemiology of cancer
参考:
Birbrair A, Zhang T, Wang ZM, Messi ML, Olson JD, Mintz A, Delbono O (July 2014). "Type-2 pericytes participate in normal and tumoral angiogenesis". Am. J. Physiol., Cell Physiol. 307 (1): C25–38. doi:10.1152/ajpcell.00084.2014. PMC 4080181. PMID 24788248.
Cooper GM (1992). Elements of human cancer. Boston: Jones and Bartlett Publishers. p. 16. ISBN 978-0-86720-191-8.
Taylor, Elizabeth J. (2000). Dorland's Illustrated medical dictionary (29th ed.). Philadelphia: Saunders. p. 1184. ISBN 978-0721662541.
Stedman's medical dictionary (28th ed.). Philadelphia: Lippincott Williams & Wilkins. 2006. p. Neoplasm. ISBN 978-0781733908.
"II Neoplasms". International Statistical Classification of Diseases and Related Health Problems 10th Revision (ICD-10) Version for 2010. World Health Organization. Retrieved 19 June 2014.
Abrams, Gerald. "Neoplasia I". Retrieved 23 January 2012.
"Cancer - Activity 1 - Glossary, page 4 of 5". Archived from the original on 2008-05-09. Retrieved 2008-01-08.
Clone definition - Medical Dictionary definitions of popular medical terms easily defined on MedTerms
Lee ES, Locker J, Nalesnik M, Reyes J, Jaffe R, Alashari M, Nour B, Tzakis A, Dickman PS (January 1995). "The association of Epstein-Barr virus with smooth-muscle tumors occurring after organ transplantation". N. Engl. J. Med. 332 (1): 19–25. doi:10.1056/NEJM199501053320104. PMID 7990861.
"Pancreas Cancer: Glossary of Terms". Retrieved 2008-01-08.
"Tumor". Dorland's Illustrated Medical Dictionary (31st ed.). Saunders. 2007. ISBN 978-1-84972-348-0.
Asashima M, Oinuma T, Meyer-Rochow VB (1987). "Tumors in amphibia". Zoological Science. 4: 411–425.
Ambrosi D, Mollica F (2002). "On the mechanics of a growing tumor". International Journal of Engineering Science. 40 (12): 1297–316. doi:10.1016/S0020-7225(02)00014-9.
Volokh KY (September 2006). "Stresses in growing soft tissues". Acta Biomater. 2 (5): 493–504. doi:10.1016/j.actbio.2006.04.002. PMID 16793355.
Bernstein C, Prasad AR, Nfonsam V, Bernstei H (2013). "DNA Damage, DNA Repair and Cancer". New Research Directions in DNA Repair. pp. 413–65. doi:10.5772/53919. ISBN 978-953-51-1114-6.
Kastan MB (2008). "DNA damage responses: mechanisms and roles in human disease: 2007 G.H.A. Clowes Memorial Award Lecture". Mol. Cancer Res. 6 (4): 517–24. doi:10.1158/1541-7786.MCR-08-0020. PMID 18403632.
Cunningham FH, Fiebelkorn S, Johnson M, Meredith C (November 2011). "A novel application of the Margin of Exposure approach: segregation of tobacco smoke toxicants". Food Chem. Toxicol. 49 (11): 2921–33. doi:10.1016/j.fct.2011.07.019. PMID 21802474.
Kanavy HE, Gerstenblith MR (December 2011). "Ultraviolet radiation and melanoma". Semin Cutan Med Surg. 30 (4): 222–8. doi:10.1016/j.sder.2011.08.003. PMID 22123420.
Handa O, Naito Y, Yoshikawa T (2011). "Redox biology and gastric carcinogenesis: the role of Helicobacter pylori". Redox Rep. 16 (1): 1–7. doi:10.1179/174329211X12968219310756. PMID 21605492.
Bernstein C, Holubec H, Bhattacharyya AK, Nguyen H, Payne CM, Zaitlin B, Bernstein H (August 2011). "Carcinogenicity of deoxycholate, a secondary bile acid". Arch. Toxicol. 85 (8): 863–71. doi:10.1007/s00204-011-0648-7. PMC 3149672. PMID 21267546.
Katsurano M, Niwa T, Yasui Y, Shigematsu Y, Yamashita S, Takeshima H, Lee MS, Kim YJ, Tanaka T, Ushijima T (January 2012). "Early-stage formation of an epigenetic field defect in a mouse colitis model, and non-essential roles of T- and B-cells in DNA methylation induction". Oncogene. 31 (3): 342–51. doi:10.1038/onc.2011.241. PMID 21685942.
Malkin D (April 2011). "Li-fraumeni syndrome". Genes Cancer. 2 (4): 475–84. doi:10.1177/1947601911413466. PMC 3135649. PMID 21779515.
Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, Pukkala E, Skytthe A, Hemminki K (July 2000). "Environmental and heritable factors in the causation of cancer--analyses of cohorts of twins from Sweden, Denmark, and Finland". N. Engl. J. Med. 343 (2): 78–85. doi:10.1056/NEJM200007133430201. PMID 10891514.
Halford S, Rowan A, Sawyer E, Talbot I, Tomlinson I (June 2005). "O(6)-methylguanine methyltransferase in colorectal cancers: detection of mutations, loss of expression, and weak association with G:C>A:T transitions". Gut. 54 (6): 797–802. doi:10.1136/gut.2004.059535. PMC 1774551. PMID 15888787.
Shen L, Kondo Y, Rosner GL, Xiao L, Hernandez NS, Vilaythong J, Houlihan PS, Krouse RS, Prasad AR, Einspahr JG, Buckmeier J, Alberts DS, Hamilton SR, Issa JP (September 2005). "MGMT promoter methylation and field defect in sporadic colorectal cancer". J. Natl. Cancer Inst. 97 (18): 1330–8. doi:10.1093/jnci/dji275. PMID 16174854.
Psofaki V, Kalogera C, Tzambouras N, Stephanou D, Tsianos E, Seferiadis K, Kolios G (July 2010). "Promoter methylation status of hMLH1, MGMT, and CDKN2A/p16 in colorectal adenomas". World J. Gastroenterol. 16 (28): 3553–60. doi:10.3748/wjg.v16.i28.3553. PMC 2909555. PMID 20653064.
Lee KH, Lee JS, Nam JH, Choi C, Lee MC, Park CS, Juhng SW, Lee JH (October 2011). "Promoter methylation status of hMLH1, hMSH2, and MGMT genes in colorectal cancer associated with adenoma-carcinoma sequence". Langenbecks Arch Surg. 396 (7): 1017–26. doi:10.1007/s00423-011-0812-9. PMID 21706233.
Amatu A, Sartore-Bianchi A, Moutinho C, Belotti A, Bencardino K, Chirico G, Cassingena A, Rusconi F, Esposito A, Nichelatti M, Esteller M, Siena S (April 2013). "Promoter CpG island hypermethylation of the DNA repair enzyme MGMT predicts clinical response to dacarbazine in a phase II study for metastatic colorectal cancer". Clin. Cancer Res. 19 (8): 2265–72. doi:10.1158/1078-0432.CCR-12-3518. PMID 23422094.
Mokarram P, Zamani M, Kavousipour S, Naghibalhossaini F, Irajie C, Moradi Sarabi M, et al. (May 2013). "Different patterns of DNA methylation of the two distinct O6-methylguanine-DNA methyltransferase (O6-MGMT) promoter regions in colorectal cancer". Mol. Biol. Rep. 40 (5): 3851–7. doi:10.1007/s11033-012-2465-3. PMID 23271133.
Truninger K, Menigatti M, Luz J, Russell A, Haider R, Gebbers JO, et al. (May 2005). "Immunohistochemical analysis reveals high frequency of PMS2 defects in colorectal cancer". Gastroenterology. 128 (5): 1160–71. doi:10.1053/j.gastro.2005.01.056. PMID 15887099.
Valeri N, Gasparini P, Fabbri M, Braconi C, Veronese A, Lovat F, et al. (April 2010). "Modulation of mismatch repair and genomic stability by miR-155". Proc. Natl. Acad. Sci. U.S.A. 107 (15): 6982–7. doi:10.1073/pnas.1002472107. PMC 2872463. PMID 20351277.
Facista A, Nguyen H, Lewis C, Prasad AR, Ramsey L, Zaitlin B, et al. (2012). "Deficient expression of DNA repair enzymes in early progression to sporadic colon cancer". Genome Integr. 3 (1): 3. doi:10.1186/2041-9414-3-3. PMC 3351028. PMID 22494821.
Narayanan L, Fritzell JA, Baker SM, Liskay RM, Glazer PM (April 1997). "Elevated levels of mutation in multiple tissues of mice deficient in the DNA mismatch repair gene Pms2". Proc. Natl. Acad. Sci. U.S.A. 94 (7): 3122–7. doi:10.1073/pnas.94.7.3122. PMC 20332. PMID 9096356.
Hegan DC, Narayanan L, Jirik FR, Edelmann W, Liskay RM, Glazer PM (December 2006). "Differing patterns of genetic instability in mice deficient in the mismatch repair genes Pms2, Mlh1, Msh2, Msh3 and Msh6". Carcinogenesis. 27 (12): 2402–8. doi:10.1093/carcin/bgl079. PMC 2612936. PMID 16728433.
Tutt AN, van Oostrom CT, Ross GM, van Steeg H, Ashworth A (March 2002). "Disruption of Brca2 increases the spontaneous mutation rate in vivo: synergism with ionizing radiation". EMBO Rep. 3 (3): 255–60. doi:10.1093/embo-reports/kvf037. PMC 1084010. PMID 11850397.
O'Hagan HM, Mohammad HP, Baylin SB (2008). Lee JT (ed.). "Double strand breaks can initiate gene silencing and SIRT1-dependent onset of DNA methylation in an exogenous promoter CpG island". PLoS Genet. 4 (8): e1000155. doi:10.1371/journal.pgen.1000155. PMC 2491723. PMID 18704159.
Cuozzo C, Porcellini A, Angrisano T, Morano A, Lee B, Di Pardo A, Messina S, Iuliano R, Fusco A, Santillo MR, Muller MT, Chiariotti L, Gottesman ME, Avvedimento EV (July 2007). "DNA damage, homology-directed repair, and DNA methylation". PLoS Genet. 3 (7): e110. doi:10.1371/journal.pgen.0030110. PMC 1913100. PMID 17616978.
Gerlinger M, Rowan AJ, Horswell S, Larkin J, Endesfelder D, Gronroos E, et al. (March 2012). "Intratumor heterogeneity and branched evolution revealed by multiregion sequencing". N. Engl. J. Med. 366 (10): 883–92. doi:10.1056/NEJMoa1113205. PMC 4878653. PMID 22397650.
Slaughter DP, Southwick HW, Smejkal W (September 1953). "Field cancerization in oral stratified squamous epithelium; clinical implications of multicentric origin". Cancer. 6 (5): 963–8. doi:10.1002/1097-0142(195309)6:5<963::AID-CNCR2820060515>3.0.CO;2-Q. PMID 13094644.
Bernstein C, Bernstein H, Payne CM, Dvorak K, Garewal H (February 2008). "Field defects in progression to gastrointestinal tract cancers". Cancer Lett. 260 (1–2): 1–10. doi:10.1016/j.canlet.2007.11.027. PMC 2744582. PMID 18164807.
Nguyen H, Loustaunau C, Facista A, Ramsey L, Hassounah N, Taylor H, Krouse R, Payne CM, Tsikitis VL, Goldschmid S, Banerjee B, Perini RF, Bernstein C (2010). "Deficient Pms2, ERCC1, Ku86, CcOI in field defects during progression to colon cancer". J Vis Exp (41): 1931. doi:10.3791/1931. PMC 3149991. PMID 20689513.
Rubin H (March 2011). "Fields and field cancerization: the preneoplastic origins of cancer: asymptomatic hyperplastic fields are precursors of neoplasia, and their progression to tumors can be tracked by saturation density in culture". BioEssays. 33 (3): 224–31. doi:10.1002/bies.201000067. PMID 21254148.
Tsao JL, Yatabe Y, Salovaara R, Järvinen HJ, Mecklin JP, Aaltonen LA, Tavaré S, Shibata D (February 2000). "Genetic reconstruction of individual colorectal tumor histories". Proc. Natl. Acad. Sci. U.S.A. 97 (3): 1236–41. doi:10.1073/pnas.97.3.1236. PMC 15581. PMID 10655514.
Vogelstein B, Papadopoulos N, Velculescu VE, Zhou S, Diaz LA, Kinzler KW (March 2013). "Cancer genome landscapes". Science. 339 (6127): 1546–58. doi:10.1126/science.1235122. PMC 3749880. PMID 23539594.
Lochhead P, Chan AT, Nishihara R, Fuchs CS, Beck AH, Giovannucci E, Ogino S (2014). "Etiologic field effect: reappraisal of the field effect concept in cancer predisposition and progression". Mod Pathol. 28 (1): 14–29. doi:10.1038/modpathol.2014.81. PMC 4265316. PMID 24925058.
Svrcek M, Buhard O, Colas C, Coulet F, Dumont S, Massaoudi I, et al. (November 2010). "Methylation tolerance due to an O6-methylguanine DNA methyltransferase (MGMT) field defect in the colonic mucosa: an initiating step in the development of mismatch repair-deficient colorectal cancers". Gut. 59 (11): 1516–26. doi:10.1136/gut.2009.194787. PMID 20947886.
Paluszczak J, Misiak P, Wierzbicka M, Woźniak A, Baer-Dubowska W (February 2011). "Frequent hypermethylation of DAPK, RARbeta, MGMT, RASSF1A and FHIT in laryngeal squamous cell carcinomas and adjacent normal mucosa". Oral Oncol. 47 (2): 104–7. doi:10.1016/j.oraloncology.2010.11.006. PMID 21147548.
Zuo C, Zhang H, Spencer HJ, Vural E, Suen JY, Schichman SA, Smoller BR, Kokoska MS, Fan CY (October 2009). "Increased microsatellite instability and epigenetic inactivation of the hMLH1 gene in head and neck squamous cell carcinoma". Otolaryngol Head Neck Surg. 141 (4): 484–90. doi:10.1016/j.otohns.2009.07.007. PMID 19786217.
Tawfik HM, El-Maqsoud NM, Hak BH, El-Sherbiny YM (2011). "Head and neck squamous cell carcinoma: mismatch repair immunohistochemistry and promoter hypermethylation of hMLH1 gene". Am J Otolaryngol. 32 (6): 528–36. doi:10.1016/j.amjoto.2010.11.005. PMID 21353335.
Zou XP, Zhang B, Zhang XQ, Chen M, Cao J, Liu WJ (November 2009). "Promoter hypermethylation of multiple genes in early gastric adenocarcinoma and precancerous lesions". Hum. Pathol. 40 (11): 1534–42. doi:10.1016/j.humpath.2009.01.029. PMID 19695681.
Wani M, Afroze D, Makhdoomi M, Hamid I, Wani B, Bhat G, Wani R, Wani K (2012). "Promoter methylation status of DNA repair gene (hMLH1) in gastric carcinoma patients of the Kashmir valley". Asian Pac. J. Cancer Prev. 13 (8): 4177–81. doi:10.7314/APJCP.2012.13.8.4177. PMID 23098428.
Agarwal A, Polineni R, Hussein Z, Vigoda I, Bhagat TD, Bhattacharyya S, Maitra A, Verma A (2012). "Role of epigenetic alterations in the pathogenesis of Barrett's esophagus and esophageal adenocarcinoma". Int J Clin Exp Pathol. 5 (5): 382–96. PMC 3396065. PMID 22808291.
Hofstad B, Vatn MH, Andersen SN, Huitfeldt HS, Rognum T, Larsen S, Osnes M (September 1996). "Growth of colorectal polyps: redetection and evaluation of unresected polyps for a period of three years". Gut. 39 (3): 449–56. doi:10.1136/gut.39.3.449. PMC 1383355. PMID 8949653.
Schmitt MW, Prindle MJ, Loeb LA (September 2012). "Implications of genetic heterogeneity in cancer". Ann. N. Y. Acad. Sci. 1267: 110–6. doi:10.1111/j.1749-6632.2012.06590.x. PMC 3674777. PMID 22954224.
Lander ES, Linton LM, Birren B, Nusbaum C, Zody MC, Baldwin J, Devon K, Dewar K, Doyle M, FitzHugh W, et al. (February 2001). "Initial sequencing and analysis of the human genome". Nature. 409 (6822): 860–921. doi:10.1038/35057062. PMID 11237011.
Yost SE, Smith EN, Schwab RB, Bao L, Jung H, Wang X, Voest E, Pierce JP, Messer K, Parker BA, Harismendy O, Frazer KA (August 2012). "Identification of high-confidence somatic mutations in whole genome sequence of formalin-fixed breast cancer specimens". Nucleic Acids Res. 40 (14): e107. doi:10.1093/nar/gks299. PMC 3413110. PMID 22492626.
Berger MF, Hodis E, Heffernan TP, Deribe YL, Lawrence MS, Protopopov A, et al. (May 2012). "Melanoma genome sequencing reveals frequent PREX2 mutations". Nature. 485 (7399): 502–6. doi:10.1038/nature11071. PMC 3367798. PMID 22622578.
Roach JC, Glusman G, Smit AF, Huff CD, Hubley R, Shannon PT, et al. (April 2010). "Analysis of genetic inheritance in a family quartet by whole-genome sequencing". Science. 328 (5978): 636–9. doi:10.1126/science.1186802. PMC 3037280. PMID 20220176.
Campbell CD, Chong JX, Malig M, Ko A, Dumont BL, Han L, et al. (November 2012). "Estimating the human mutation rate using autozygosity in a founder population". Nat. Genet. 44 (11): 1277–81. doi:10.1038/ng.2418. PMC 3483378. PMID 23001126.
Tumor in Medical Encyclopedia
"Swelling". MedlinePlus Medical Encyclopedia. October 14, 2012.
"tumescence". Oxford English Dictionary (3rd ed.). Oxford University Press. September 2005. (Subscription or UK public library membership required.) |