肌腱或筋是纤维结缔组织的坚韧带,通常将肌肉与骨骼连接并且能够承受张力。
肌腱与韧带相似; 两者都是由胶原蛋白制成。 韧带将一块骨头连接到骨骼上,而肌腱将肌肉与骨骼连接起来,以使身体正常运作。
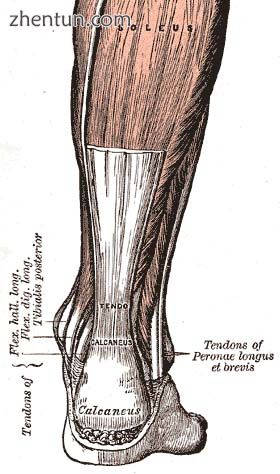
跟腱,是人体肌腱之一
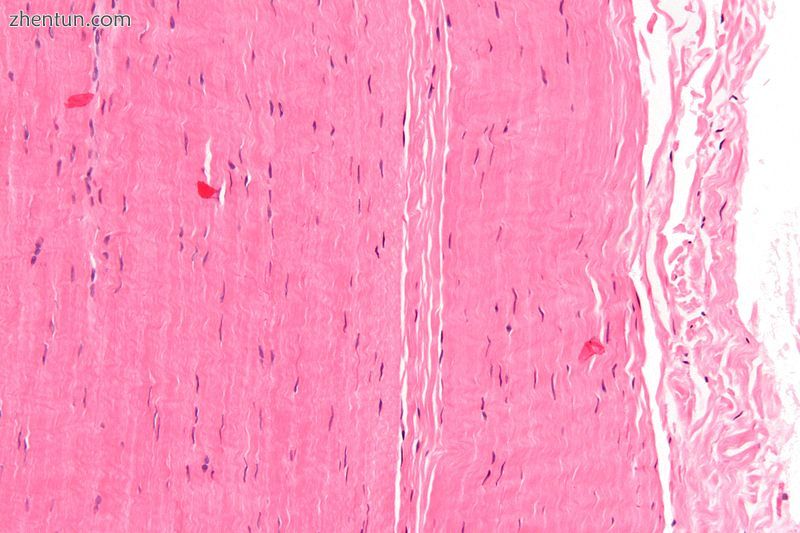
一块肌腱的显微照片; H&E
目录
1 结构
2 功能
2.1 力学
2.2 治疗
2.2.1 活动对愈合的影响
3 社会与文化
3.1 烹饪用途
4 临床意义
4.1 损伤
5 其他动物
6 参考
结构
在组织学上,肌腱由密集的规则结缔组织束组成,包裹在致密的不规则结缔组织鞘中。正常健康的肌腱主要由紧密堆积在一起的平行的胶原纤维阵列组成。它们被大量分布的纤维固定在骨头上。正常肌腱的干质量占其总质量的约30%,由约86%的胶原蛋白,2%的弹性蛋白,1-5%的蛋白多糖和0.2%的无机成分如铜,锰和钙组成。 [1] [2]胶原蛋白部分由97-98%的I型胶原蛋白和少量其他类型的胶原蛋白组成。这些包括软骨区的II型胶原,血管壁的网状纤维中的III型胶原,IX型胶原,毛细血管基底膜中的IV型胶原,血管壁中的V型胶原,以及X型胶原。与骨骼界面附近的矿化纤维软骨[1] [3]
胶原纤维聚结成大颗粒。在从细胞分泌后,由原胶原N-和C-蛋白酶切割,并且原胶原分子自发地组装成不溶性原纤维。胶原分子长约300nm,宽1-2nm,并且形成的原纤维的直径可以在50-500nm的范围内。在肌腱中,原纤维然后进一步组装形成束,其长度为约10mm,直径为50-300μm,最后形成直径为100-500μm的肌腱纤维。[4]束缚由内腱结合,内膜是一种含有薄胶原纤维的脆弱结缔组织。[5] [6]和弹性纤维。[7]束的组由限制因子限制。在肌腱所在的筋膜内填充间质是一种脂肪乳晕组织。[8]
肌腱中的胶原蛋白与蛋白多糖(由结合糖胺聚糖的蛋白质组成的化合物,特别是存在于结缔组织中)组成,包括核心蛋白聚糖,并且在肌腱的压缩区域中,聚集蛋白聚糖,其能够结合胶原原纤维。具体地点。[9]蛋白多糖与胶原纤维交织在一起 - 它们的糖胺聚糖(GAG)侧链与原纤维表面有多种相互作用 - 表明蛋白多糖在结构上与原纤维相互连接是重要的。[10]肌腱的主要GAG组分是硫酸皮肤素和硫酸软骨素,其与胶原结合并且在肌腱发育期间参与原纤维组装过程。硫酸皮肤素被认为是造成原纤维之间关联的原因,而硫酸软骨素被认为更多地涉及原纤维之间的占据体积,以保持它们分离并有助于抵抗变形。[11]核心蛋白聚糖的硫酸皮肤素侧链在溶液中聚集,并且这种行为可以帮助组装胶原原纤维。当核心蛋白聚糖分子与胶原纤维结合时,它们的硫酸皮肤素链可以延伸并与核心蛋白聚糖上的其他硫酸皮肤素链结合,所述核心蛋白聚糖与分离的原纤维结合,因此产生纤维间桥并最终导致原纤维平行排列。[12]
肌腱细胞产生胶原分子,其端对端和侧对侧聚集以产生胶原原纤维。组织原纤维束以形成纤维,细长的肌腱细胞紧密地包裹在它们之间。存在与肌腱中的胶原相关的细胞过程的三维网络。这些信号通过间隙连接相互通信,这种信号使它们能够检测并响应机械负载。[13]
血管可以在与胶原纤维平行的内膜中显现,偶尔分支横向吻合。
内部肌腱体被认为不包含神经纤维,但是上皮和腱周组织包含神经末梢,而高尔基肌腱器官存在于肌腱和肌肉之间的交界处。
所有主要群体和人与人之间的肌腱长度不同。实际上,肌腱长度是关于实际和潜在肌肉大小的决定因素。例如,所有其他相关的生物学因素相同,肌腱较短且肱二头肌较长的男性肌肉质量的潜力大于肌腱较长且肌肉较短的男性。成功的健美运动员通常会有较短的肌腱。相反,在要求运动员在跑步或跳跃等方面表现出色的运动中,有一个比平均跟腱更短和更短的小腿肌肉是有益的。[14]
肌腱长度由遗传易感性决定,并且未显示出对环境的反应增加或减少,与肌肉不同,肌肉可以通过创伤缩短,使用不平衡和缺乏恢复和伸展。[15]
功能
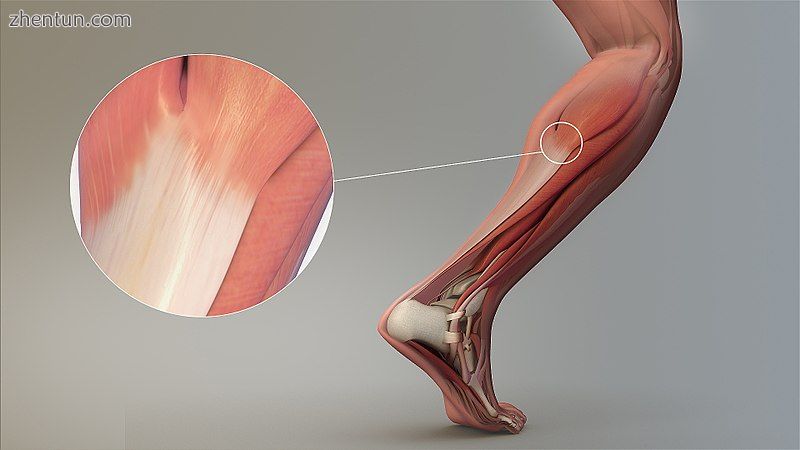
肌腱的放大视图。
传统上,肌腱被认为是肌肉连接到骨骼以及肌肉本身的机制,其功能是传递力。这种连接允许肌腱在运动期间被动地调节力,提供额外的稳定性而无需主动工作。然而,在过去的二十年中,许多研究都集中在一些肌腱的弹性和它们作为弹簧起作用的能力上。并非所有的肌腱都需要发挥相同的功能作用,其中一些主要是定位肢体,例如手指时的手指(位置肌腱)和其他作为弹簧的弹簧,以使运动更有效(储能肌腱)。[16]储能筋可以高效储存和回收能量。例如,在人类步幅期间,跟腱延伸为踝关节背屈。在步幅的最后部分期间,当脚足底弯曲(指向脚趾向下)时,释放存储的弹性能量。此外,由于肌腱伸展,肌肉能够在长度变化较小或甚至没有变化的情况下发挥作用,从而使肌肉产生更大的力。
肌腱的机械性能取决于胶原纤维的直径和方向。胶原原纤维彼此平行且紧密堆积,但由于平面起伏或卷曲,在几微米的尺度上显示出波浪状外观。[17]在肌腱中,胶原纤维具有一定的柔韧性,因为在氨基酸序列中的特定位置不存在羟脯氨酸和脯氨酸残基,这允许在三螺旋中形成其他构象,例如弯曲或内环,并导致其发展。卷曲。[18]胶原纤维中的卷曲允许肌腱具有一定的柔韧性以及低的压缩刚度。此外,由于肌腱是由许多部分独立的原纤维和束组成的多链结构,因此它不像单个杆那样,这种性质也有助于其灵活性。[19]
肌腱的蛋白多糖组分对机械性质也很重要。虽然胶原纤维允许肌腱抵抗拉伸应力,但蛋白聚糖允许它们抵抗压缩应力。这些分子非常亲水,这意味着它们可以吸收大量的水,因此具有高溶胀比。由于它们与原纤维非共价结合,因此它们可以可逆地缔合和解离,从而可以破坏和重新形成原纤维之间的桥。这个过程可能涉及使原纤维伸长并在张力下直径减小。[20]然而,蛋白多糖也可能在肌腱的拉伸性质中起作用。肌腱的结构实际上是纤维复合材料,构建为一系列层级。在层次结构的每个层面,胶原蛋白单元通过胶原交联或蛋白多糖结合在一起,形成高度抗拉伸负荷的结构。[21]在相同的应力下,单独的胶原纤维的伸长率和应变已经显示出远低于整个肌腱的总伸长率和应变,这表明富含蛋白多糖的基质也必须经历变形,并且硬化。基质在高应变率下发生。[22]非胶原基质的这种变形发生在肌腱层次的所有层面,并且通过调节该基质的组织和结构,可以实现不同肌腱所需的不同机械性能。[23]能量储存肌腱已被证明在束之间利用大量滑动以实现它们所需的高应变特性,而位置肌腱更依赖于胶原纤维和原纤维之间的滑动。[24]然而,最近的数据表明,储能肌腱还可能包含本质上扭曲或螺旋状的束 - 这种布置对于提供这些肌腱所需的类似弹簧的行为非常有益。[25]
机械学
主要文章:软组织
肌腱是粘弹性结构,这意味着它们表现出弹性和粘性行为。当拉伸时,肌腱表现出典型的“软组织”行为。力 - 伸展或应力 - 应变曲线始于非常低的刚度区域,因为卷曲结构伸直,胶原纤维排列,表明肌腱纤维中的负泊松比。[26]最近,在体内(通过MRI)和离体(通过各种尸体肌腱组织的机械测试)进行的测试表明,健康肌腱具有高度各向异性,并且当伸展到2时,在一些平面中表现出负泊松比(拉胀作用)。沿着它们的长度的百分比,即在它们的正常运动范围内。[27]在这个“脚趾”区域之后,结构变得非常硬,并且具有线性应力 - 应变曲线,直到它开始失效。肌腱的机械性能变化很大,因为它们与肌腱的功能要求相匹配。储能筋往往更具弹性或更不僵硬,因此它们可以更容易地储存能量,而较硬的位置肌腱倾向于稍微更粘弹性,并且弹性较小,因此它们可以提供更精细的运动控制。典型的储能肌腱将在大约12-15%的应变下失效,并且应力在100-150MPa的范围内,尽管一些肌腱比这更明显更具伸展性,例如马中的表面数字屈肌,其伸展在在奔腾时超过20%。[28]位置性肌腱可能在低至6-8%的应变下失效,但在700-1000MPa的范围内可具有模量。[29]
一些研究表明肌腱对生长和重塑过程的机械负荷变化做出反应,就像骨骼一样。特别是,一项研究表明,在大鼠中废弃跟腱导致包含肌腱的胶原纤维束的平均厚度减少。[30]在人类中,人们接受模拟微重力环境的实验发现,即使受试者需要进行抗躁运动,肌腱僵硬度也会显著下降。[31]这些影响涉及从卧床患者的治疗到宇航员更有效的运动设计等方面。
恢复
脚中的肌腱非常复杂且复杂。因此,断筋的愈合过程是漫长而痛苦的。大多数在受伤前48小时内未接受医疗护理的人将在受伤发生时遭受严重的肿胀,疼痛和烧灼感。
据信,肌腱不能进行基质更新,并且肌腱细胞不能修复。然而,已经表明,在人的整个生命周期中,肌腱中的肌腱细胞主动合成基质成分以及诸如基质金属蛋白酶(MMP)的酶可以降解基质。[32]肌腱能够在受到肌腱细胞及其周围细胞外基质控制的过程中从损伤中愈合和恢复。
肌腱愈合的三个主要阶段是炎症,修复或增殖,以及重塑,其可以进一步分为巩固和成熟。这些阶段可以彼此重叠。在第一阶段,炎症细胞如嗜中性粒细胞与红细胞一起被募集到损伤部位。在最初的24小时内募集单核细胞和巨噬细胞,并且发生损伤部位的坏死物质的吞噬作用。在血管活性和趋化因子释放后,开始血管生成和肌腱细胞的增殖。然后肌腱细胞进入该部位并开始合成胶原蛋白III。[33] [34]几天后,修复或增殖阶段开始。在这个阶段,肌腱细胞在损伤部位参与大量胶原蛋白和蛋白多糖的合成,GAG和水的含量很高。[35]大约六周后,重塑阶段开始。这一阶段的第一部分是巩固,持续时间为伤后约六至十周。在此期间,胶原蛋白和GAG的合成减少,并且由于胶原蛋白I的产生增加导致组织变得更加纤维,细胞性也降低,并且原纤维在机械应力的方向上排列。[34]最后的成熟阶段在十周后发生,并且在此期间,胶原原纤维的交联增加,这导致组织变硬。逐渐地,大约一年,组织将从纤维变成疤痕状。[35]
基质金属蛋白酶(MMPs)在肌腱损伤后的愈合过程中对ECM的降解和重塑具有非常重要的作用。某些MMP包括MMP-1,MMP-2,MMP-8,MMP-13和MMP-14具有胶原酶活性,这意味着与许多其他酶不同,它们能够降解胶原蛋白I原纤维。 MMP-1对胶原原纤维的降解以及变性胶原的存在是被认为会导致肌腱ECM减弱和导致另一次破裂的可能性增加的因素。[36]为了应对反复的机械负荷或损伤,细胞因子可能被肌腱细胞释放,并可诱导MMP释放,导致ECM降解并导致复发性损伤和慢性腱病[34]。
各种其他分子参与肌腱修复和再生。在肌腱愈合期间,有五种生长因子被证明显著上调和活跃:胰岛素样生长因子1(IGF-I),血小板衍生生长因子(PDGF),血管内皮生长因子(VEGF),碱性成纤维细胞生长因子(bFGF)和转化生长因子β(TGF-β)。[35]这些生长因子在愈合过程中都有不同的作用。 IGF-1在炎症的第一阶段增加胶原蛋白和蛋白多糖的产生,并且在损伤后的早期阶段也存在PDGF,并促进其他生长因子的合成以及DNA的合成和肌腱细胞的增殖[35]。已知TGF-β的三种同种型(TGF-β1,TGF-β2,TGF-β3)在伤口愈合和瘢痕形成中起作用[37]。众所周知,VEGF可促进血管生成并诱导内皮细胞增殖和迁移,已显示VEGF mRNA在肌腱损伤部位与胶原蛋白I mRNA一起表达[38]。骨形态发生蛋白(BMPs)是TGF-β超家族的亚组,其可以诱导骨和软骨形成以及组织分化,并且BMP-12特异性地已经显示出影响肌腱组织的形成和分化并促进纤维发生。
活动对愈合的影响
在动物模型中,已经进行了广泛的研究以研究机械应变以活动水平形式对肌腱损伤和愈合的影响。虽然拉伸可以在最初的炎症阶段破坏愈合,但已经表明,在急性损伤后约一周后肌腱的受控运动可以有助于促进肌腱细胞合成胶原蛋白,导致拉伸强度和直径增加。愈合肌腱和粘连比固定的肌腱少。在慢性肌腱损伤中,机械负荷也被证明可以促进成纤维细胞增殖和胶原蛋白合成以及胶原蛋白的重新排列,所有这些都促进了修复和重塑。[35]为了进一步支持运动和活动有助于肌腱愈合的理论,已经表明,损伤后肌腱的固定通常对愈合具有负面影响。在兔子中,固定的胶原蛋白束已经显示出降低的拉伸强度,并且固定化也导致肌腱中水,蛋白多糖和胶原交联的量较低[33]。
已经提出了几种机械转导机制作为肌腱细胞对机械力的响应的原因,这使得它们能够改变它们的基因表达,蛋白质合成和细胞表型,并最终引起肌腱结构的变化。一个主要因素是细胞外基质的机械变形,其可以影响肌动蛋白细胞骨架并因此影响细胞形状,运动性和功能。机械力可以通过粘着斑点,整合素和细胞 - 细胞连接传递。肌动蛋白细胞骨架的变化可以激活整联蛋白,其介导细胞和基质之间的“外向内”和“内向外”信号传导。诱导细胞内信号级联的G蛋白也很重要,通过拉伸激活离子通道以允许离子如钙,钠或钾进入细胞。[35]
社会与文化
Sinew在整个工业化时代被广泛用作坚韧耐用的纤维。一些特定的用途包括使用sinew作为缝纫线,将羽毛连接到箭头(参见fletch),将工具刀片绑在轴上等。在生存指南中也推荐使用它作为一种材料,可以为陷阱或物品等物品制作强力绳索。生活结构。必须以特定的方式对肌腱进行治疗才能有效地发挥作用。因纽特人和其他极地人使用肌腱作为所有家庭用途的唯一绳索,因为其生态栖息地缺乏其他合适的纤维来源。特定肌腱的弹性特性也用于欧亚大陆草原游牧民族和美洲原住民所偏爱的复合弯曲弓。第一个投掷石头的火炮也使用了肌腱的弹性。
Sinew制造出一种优质的绳索材料有三个原因:它非常坚固,含有天然胶水,随着干燥而收缩,不需要打结。
烹饪用途
主要文章:肌腱(餐)
Tendon(特别是牛筋)在一些亚洲美食中被用作食物(通常在yum cha或点心餐厅供应)。一种受欢迎的菜是suan bao niu jin,其中肌腱用大蒜腌制。有时也会在越南面条phở中找到它。
临床意义
损伤
肌腱受到多种伤害。由于过度使用,存在各种形式的肌腱病或肌腱损伤。这些类型的损伤通常会导致肌腱的炎症和退化或减弱,最终可能导致肌腱断裂。[33]肌腱病可由与肌腱细胞外基质(ECM)相关的许多因素引起,并且它们的分类很困难,因为它们的症状和组织病理学通常是相似的。
第一类肌腱病是腱鞘炎,指的是腱周组织的炎症,或位于肌腱和鞘之间的腱周的片。肌腱病是指细胞水平的肌腱非炎性损伤。这种降解是由胶原蛋白,细胞和肌腱血管成分的损伤引起的,并且已知会导致破裂。[39]对经历过自发性破裂的肌腱的观察显示,胶原纤维的存在不是正确的平行方向,或者长度或直径不均匀,还有圆形肌腱细胞,其他细胞异常和血管向内生长[33]。 ]未导致破裂的其他形式的肌腱变性也显示出胶原原纤维的变性,定向障碍和变薄,以及原纤维之间的糖胺聚糖量的增加[34]。第三种是伴有肌腱变性的腱鞘炎,其中存在腱周炎症和肌腱变性的组合。最后一种是肌腱炎,指的是肌腱炎症引起的退化以及血管破坏。[1]
肌腱病可能由几个内在因素引起,包括年龄,体重和营养。外在因素通常与体育有关,包括过度的力量或负荷,不良的训练技术和环境条件。[32]
其他动物

来自怀俄明州埃德蒙顿龙骨床的骨化肌腱(Lance Formation)
在一些生物中,值得注意的是鸟类[40]和鸟类恐龙,[41]肌腱的部分可能会僵化。 在这个过程中,骨细胞渗入肌腱并像在髌骨等骨质骨中那样铺设骨骼。 在鸟类中,肌腱骨化主要发生在后肢,而在鸟臀肌恐龙中,骨化的轴肌肌腱沿着尾部的神经和血管刺形成网格,可能是为了支撑。
另见:
This article uses anatomical terminology; for an overview, see anatomical terminology.
Wikimedia Commons has media related to Tendons.
Aponeurosis
Cartilage
Chordae tendineae
List of muscles of the human body
Tendon sheath
参考:
Jozsa, L., and Kannus, P., Human Tendons: Anatomy, Physiology, and Pathology. Human Kinetics: Champaign, IL, 1997.
Lin, T. W.; Cardenas, L.; Soslowsky, L. J. (2004). "Biomechanics of tendon injury and repair". Journal of Biomechanics. 37 (6): 865–877. doi:10.1016/j.jbiomech.2003.11.005. PMID 15111074.
Fukuta, S.; Oyama, M.; Kavalkovich, K.; Fu, F. H.; Niyibizi, C. (1998). "Identification of types II, IX and X collagens at the insertion site of the bovine achilles tendon". Matrix Biology. 17 (1): 65–73. doi:10.1016/S0945-053X(98)90125-1. PMID 9628253.
Fratzl, P. (2009). "Cellulose and collagen: from fibres to tissues". Current Opinion in Colloid & Interface Science. 8 (1): 32–39. doi:10.1016/S1359-0294(03)00011-6.
Dorlands Medical Dictionary, page 602
Caldini, E. G.; Caldini, N.; De-Pasquale, V.; Strocchi, R.; Guizzardi, S.; Ruggeri, A.; Montes, G. S. (1990). "Distribution of elastic system fibres in the rat tail tendon and its associated sheaths". Cells Tissues Organs. 139 (4): 341–348. doi:10.1159/000147022. PMID 1706129.
Grant, T. M.; Thompson, M. S.; Urban, J.; Yu, J. (2013). "Elastic fibres are broadly distributed in tendon and highly localized around tenocytes". Journal of Anatomy. 222 (6): 573–579. doi:10.1111/joa.12048. PMC 3666236. PMID 23587025.
Dorlands Medical Dictionary 2012.Page 1382
Zhang, G. E., Y.; Chervoneva, I.; Robinson, P. S.; Beason, D. P.; Carine, E. T.; Soslowsky, L. J.; Iozzo, R. V.; Birk, D. E. (2006). "Decorin regulates assembly of collagen fibrils and acquisition of biomechanical properties during tendon development". Journal of Cellular Biochemistry. 98 (6): 1436–1449. doi:10.1002/jcb.20776. PMID 16518859.
Raspanti, M.; Congiu, T.; Guizzardi, S. (2002). "Structural Aspects of the Extracellular Matrix of the Tendon : An Atomic Force and Scanning Electron Microscopy Study". Archives of Histology and Cytology. 65 (1): 37–43. doi:10.1679/aohc.65.37. PMID 12002609.
Scott, J. E. O., C. R.; Hughes, E. W. (1981). "Proteoglycan-collagen arrangements in developing rat tail tendon. An electron microscopical and biochemical investigation". Biochemical Journal. 195 (3): 573–581. doi:10.1042/bj1950573. PMC 1162928. PMID 6459082.
Scott, J. E. (2003). "Elasticity in extracellular matrix 'shape modules' of tendon, cartilage, etc. A sliding proteoglycan-filament model". Journal of Physiology. 553 (2): 335–343. doi:10.1113/jphysiol.2003.050179. PMC 2343561. PMID 12923209.
McNeilly, C. M.; Banes, A. J.; Benjamin, M.; Ralphs, J. R. (1996). "Tendon cells in vivo form a three dimensional network of cell processes linked by gap junctions". Journal of Anatomy. 189 (Pt 3): 593–600. PMC 1167702. PMID 8982835.
"Having a short Achilles tendon may be an athlete's Achilles heel". Retrieved 2007-10-26.
Young, Michael. "A Review on Postural Realignment and its Muscular and Neural Components" (PDF).
Thorpe C.T., Birch H.L., Clegg P.D., Screen H.R.C. (2013). The role of the non-collagenous matrix in tendon function. Int J ExpPathol. 94;4: 248-59.
Hulmes, D. J. S. (2002). "Building Collagen Molecules, Fibrils, and Suprafibrillar Structures". Journal of Structural Biology. 137 (1–2): 2–10. doi:10.1006/jsbi.2002.4450. PMID 12064927.
Silver, F. H.; Freeman, J. W.; Seehra, G. P. (2003). "Collagen self-assembly and the development of tendon mechanical properties". Journal of Biomechanics. 36 (10): 1529–1553. doi:10.1016/S0021-9290(03)00135-0. PMID 14499302.
Ker, R. F. (2002). "The implications of the adaptable fatigue quality of tendons for their construction, repair and function". Comparative Biochemistry and Physiology A. 133 (4): 987–1000. doi:10.1016/S1095-6433(02)00171-X. PMID 12485688.
Cribb, A. M.; Scott, J.E. (1995). In Tendon response to tensile-stress - an ultrastructural investigation of collagen - proteoglycan interactions in stressed tendon,1995; Cambridge Univ Press.pp 423-428.
Screen H.R., Lee D.A., Bader D.L., Shelton J.C. (2004). "An investigation into the effects of the hierarchical structure of tendon fascicles on micromechanical properties". Proc Inst Mech Eng H. 218 (2): 109–119. doi:10.1243/095441104322984004. PMID 15116898.
Puxkandl, R.; Zizak, I.; Paris, O.; Keckes, J.; Tesch, W.; Bernstorff, S.; Purslow, P.; Fratzl, P. (2002). "Viscoelastic properties of collagen: synchrotron radiation investigations and structural model". Philosophical Transactions of the Royal Society B. 357 (1418): 191–197. doi:10.1098/rstb.2001.1033. PMC 1692933. PMID 11911776.
Gupta H.S., Seto J., Krauss S., Boesecke P.& Screen H.R.C. (2010). In situ multi-level analysis of viscoelastic deformation mechanisms in tendon collagen. J. Struct. Biol. 169(2):183-191.
Thorpe C.T; Udeze C.P; Birch H.L.; Clegg P.D.; Screen H.R.C. (2012). "Specialisation of tendon mechanical properties results from inter-fascicular differences". J Roy Soc Int. 9 (76): 3108–3117. doi:10.1098/rsif.2012.0362. PMC 3479922. PMID 22764132.
Thorpe C.T.; Klemt C; Riley G.P.; Birch H.L.; Clegg P.D.; Screen H.R.C. (2013). "Helical sub-structures in energy-storing tendons provide a possible mechanism for efficient energy storage and return". Acta Biomater. 9 (8): 7948–56. doi:10.1016/j.actbio.2013.05.004. PMID 23669621.
Herchenhan, Andreas; Kalson, Nicholas S.; Holmes, David F.; Hill, Patrick; Kadler, Karl E.; Margetts, Lee (2011-07-07). "Tenocyte contraction induces crimp formation in tendon-like tissue". Biomechanics and Modeling in Mechanobiology. 11 (3–4): 449–459. doi:10.1007/s10237-011-0324-0. ISSN 1617-7959. PMC 3822867. PMID 21735243.
Gatt R, Vella Wood M, Gatt A, Zarb F, Formosa C, Azzopardi KM, Casha A, Agius TP, Schembri-Wismayer P, Attard L, Chockalingam N, Grima JN (2015). "Negative Poisson's ratios in tendons: An unexpected mechanical response". Acta Biomater. 24: 201–208. doi:10.1016/j.actbio.2015.06.018. PMID 26102335.
Batson EL, Paramour RJ, Smith TJ, Birch HL, Patterson-Kane JC, Goodship AE. (2003). Equine Vet J. |volume=35 |issue=3 |pages=314-8. Are the material properties and matrix composition of equine flexor and extensor tendons determined by their functions?
ScreenH.R.C., Tanner, K.E. (2012). Structure & Biomechanics of Biological Composites. In: Encyclopaedia of Composites 2nd Ed. Nicolais & Borzacchiello.Pub. John Wiley & Sons, Inc. ISBN 978-0-470-12828-2 (pages 2928-39)
Nakagawa, Y. (1989). "Effect of disuse on the ultra structure of the Achilles tendon in rats". European Journal of Applied Physiology. 59 (3): 239–242. doi:10.1007/bf02386194.
Reeves, N. D. (2005). "Influence of 90-day simulated micro-gravity on human tendon mechanical properties and the effect of restiveness countermeasures". Applied Physiology. 98 (6): 2278–2286. doi:10.1152/japplphysiol.01266.2004. PMID 15705722.
Riley, G. (2004). "The pathogenesis of tendinopathy. A molecular perspective". Rheumatology. 43 (2): 131–142. doi:10.1093/rheumatology/keg448. PMID 12867575.
Sharma, P. M., N. (2006). "Biology of tendon injury: healing, modeling and remodeling". Journal of Musculoskeletal and Neuronal Interactions. 6 (2): 181–190. PMID 16849830.
Sharma, P.; Maffulli, N. (2005). "Tendon injury and tendinopathy: Healing and repair". Journal of Bone and Joint Surgery. American Volume. 87A (1): 187–202. doi:10.2106/JBJS.D.01850. PMID 15634833.
Wang, J. H. C. (2006). "Mechanobiology of tendon". Journal of Biomechanics. 39 (9): 1563–1582. doi:10.1016/j.jbiomech.2005.05.011. PMID 16000201.
Riley, G. P.; Curry, V.; DeGroot, J.; van El, B.; Verzijl, N.; Hazleman, B. L.; Bank, R. A. (2002). "Matrix metalloproteinase activities and their relationship with collagen remodelling in tendon pathology". Matrix Biology. 21 (2): 185–195. doi:10.1016/S0945-053X(01)00196-2. PMID 11852234.
Moulin, V.; Tam, B. Y. Y.; Castilloux, G.; Auger, F. A.; O'Connor-McCourt, M. D.; Philip, A.; Germain, L. (2001). "Fetal and adult human skin fibroblasts display intrinsic differences in contractile capacity". Journal of Cellular Physiology. 188 (2): 211–222. doi:10.1002/jcp.1110. PMID 11424088.
Boyer, M. I. W., J. T.; Lou, J.; Manske, P. R.; Gelberman, R. H.; Cai, S. R. (2001). "Quantitative variation in vascular endothelial growth factor mRNA expression during early flexor tendon healing: an investigation in a canine model". Journal of Orthopaedic Research. 19 (5): 869–872. doi:10.1016/S0736-0266(01)00017-1. PMID 11562135.
Astrom, M.; Rausing, A. (1995). "Chronic Achilles Tendinopathy - A survey of Surgical and Histopathologic findings". Clinical Orthopaedics and Related Research. 316 (316): 151–164. doi:10.1097/00003086-199507000-00021. PMID 7634699.
Berge, James C. Vanden; Storer, Robert W. (1995). "Intratendinous ossification in birds: A review". Journal of Morphology. 226 (1): 47–77. doi:10.1002/jmor.1052260105. PMID 29865323.
Organ, Chris L. (2006). "Biomechanics of ossified tendons in ornithopod dinosaurs". Paleobiology. 32 (4): 652–665. doi:10.1666/05039.1. |