肌肉是大多数动物中发现的软组织。肌细胞含有肌动蛋白和肌球蛋白的蛋白质丝,它们相互滑动,产生收缩,改变细胞的长度和形状。肌肉起到产生力和运动的作用。它们主要负责维持和改变姿势,运动以及内脏器官的运动,例如心脏的收缩和通过蠕动消化系统的食物运动。
肌肉组织来源于胚胎生殖细胞的中胚层,其过程称为肌生成。有三种类型的肌肉,骨骼或条纹,心脏和光滑。肌肉动作可分为自愿或非自愿。心脏和平滑肌无意识地收缩,被称为非自愿,而骨骼肌则根据命令收缩。[1]骨骼肌又可分为快速和慢速抽搐纤维。
肌肉主要由脂肪和碳水化合物的氧化提供动力,但也使用厌氧化学反应,特别是快速抽搐纤维。这些化学反应产生三磷酸腺苷(ATP)分子,用于驱动肌球蛋白头的运动。[2]
术语肌肉来自拉丁文肌肉,意思是“小老鼠”,可能是因为某些肌肉的形状,或者因为收缩的肌肉看起来像老鼠在皮肤下移动。[3] [4]
骨骼肌的自上而下的视图
目录
1 结构
1.1 类型
1.2 显微解剖
1.3 大体解剖学
1.4 肌肉系统
1.5 发育
2 生理学
2.1 收缩
2.2 神经控制
2.3 能源消耗
2.4 强度
3 练习
4 临床意义
4.1 肥大
4.2 萎缩
4.3 疾病
5 演进
6 参考
结构
肌肉的解剖结构包括大体解剖结构,其包括生物体的所有肌肉,以及微观解剖学,其包括单个肌肉的结构。
类型
主要文章:肌肉组织
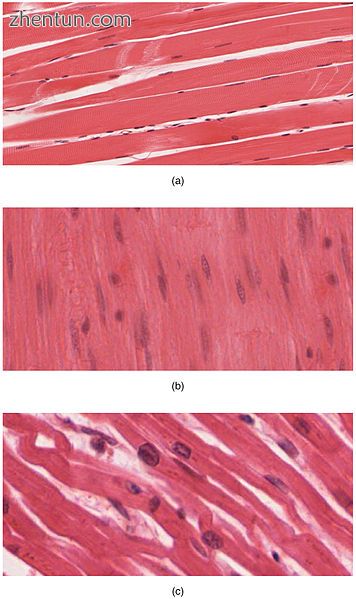
身体包含三种类型的肌肉组织:(a)骨骼肌,(b)平滑肌和(c)心肌。 (放大倍数相同)
肌肉组织是软组织,是动物中存在的四种基本组织类型之一。脊椎动物中识别出三种类型的肌肉组织:
骨骼肌或“随意肌肉”通过肌腱(或通过几个地方的腱膜)固定到骨骼上,并用于实现骨骼运动,例如运动和维持姿势。虽然这种姿势控制通常被保持为无意识的反射,但负责的肌肉会像非姿势肌一样对意识控制作出反应。平均成年男性由42%的骨骼肌组成,平均成年女性由36%(占体重的百分比)组成。[5]
在器官和结构的壁内发现平滑肌或“不随意的肌肉”,例如食道,胃,肠,支气管,子宫,尿道,膀胱,血管和皮肤中的竖立菌毛(它控制着勃起的皮肤)体毛)。与骨骼肌不同,平滑肌不受意识控制。
心肌(心肌)也是一种“不随意的肌肉”,但在结构上更像骨骼肌,仅在心脏中发现。
心脏和骨骼肌是“条纹”的,因为它们含有肌节,这些肌节被包装成高度规则的束状排列;平滑肌细胞的肌原纤维没有排列在肌节中,因此没有条纹。虽然骨骼肌中的肌节以规则的平行束排列,但心肌肌节以分支,不规则角度(称为插入椎间盘)连接。横纹肌收缩并在短时间内剧烈放松,而平滑肌则持续更长时间甚至近乎永久性的收缩。
骨骼(自愿)肌肉进一步分为两大类:慢抽搐和快速抽搐:
I型,慢抽搐或“红色”肌肉,毛细血管密集,富含线粒体和肌红蛋白,使肌肉组织呈现出独特的红色。它可以携带更多的氧气,并以脂肪或碳水化合物为燃料维持有氧活动。[6]慢抽搐纤维长时间收缩,但力量很小。
II型,快速抽搐肌,有三种主要的亚型(IIa,IIx和IIb),它们的收缩速度[7]和产生的力都有所不同。[6]快速抽搐纤维迅速而有力地收缩,但疲劳非常迅速,在肌肉收缩变得疼痛之前只能维持短暂的无氧运动。它们对肌肉力量贡献最大,并且具有更大的质量增加潜力。 IIb型是厌氧的,糖酵解的“白色”肌肉,其在线粒体和肌红蛋白中密度最小。在小动物(例如啮齿动物)中,这是主要的快肌类型,解释了它们肉的苍白颜色。
哺乳动物骨骼肌组织的密度约为1.06千克/升。[8]这与脂肪组织(脂肪)的密度形成鲜明对比,后者为0.9196千克/升[9]。这使得肌肉组织比脂肪组织密度大约15%。
显微解剖
主要文章:肌细胞和肌节
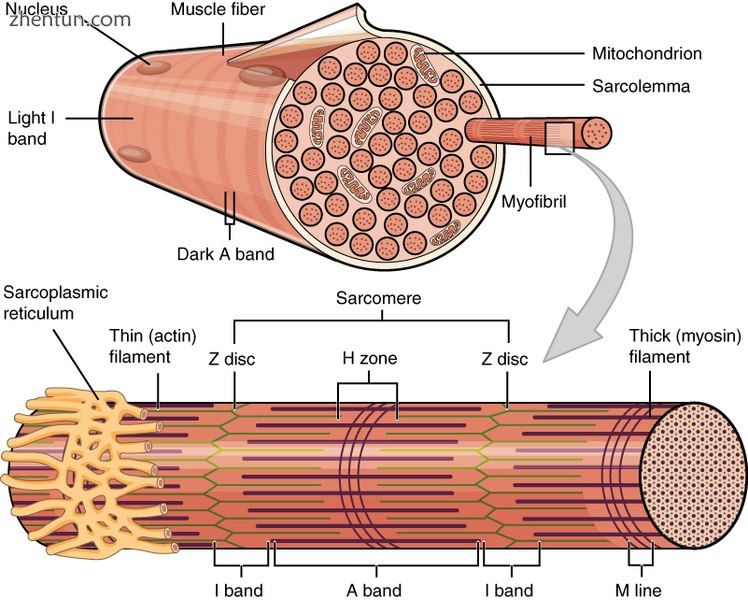
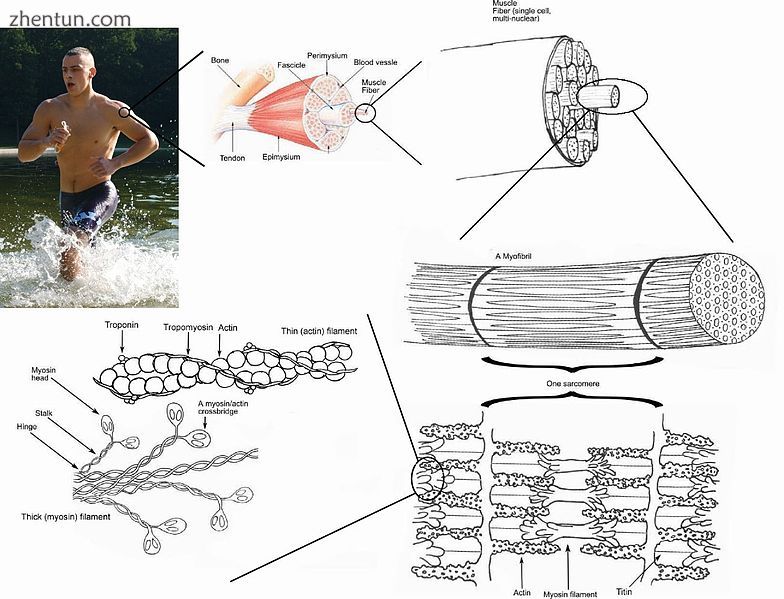
骨骼肌纤维被称为肌纤维膜的质膜包围,其中含有肌浆,即肌细胞的细胞质。肌纤维由许多原纤维组成,使细胞具有条纹外观。
骨骼肌被一层坚硬的结缔组织覆盖,称为外膜。外膜将肌肉组织固定在两端的肌腱上,肌腱变得更厚和胶原。它还可以保护肌肉免受与其他肌肉和骨骼的摩擦。在外膜内有多束称为束,每束包含10至100或更多的肌纤维,这些肌纤维由肌膜组成。除了围绕每个分支,外周膜是神经和肌肉内血液流动的途径。线状肌纤维是单个肌细胞(肌细胞),每个细胞都被包裹在其自身的胶原纤维内膜中。因此,整体肌肉由捆绑成束的纤维(细胞)组成,束本身组合在一起形成肌肉。在每个捆绑水平,胶原膜围绕束,这些膜通过抵抗组织的被动拉伸和分配施加到肌肉的力来支持肌肉功能。[10]整个肌肉散布着肌肉锭子,为中枢神经系统提供感觉反馈信息。 (这种分组结构类似于使用神经外膜,神经束膜和神经内膜的神经组织)。
这种相同的束内束结构在肌肉细胞内复制。在肌肉细胞内是肌原纤维,肌原纤维本身就是蛋白质丝束。术语“肌原纤维”不应与“肌纤维”相混淆,“肌纤维”只是肌细胞的另一个名称。肌原纤维是由几种蛋白质丝组成的复杂链,组合成称为肌节的重复单元。骨骼肌和心肌的纹状结果来自其细胞内的规则的肌节模式。虽然这两种类型的肌肉都含有肌节,但心肌中的纤维通常分支形成网络。心肌纤维通过插入的椎间盘相互连接,[11]使组织具有合胞体的外观。
肌节中的细丝由肌动蛋白和肌球蛋白组成。
大体解剖
另见:人体肌肉列表
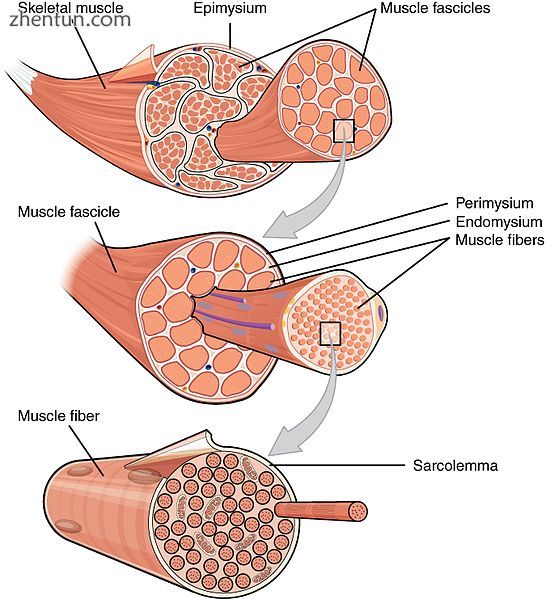
肌束纤维被称为束,被肌膜覆盖。肌肉纤维被肌内膜覆盖。
肌肉的大体解剖是其在体内作用的最重要指标。在画笔肌肉和其他肌肉之间有一个重要的区别。在大多数肌肉中,所有纤维都朝向相同的方向,从原点到插入一条直线运行。然而,在羽状肌中,单根纤维相对于作用线成一定角度,附着在原点和每端的插入肌腱上。因为收缩纤维以一定角度拉动肌肉的整体作用,所以长度的变化较小,但是这种相同的取向允许在给定尺寸的肌肉中有更多的纤维(因此更大的力)。通常发现阴茎肌肉,其长度变化不如最大力量重要,例如股直肌。
骨骼肌排列在离散的肌肉中,其中一个例子是肱二头肌(二头肌)。骨骼肌坚韧的纤维状外膜既与肌腱相连,又与肌腱连续。反过来,肌腱连接到骨骼周围的骨膜层,允许力从肌肉传递到骨骼。这些纤维层以及肌腱和韧带一起构成了身体的深筋膜。
肌肉系统
主要文章:肌肉系统
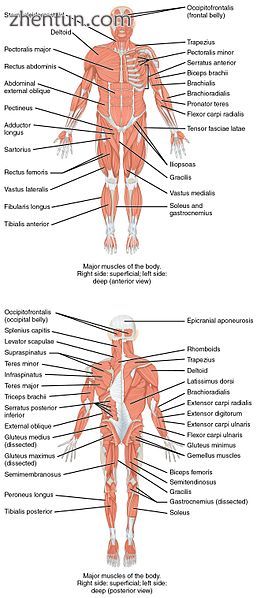
在上方肌肉系统的前视图和后视图中,表面右侧显示浅表肌肉(表面处的肌肉),而身体左半部分显示深部肌肉(浅表肌肉下方)。对于腿部,前视图显示浅表肌肉,而后视图显示浅表和深部肌肉。
肌肉系统由单个身体中存在的所有肌肉组成。人体内约有650个骨骼肌[12],但确切的数字难以界定。困难的部分原因在于,不同的来源对肌肉进行不同的分组,部分原因是某些肌肉(例如掌长肌)并不总是存在。
肌肉滑动是一段狭窄的肌肉,可以增强肌肉或肌肉。
肌肉系统是肌肉骨骼系统的一个组成部分,不仅包括肌肉,还包括骨骼,关节,肌腱和其他允许运动的结构。
发育
主要文章:肌生成
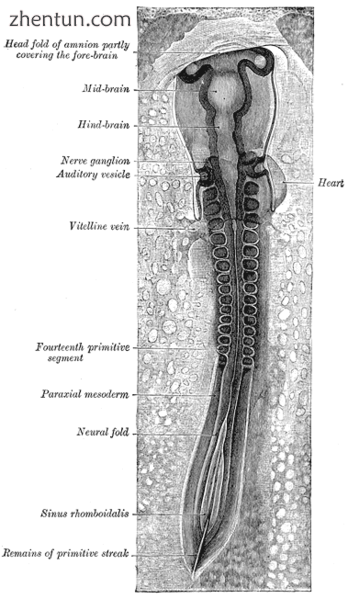
鸡胚,显示神经褶皱两侧的旁轴中胚层。前(前)部分已开始形成体节(标记为“原始片段”)。
所有肌肉都来自旁轴中胚层。近轴中胚层沿着胚胎的长度分成体节,对应于身体的分割(最明显见于脊柱。[13]每个体节有3个分区,菌核(形成椎骨),皮区(形成皮肤)肌肉组织(形成肌肉)。肌肉组分为两个部分,即表皮和低聚体,它们分别形成躯干和躯干肌肉。人类唯一的躯干肌肉是竖脊肌和小的椎间肌,并受到神经支配。所有其他肌肉,包括肢体的肌肉,都是双侧的,并且由脊神经的腹侧支架组成。[13]
在发育期间,成肌细胞(肌肉祖细胞)或者保留在体节中以形成与脊柱相关的肌肉,或者迁移到体内以形成所有其他肌肉。成肌细胞迁移之前是结缔组织框架的形成,通常由体细胞侧板中胚层形成。成肌细胞将化学信号传递到适当的位置,在那里它们融合成细长的骨骼肌细胞。[13]
生理
收缩
主要文章:肌肉收缩
三种类型的肌肉(骨骼,心脏和平滑)有显着差异。然而,所有三个人都使用肌动蛋白对肌球蛋白的运动来产生收缩。在骨骼肌中,通过神经传递的电脉冲,尤其是运动神经元(运动神经)来刺激收缩。内部起搏器细胞刺激心脏和平滑肌收缩,这些细胞经常收缩,并将收缩传播到与其接触的其他肌肉细胞。神经递质乙酰胆碱促进所有骨骼肌和许多平滑肌收缩。
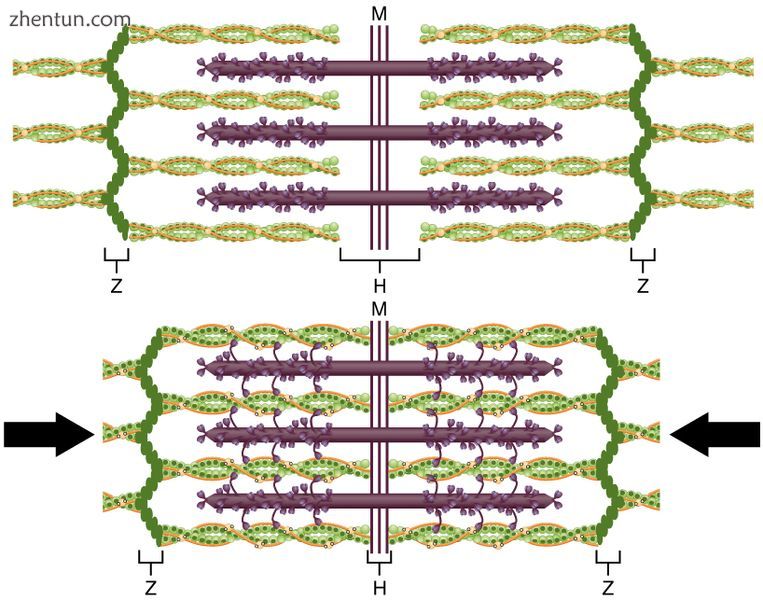
当肌节收缩时,Z线靠得更近,I带变小。 A波段保持相同的宽度。在完全收缩时,细长的细丝重叠。
肌肉产生的动作由原点和插入位置决定。肌肉的横截面积(而不是体积或长度)通过定义可以平行操作的“肌节”的数量来确定它可以产生的力的大小。每个骨骼肌都含有称为肌原纤维的长单位,每个肌原纤维都是一个肌节链。由于肌肉细胞中所有连接的肌节同时发生收缩,这些肌节链会缩短,从而缩短肌纤维,导致整体长度变化。[14]施加到外部环境的力的大小由杠杆机构确定,特别是杠杆与杠杆的比率。例如,在半径上更远地移动二头肌的插入点(远离旋转关节)将增加屈曲期间产生的力(并且因此,在该运动中提升的最大重量),但是减小最大值屈曲速度。向近侧移动插入点(更靠近旋转关节)将导致力减小但速度增加。通过将鼹鼠的肢体与马匹进行比较可以很容易地看出 - 在前者中,插入点定位为最大化力(用于挖掘),而在后者中,插入点定位为最大化速度(用于跑步) )。
神经控制
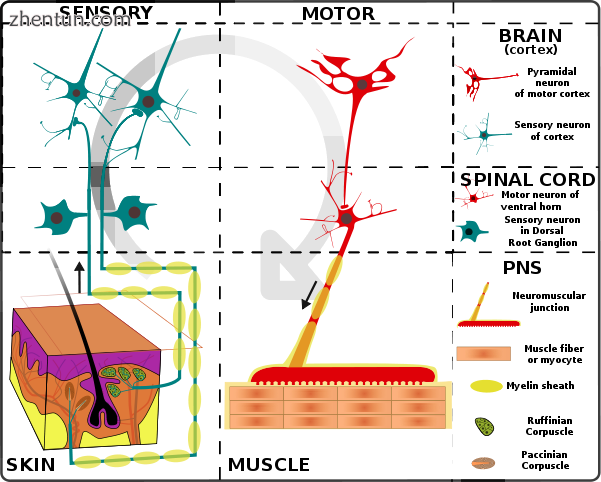
基本神经系统功能的简化模式。信号被感觉受体拾取并通过周围神经系统的传入腿被送到脊髓和大脑,随后发生处理,导致信号被送回脊髓,然后通过传出腿传递到运动神经元。
肌肉运动
周围神经系统的传出腿负责向肌肉和腺体传递命令,并且最终负责自愿运动。神经移动肌肉以响应来自大脑的自主和自主(非自愿)信号。深层肌肉,浅表肌肉,面部肌肉和内部肌肉都与大脑初级运动皮层中的专用区域相对应,直接位于中央沟前方,分隔额叶和顶叶。
此外,肌肉会对反射性神经刺激做出反应,这些神经刺激并不总能将信号一直发送到大脑。在这种情况下,来自传入纤维的信号不会到达大脑,而是通过与脊柱中的传出神经的直接连接产生反射运动。然而,大多数肌肉活动是意志性的,并且是大脑各个区域之间复杂相互作用的结果。
控制哺乳动物骨骼肌的神经对应于沿着大脑皮质的初级运动皮层的神经元群。命令通过基底神经节传导,并在通过锥体束传递到脊髓并从那里传递到肌肉的运动端板之前通过来自小脑的输入进行修改。在此过程中,诸如锥体外系统的反馈会产生影响肌肉张力和反应的信号。
诸如涉及姿势的那些更深的肌肉通常由脑干和基底神经节中的细胞核控制。
本体
主要文章:本体感觉
在骨骼肌中,肌梭传递有关肌肉长度和伸展到中枢神经系统的信息,以帮助维持姿势和关节位置。 我们的身体在太空中的感觉被称为本体感受,身体意识的感知,身体的各个区域在任何时间位于何处的“无意识”意识。 大脑中的几个区域利用从本体感受中获得的反馈信息来协调运动和位置。 小脑和红核尤其连续采样位置以防止运动并进行微小修正以确保平稳运动。
能源消耗
主要文章:生物能系统
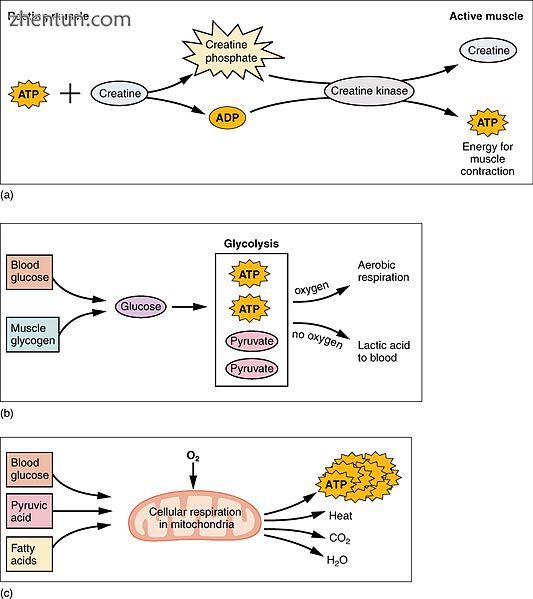
(a)一些ATP储存在静息肌肉中。随着收缩开始,它会在几秒钟内用完。磷酸肌酸产生更多的ATP约15秒。 (b)每个葡萄糖分子产生两个ATP和两个丙酮酸分子,可用于有氧呼吸或转化为乳酸。如果没有氧气,丙酮酸会转化为乳酸,这可能会导致肌肉疲劳。这种情况发生在剧烈运动时,需要大量的能量,但氧气不能充分地输送到肌肉。 (c)有氧呼吸是在氧气(O2)存在下葡萄糖分解产生二氧化碳,水和ATP。休息或中度活跃肌肉所需的ATP的大约95%是通过有氧呼吸提供的,其发生在线粒体中。
肌肉活动占身体能量消耗的大部分。所有肌肉细胞都产生三磷酸腺苷(ATP)分子,用于驱动肌球蛋白头的运动。肌肉具有磷酸肌酸形式的短期能量储存,其由ATP产生并且在需要时可以用肌酸激酶再生ATP。肌肉还以糖原的形式保持葡萄糖的储存形式。当能量持续强大的收缩时,糖原可以迅速转化为葡萄糖。在自愿骨骼肌内,葡萄糖分子可以在称为糖酵解的过程中厌氧代谢,在此过程中产生两个ATP和两个乳酸分子(请注意,在有氧条件下,乳酸没有形成;相反,丙酮酸形成并通过柠檬酸循环)。肌肉细胞还含有脂肪球,在有氧运动中用作能量。有氧能量系统需要更长的时间来产生ATP并达到峰值效率,并且需要更多的生化步骤,但产生比无氧糖酵解更多的ATP。另一方面,心肌可以在没有“预热”期的情况下有氧地消耗三种常量营养素(蛋白质,葡萄糖和脂肪)中的任何一种,并且总是从所涉及的任何分子中提取最大的ATP产量。心脏,肝脏和红细胞也会消耗运动过程中骨骼肌产生和排出的乳酸。
静息时,骨骼肌每天消耗54.4 kJ / kg(13.0 kcal / kg)。这比18.8 kJ / kg(4.5 kcal / kg)的脂肪组织(脂肪)和9.6 kJ / kg(2.3 kcal / kg)的骨骼大[15]。
效率
已经测量了人体肌肉的效率(在划船和骑车的情况下)为18%至26%。效率定义为机械功输出与总代谢成本的比率,可以从氧气消耗计算得出。这种低效率是由食物能量产生ATP的效率约为40%,将ATP中的能量转化为肌肉内的机械功以及体内机械损失的结果。后两种损失取决于运动类型和使用的肌纤维类型(快速抽搐或慢抽搐)。总效率为20%,1瓦特的机械功率相当于每小时4.3千卡。例如,一个划船设备制造商校准其划船测功计,将燃烧的卡路里计算为实际机械功的四倍,再加上每小时300千卡,[16]这相当于250瓦机械输出时的效率约为20%。循环收缩的机械能输出可取决于许多因素,包括激活时间,肌肉拉伸轨迹以及力上升和衰减的速率。这些可以使用工作循环分析通过实验合成。
强度
肌肉是三个重叠因素的结果:生理强度(肌肉大小,横截面积,可用的交叉桥,对训练的反应),神经强度(告诉肌肉收缩的信号强弱)和机械强度(肌肉在杠杆上的力角,力矩臂长度,关节能力)。
生理力量
主要文章:体力
分级 肌肉力量
0级 没有收缩
1级 收缩痕迹,但关节没有运动
2级 运动在关节处消除了重力
3级 运动抵抗重力,但不抵抗额外阻力
4级 运动抵抗外部阻力,但低于正常水平
5级 正常强度
当等长并且在最佳长度时,脊椎动物肌肉通常每平方厘米的肌肉横截面积产生大约25-33N(5.6-7.4lbf)的力。[17]一些无脊椎动物的肌肉,例如蟹爪,比脊椎动物具有更长的肌节,导致肌动蛋白和肌球蛋白结合的位点更多,因此每平方厘米的力更大,代价是速度慢得多。收缩产生的力可以使用肌动描记法或分析法进行非侵入性测量,使用肌腱应变(如果存在显着的肌腱)在体内测量,或者使用更具侵入性的方法直接测量。
就施加在骨架上的力而言,任何给定肌肉的强度取决于长度,缩短速度,横截面积,pennation,肌节长度,肌球蛋白同种型和运动单位的神经活化。肌肉力量的显着降低可以指示潜在的病理学,右图用作指导。
“最强壮”的人体肌肉
由于三个因素同时影响肌肉力量而肌肉不能单独起作用,因此比较单个肌肉的力量是错误的,并说一个是“最强”。但下面是几种肌肉,其力量因各种原因值得注意。
用普通的说法,肌肉“强度”通常指的是在外部物体上施加力的能力 - 例如,举重。根据这个定义,咬肌或下颌肌肉是最强的。 1992年吉尼斯世界纪录记录了4,337 N(975 lbf)的咬合强度达到2秒。咬肌的区别并不是肌肉本身的任何特殊之处,而是它在比其他肌肉更短的杠杆臂上工作的优势。
如果“强度”是指由肌肉本身施加的力,例如在其插入骨骼的位置,则最强的肌肉是具有最大横截面积的肌肉。这是因为单个骨骼肌纤维施加的张力变化不大。每根纤维可以施加0.3微牛顿的力。根据这个定义,身体最强壮的肌肉通常被称为股四头肌或臀大肌。
因为肌肉强度由横截面积决定,所以较短的肌肉比相同横截面积的较长肌肉更强“磅重”(即按重量计)。子宫的子宫肌层可以是女性人体中最强的肌肉。在婴儿分娩时,整个人体子宫重约1.1千克(40盎司)。在分娩期间,子宫在每次收缩时施加100至400N(25至100lbf)的向下力。
与眼球的小尺寸和重量相比,眼睛的外部肌肉明显大而强壮。人们经常说他们是“他们必须做的最强壮的肌肉”,并且有时声称“比他们需要的强100倍”。然而,眼睛运动(特别是用于面部扫描和阅读的眼镜)确实需要高速运动,并且在快速眼动睡眠期间夜间运动眼部肌肉。
“舌头是身体中最强壮的肌肉”的说法经常出现在令人惊讶的事实清单中,但很难找到任何能使这种说法成真的“力量”定义。请注意,舌头由八块肌肉组成,而不是一块。
心脏声称自己是在一生中进行最大量体力劳动的肌肉。 人体心脏功率输出的估计范围为1至5瓦。 这远远小于其他肌肉的最大输出功率; 例如,股四头肌可以产生超过100瓦,但只有几分钟。 心脏在一生中不间断地持续工作,从而“锻炼”其他肌肉。 连续产生一瓦特八十年的产量,总产量为2.5千兆焦耳。[18]
运动
主要文章:体育锻炼

慢跑是有氧运动的一种形式。
通常建议锻炼作为改善运动技能,健身,肌肉和骨骼强度以及关节功能的手段。运动对肌肉,结缔组织,骨骼和刺激肌肉的神经有一些影响。一种这样的效果是肌肉肥大,尺寸增加。这用于健美运动。
各种锻炼需要一定的肌纤维利用优势。有氧运动涉及长时间,低水平的运动,其中肌肉的使用远低于其最大收缩强度长时间(最典型的例子是马拉松)。主要依靠有氧(含氧)系统的有氧事件使用较高百分比的I型(或慢肌肉)肌纤维,消耗脂肪,蛋白质和碳水化合物的混合物来获取能量,消耗大量氧气并产生少量乳酸。无氧运动涉及较高强度收缩的短暂爆发,其最大收缩强度的百分比大得多。无氧运动的例子包括短跑和举重。厌氧能量输送系统主要使用II型或快肌纤维,主要依靠ATP或葡萄糖作为燃料,消耗相对较少的氧气,蛋白质和脂肪,产生大量乳酸并且不能持续很长一段时间作为有氧运动。许多运动部分是有氧运动,部分是无氧运动;例如,足球和攀岩涉及两者的结合。
乳酸的存在对肌肉内的ATP生成具有抑制作用;尽管不产生疲劳,但如果细胞内浓度变得太高,它可以抑制甚至停止性能。然而,长期训练会导致肌肉内的新血管形成,增加将废物移出肌肉并保持收缩的能力。一旦从肌节中高浓度的肌肉中移出,乳酸可以被其他肌肉或身体组织用作能量来源,或者被运输到肝脏,在那里它被转换回丙酮酸。除了增加乳酸水平外,剧烈运动还会导致肌肉中钾离子的损失,并导致间质中靠近肌纤维的钾离子浓度增加。乳酸酸化可以恢复力,使酸中毒可以防止疲劳,而不是疲劳的原因。[19]
延迟性肌肉酸痛是运动后一至三天可能感觉到的疼痛或不适,并且通常在两到三天后消退。一旦被认为是由乳酸积聚引起的,最近的一个理论是,它是由肌肉纤维中的微小撕裂引起的,这是由于离心收缩或不习惯的训练水平造成的。由于乳酸分散相当迅速,因此无法解释运动后几天所经历的疼痛。[20]
临床意义
肥大
主要文章:肌肉肥大
与力量和性能测量无关,可以通过许多因素诱导肌肉变大,包括激素信号传导,发育因素,力量训练和疾病。与普遍看法相反,肌肉纤维的数量不能通过锻炼增加。相反,肌肉细胞生长的组合会使肌肉变大,因为新的蛋白质细丝与现有肌肉细胞旁边的未分化卫星细胞一起增加了额外的质量。[12]
生理因素如年龄和激素水平可以影响肌肉肥大。在男性青春期,随着身体产生的促生长激素水平的增加,肥大以加速的速度发生。天然肥大通常在青少年后期完全停止。由于睾酮是人体主要的生长激素之一,平均而言,男性比女性更容易发现肥大。服用额外的睾酮或其他合成代谢类固醇会增加肌肉肥大。
肌肉,脊柱和神经因素都会影响肌肉的建立。有时,一个人可能会注意到给定肌肉的力量增加,即使只有其相反的部位已经进行了锻炼,例如当一个健美运动员在完成仅关注右侧二头肌的治疗方案后发现她的左侧二头肌更强时。这种现象称为交叉训练。
萎缩
主要文章:肌肉萎缩
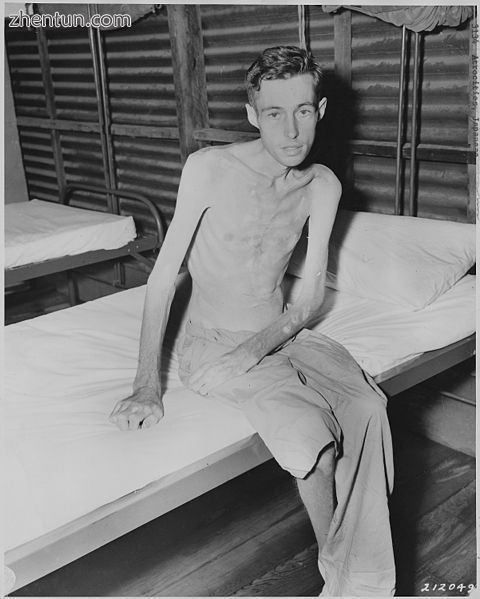
由于营养不良导致肌肉萎缩的战俘。由于营养不良,缺乏身体活动,衰老或疾病,肌肉可能会萎缩。
哺乳动物的不活动和饥饿会导致骨骼肌萎缩,肌肉质量下降,可能伴随着肌肉细胞数量和大小的减少以及蛋白质含量的降低[21]。肌肉萎缩也可能由自然衰老过程或疾病引起。
在人类中,长时间的固定,如在卧床休息或宇航员在太空中飞行的情况,已知会导致肌肉减弱和萎缩。载人太空飞行社区对萎缩特别感兴趣,因为在太空飞行中所经历的失重导致一些肌肉的质量损失高达30%[22] [23]。这种后果也出现在小型冬眠哺乳动物中,如金色的地松鼠和棕色蝙蝠。[24]
在衰老期间,维持骨骼肌功能和质量的能力逐渐降低,称为肌肉减少症。肌肉减少症的确切原因尚不清楚,但可能是由于“卫星细胞”逐渐失效,有助于骨骼肌纤维再生,以及对关键分泌生长因子的敏感性或可用性的降低。维持肌肉质量和卫星细胞存活所必需的。肌肉减少症是衰老的一个正常方面,实际上并不是一种疾病状态,但可能与老年人的许多伤害以及生活质量下降有关。[25]
还有许多引起肌肉萎缩的疾病和病症。实例包括癌症和艾滋病,其诱发称为恶病质的身体消耗综合征。可引起骨骼肌萎缩的其他综合征或病症是充血性心脏病和一些肝脏疾病。
疾病
主要文章:神经肌肉疾病
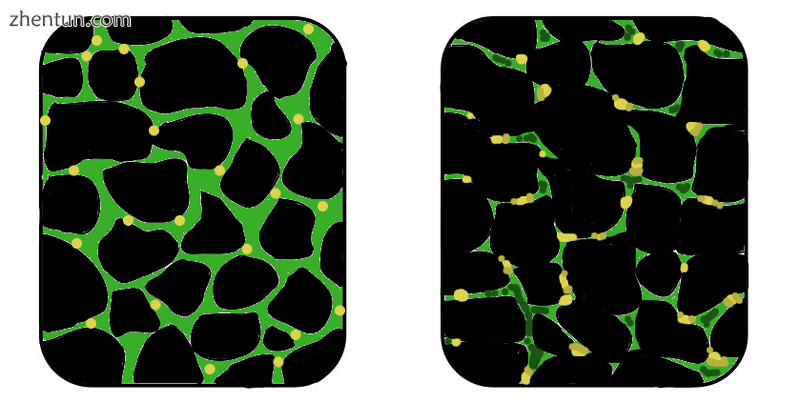
在肌营养不良症中,受影响的组织变得杂乱无章,肌营养不良蛋白(绿色)的浓度大大降低。
神经肌肉疾病是影响肌肉和/或神经控制的疾病。一般而言,神经控制的问题可能导致痉挛或瘫痪,这取决于问题的位置和性质。大部分神经系统疾病,从脑血管意外(中风)和帕金森病到克雅氏病,都可能导致运动或运动协调问题。
肌肉疾病的症状可能包括虚弱,痉挛,肌阵挛和肌痛。可能揭示肌肉疾病的诊断程序包括测试血液中的肌酸激酶水平和肌电图(测量肌肉中的电活动)。在某些情况下,可以进行肌肉活检以识别肌病,以及进行基因检测以鉴定与特定肌病和营养不良相关的DNA异常。
测量肌肉噪音的非侵入性弹性成像技术正在进行实验,以提供一种监测神经肌肉疾病的方法。肌肉产生的声音来自沿着肌肉轴线的肌动球蛋白丝的缩短。在收缩期间,肌肉沿其纵轴缩短并横向横向轴线扩展,在表面产生振动。[26]
演化
后生动物肌肉细胞的进化起源是一个备受争议的话题。在一个思路中,科学家认为肌肉细胞进化一次,因此所有肌肉细胞的动物都有一个共同的祖先。在另一个思路中,科学家认为肌肉细胞不止一次进化,任何形态或结构上的相似性都归因于收敛的进化和基于肌肉进化的基因,甚至是中胚层 - 许多科学家认为真正的肌肉细胞的胚层派生。
Schmid和Seipel认为,肌肉细胞的起源是一种单系特征,与所有动物的消化系统和神经系统的发育同时发生,这种起源可以追溯到存在肌肉细胞的单个后生动物祖先。他们认为,刺胞动物和栉水母中的肌肉细胞之间的分子和形态相似性与双疟原虫相似,以至于肌肉细胞衍生出的后生动物中将有一个祖先。在这种情况下,Schmid和Seipel认为,双翅目,栉水母和刺胞动物的最后一个共同祖先是三倍体或具有三个胚层的生物体,并且二倍体胚胎,即含有两个胚层的生物体,由于它们观察到它而进化二次。在大多数刺胞动物和栉水母中发现缺乏中胚层或肌肉。通过比较刺胞动物和栉水母的形态与bilaterians,Schmid和Seipel能够得出结论,在一些刺胞动物的触手和肠道以及栉水母的触须中存在成肌细胞样结构。由于这是一种肌肉细胞特有的结构,这些科学家根据他们的同伴收集的数据确定,这是横纹肌的标记,类似于在bilaterians中观察到的。作者还指出,由于这些肌肉细胞的起源是外胚层而不是中胚层或中胚层,因此在刺胞动物和栉水母中发现的肌肉细胞通常都是竞争对手。真正的肌肉细胞的起源被其他人认为是中胚层和内胚层的内胚层部分。然而,施密德和塞佩尔反驳了这种怀疑主义,认为通过认为刺胞动物通过美杜莎阶段和息肉阶段发展,在栉水母和刺胞动物中发现的肌细胞是否是真正的肌肉细胞。他们观察到在水生动物的水母阶段,有一层细胞从外胚层的远端侧分离出来,形成横纹肌细胞,其方式与中胚层相似,并将这三个分离的细胞层称为外胚层。 。他们还认为,并非所有的肌肉细胞都来自双侧中层的中内胚层,关键的例子是在脊椎动物的眼肌和螺旋体的肌肉中,这些细胞来自外胚层中胚层而不是内胚层中胚层。此外,施密德和塞佩尔认为,由于生物发生确实发生在cnidarians中,在bilaterians肌肉细胞规范中发现的分子调节元素的帮助下,有证据表明横纹肌的单一来源。[27]
与单一肌肉细胞来源的论证相反,Steinmetz等人。认为用于确定横纹肌的这种单一起源的分子标记物如肌球蛋白II蛋白实际上早于肌细胞的形成。本文作者使用了一种存在于porifera或海绵中的收缩元素的例子,这些元素确实缺乏含有这种蛋白质的横纹肌肉。此外,Steinmetz等人。目前通过分析双面体中存在的形态学和分子标记以及在cnidarians,ctenophores和bilaterians中不存在的横纹肌细胞发育的多系起源的证据。 Steimetz等人。表明传统的形态学和调节标志物如肌动蛋白,将肌球蛋白侧链磷酸化与更高浓度的钙浓度和其他MyHC元素偶联的能力存在于所有后生动物中,而不仅仅是已经显示出肌肉的生物体细胞。因此,根据Steinmetz等人,使用任何这些结构或调节元件来确定刺胞动物和栉水母的肌肉细胞是否足够类似于双层肌的肌细胞以确认单个谱系是有问题的。此外,Steinmetz等人。解释用于假设横纹肌起源的MyHc基因的直向同源物是通过基因复制事件发生的,该事件早于第一个真正的肌肉细胞(意为横纹肌),并且它们表明MyHc基因存在于海绵中具有收缩性元素但没有真正的肌肉细胞。此外,Steinmetz等人都表明,这一重复基因的定位,既有促进横纹肌基因形成和细胞调节和运动基因的功能,也已经分为条纹myhc和非肌肉myhc。通过将条纹myhc定位于海绵中的收缩液泡来显示重复基因组的这种分离,而非肌肉myhc在发育细胞形状和变化期间更加弥散地表达。 Steinmetz等人。在cnidarians中发现了类似的定位模式,除了cnidarian N. vectensis在消化道的平滑肌中存在这种横纹肌标记。因此,Steinmetz等人。认为分离的myhc直向同源物的多形性特征不能用于确定肌肉的单核因子,并且还认为这种刺胞动物的平滑肌中存在条纹肌肉标记物显示出肌肉细胞发育和结构的根本不同的机制。在刺胞动物。[28]
Steinmetz等人。通过解释用于形成肌钙蛋白复合物用于肌肉调节和生物学中形成的肌钙蛋白复合物的一组关键基因从cnidarians和ctenophores中缺失,以及观察到的47种结构和调节蛋白,继续争论后生动物中多个起源的横纹肌。 Steinmetz等人。甚至无法发现在刺胞动物和双子宫中表达的独特横纹肌细胞蛋白。此外,即使在bilaterians中,Z-disc似乎也有不同的进化,甚至在这个进化枝之间也存在大量的蛋白质,对肌肉细胞显示出很大程度的辐射。通过Z盘的这种分歧,Steimetz等人。认为只有四种常见的蛋白质组分存在于所有双侧肌肉祖先中,并且对于必需的Z-盘组分而言,只有一种肌动蛋白蛋白质,他们已经认为是一种通过其多形态的无信息标记存在于刺胞动物中。通过进一步的分子标记测试,Steinmetz等。观察到,非双字母表缺乏双曲面肌肉形成所必需的许多调节和结构成分,并且没有找到任何独特的蛋白质组合,这些蛋白质对于早期的,更原始的动物如海绵和变形虫中不存在的双字母和刺胞动物以及栉水母。通过这一分析,作者得出结论,由于缺乏bilaterians肌肉依赖于结构和使用的元素,非双色肌必须具有不同的来源,具有不同的调节和结构蛋白。[28]
在另一个观点中,Andrikou和Arnone使用基因调控网络上新近获得的数据来研究基因和形态发生素的层次结构以及组织规范的其他机制如何在早期的deuterostomes和protostomes之间发生变化和相似。通过不仅了解所有bilaterians中存在的基因,还了解这些基因的部署时间和地点,Andrikou和Arnone讨论了对肌生成进化的更深入理解。[29]
在他们的论文中,Andrikou和Arnone认为,要真正了解肌肉细胞的进化,必须在其他外部和内部相互作用的背景下理解转录调节因子的功能。通过他们的分析,Andrikou和Arnone发现在无脊椎动物双向细胞和刺胞动物中都存在基因调控网络的保守直系同源物。他们认为,拥有这种通用的通用监管电路可以使单个运行良好的网络产生高度分歧。 Andrikou和Arnone发现脊椎动物中发现的基因的直向同源物已经通过无脊椎动物的后躯体和原始体中不同类型的结构突变而发生变化,他们认为基因中的这些结构变化允许肌肉功能和肌肉形成的大量分歧。这些物种。 Andrikou和Arnone不仅能够识别由脊椎动物和无脊椎动物中发现的基因突变引起的任何差异,而且能够识别物种特异性基因的整合,这些基因也可能导致与原始基因调控网络功能的分歧。因此,虽然已经确定了一种常见的肌肉模式系统,但他们认为这可能是由于更多的祖先基因调控网络被跨越谱系多次联合,其他基因和突变导致肌肉发育非常不同。因此,似乎肌原性图案框架可能是祖先特征。然而,Andrikou和Arnone解释说,基本的肌肉图案结构也必须与发育过程中不同时间存在的顺式调节元素结合起来考虑。与高水平的基因家族装置结构相比,Andrikou和Arnone发现顺式调节元件在网络中的时间和地点都不是很保守,这可能在肌肉细胞的形成中表现出很大程度的分歧。通过这种分析,似乎肌原性GRN是一种祖先的GRN,肌原性功能和结构的实际变化可能与后来在不同时间和地点的基因联系有关。[29]
在进化上,骨骼和心肌的特殊形式早于脊椎动物/节肢动物进化线的分歧。[30]这表明这些类型的肌肉在7亿年前(mya)的某个时间在共同的祖先中发展。发现脊椎动物平滑肌独立于骨骼肌和心肌类型进化。
另见
Electroactive polymers – materials that behave like muscles, used in robotics research
Hand strength
Meat
Muscle memory
Myotomy
Preflexes
Rohmert's law – pertaining to muscle fatigue
参考
Mackenzie, Colin (1918). The Action of Muscles: Including Muscle Rest and Muscle Re-education. England: Paul B. Hoeber. p. 1. Retrieved 18 April 2015.
Brainard, Jean; Gray-Wilson, Niamh; Harwood, Jessica; Karasov, Corliss; Kraus, Dors; Willan, Jane (2011). CK-12 Life Science Honors for Middle School. CK-12 Foundation. p. 451. Retrieved 18 April 2015.
Alfred Carey Carpenter (2007). "Muscle". Anatomy Words. Retrieved 3 October 2012.
Douglas Harper (2012). "Muscle". Online Etymology Dictionary. Retrieved 3 October 2012.
Marieb, EN; Hoehn, Katja (2010). Human Anatomy & Physiology (8th ed.). San Francisco: Benjamin Cummings. p. 312. ISBN 978-0-8053-9569-3.
McCloud, Aaron (30 November 2011). "Build Fast Twitch Muscle Fibers". Complete Strength Training. Retrieved 30 November 2011.
Larsson, L; Edström, L; Lindegren, B; Gorza, L; Schiaffino, S (July 1991). "MHC composition and enzyme-histochemical and physiological properties of a novel fast-twitch motor unit type". The American Journal of Physiology. 261 (1 pt 1): C93–101. doi:10.1152/ajpcell.1991.261.1.C93. PMID 1858863. Retrieved 11 June 2006.
Urbancheka, M; Picken, E; Kalliainen, L; Kuzon, W (2001). "Specific Force Deficit in Skeletal Muscles of Old Rats Is Partially Explained by the Existence of Denervated Muscle Fibers". The Journals of Gerontology Series A: Biological Sciences and Medical Sciences. 56 (5): B191–B197. doi:10.1093/gerona/56.5.B191. PMID 11320099.
Farvid, MS; Ng, TW; Chan, DC; Barrett, PH; Watts, GF (2005). "Association of adiponectin and resistin with adipose tissue compartments, insulin resistance and dyslipidaemia". Diabetes, Obesity & Metabolism. 7 (4): 406–413. doi:10.1111/j.1463-1326.2004.00410.x. PMID 15955127.
MacIntosh, BR; Gardiner, PF; McComas, AJ (2006). "1. Muscle Architecture and Muscle Fiber Anatomy". Skeletal Muscle: Form and Function (2nd ed.). Champaign, IL: Human Kinetics. pp. 3–21. ISBN 978-0-7360-4517-9.
Kent, George C (1987). "11. Muscles". Comparative Anatomy of the Vertebrates (7th ed.). Dubuque, Iowa: Wm. C. Brown Publishers. pp. 326–374. ISBN 978-0-697-23486-5.
Poole, RM, ed. (1986). The Incredible Machine. Washington, DC: National Geographic Society. pp. 307–311. ISBN 978-0-87044-621-4.
Sweeney, Lauren (1997). Basic Concepts in Embryology: A Student's Survival Guide (1st Paperback ed.). McGraw-Hill Professional.
Kardong, Kenneth (2015). Vertebrates: Comparative Anatomy, Function, Evolution. New York: McGraw Hill Education. pp. 374–377. ISBN 978-1-259-25375-1.
Heymsfield, SB; Gallagher, D; Kotler, DP; Wang, Z; Allison, DB; Heshka, S (2002). "Body-size dependence of resting energy expenditure can be attributed to nonenergetic homogeneity of fat-free mass". American Journal of Physiology. Endocrinology and Metabolism. 282 (1): E132–E138. doi:10.1152/ajpendo.2002.282.1.e132. PMID 11739093.
"Concept II Rowing Ergometer, user manual" (PDF). 1993. Archived from the original (PDF) on 26 December 2010.
McGinnis, Peter M. (2013). Biomechanics of Sport and Exercise (3rd ed.). Champaign, IL: Human Kinetics. ISBN 978-0-7360-7966-2.
Muslumova, Irada (2003). "Power of a Human Heart". The Physics Factbook.
Nielsen, OB; Paoli, F; Overgaard, K (2001). "Protective effects of lactic acid on force production in rat skeletal muscle". Journal of Physiology. 536 (1): 161–166. doi:10.1111/j.1469-7793.2001.t01-1-00161.x. PMC 2278832. PMID 11579166.
Robergs, R; Ghiasvand, F; Parker, D (2004). "Biochemistry of exercise-induced metabolic acidosis". Am J Physiol Regul Integr Comp Physiol. 287 (3): R502–516. doi:10.1152/ajpregu.00114.2004. PMID 15308499.
Fuster, G; Busquets, S; Almendro, V; López-Soriano, FJ; Argilés, JM (2007). "Antiproteolytic effects of plasma from hibernating bears: a new approach for muscle wasting therapy?". Clin Nutr. 26 (5): 658–661. doi:10.1016/j.clnu.2007.07.003. PMID 17904252.
Roy, RR; Baldwin, KM; Edgerton, VR (1996). "Response of the neuromuscular unit to spaceflight: What has been learned from the rat model". Exerc. Sport Sci. Rev. 24: 399–425. doi:10.1249/00003677-199600240-00015. PMID 8744257.
"NASA Muscle Atrophy Research (MARES) Website". Archived from the original on 4 May 2010.
Lohuis, TD; Harlow, HJ; Beck, TD (2007). "Hibernating black bears (Ursus americanus) experience skeletal muscle protein balance during winter anorexia". Comp. Biochem. Physiol. B, Biochem. Mol. Biol. 147 (1): 20–28. doi:10.1016/j.cbpb.2006.12.020. PMID 17307375.
Roche, Alex F. (1994). "Sarcopenia: A critical review of its measurements and health-related significance in the middle-aged and elderly". American Journal of Human Biology. 6 (1): 33–42. doi:10.1002/ajhb.1310060107. PMID 28548430.
Dumé, Belle (18 May 2007). "'Muscle noise' could reveal diseases' progression". NewScientist.com news service.
Seipel, Katja; Schmid, Volker (1 June 2005). "Evolution of striated muscle: Jellyfish and the origin of triploblasty". Developmental Biology. 282 (1): 14–26. doi:10.1016/j.ydbio.2005.03.032. PMID 15936326.
Steinmetz, Patrick R.H.; Kraus, Johanna E.M.; Larroux, Claire; Hammel, Jörg U.; Amon-Hassenzahl, Annette; Houliston, Evelyn; Wörheide, Gert; Nickel, Michael; Degnan, Bernard M. (2012). "Independent evolution of striated muscles in cnidarians and bilaterians". Nature. 487 (7406): 231–234. doi:10.1038/nature11180. PMC 3398149. PMID 22763458.
Andrikou, Carmen; Arnone, Maria Ina (1 May 2015). "Too many ways to make a muscle: Evolution of GRNs governing myogenesis". Zoologischer Anzeiger. Special Issue: Proceedings of the 3rd International Congress on Invertebrate Morphology. 256: 2–13. doi:10.1016/j.jcz.2015.03.005.
OOta, S.; Saitou, N. (1999). "Phylogenetic relationship of muscle tissues deduced from superimposition of gene trees". Molecular Biology and Evolution. 16 (6): 856–867. doi:10.1093/oxfordjournals.molbev.a026170. ISSN 0737-4038. |