概要
目的:本研究的目的是使用不同的成像技术确定皮瓣和皮下乳房层质量的适当术前评估方法,与术中发现相关,以及它们对即刻种植体乳房重建的结果的重要性。
材料和方法:临床评估,乳房X光检查,乳房超声和乳房MRI用于评估乳房切除术皮瓣,这增强了乳房重建的适当手术技术的选择。评估开始于2014年使用上述方法对50名乳腺癌患者进行皮瓣修复,这些患者是改良根治性乳房切除术(MRM)的候选者,没有立即进行乳房重建。因此,在进行这样的术前皮下组织厚度评估后,在2014年和2017年之间进行了46次乳头保留乳房切除术(NSM)和21次皮肤保留乳房切除术(SSM)以及植入物的即时乳房重建。
结果:MRM组术中发现MRI术前评估准确率为90%,超声检查结果为87%,乳房X线照相检查结果为81%,捏合检查结果为71%。接受SSM或NSM的患者的术前测量是选择乳房重建手术技术的标准。术后并发症发生率较低。
结论:术前临床测量,乳房超声,乳房MRI和乳房X线摄影可以增强皮瓣厚度的预测,从而导致基于种植体的即时乳房重建的低并发症率和良好的美学效果。
关键词:皮瓣厚度,即时乳房重建,乳腺超声,乳房MRI,乳房X光检查
介绍
在过去的几十年中,乳腺癌的外科治疗主要通过保守治疗,乳房切除术仅用于局部晚期病例或甚至早期阶段的广泛疾病(DCIS)。最近乳房切除率大幅上升,尤其是年轻患者。这种变化是由于频繁的基因检测,改善乳房重建结果,特别是对于即刻重建,以及对局部复发的恐惧。尽管起初,这些乳房切除术技术的肿瘤学安全性值得商榷,但后来证明了这一点。选择和执行这些类型的乳房切除术时,一个非常重要的问题是皮瓣质量。乳房切除术皮瓣剥离是这项手术的一个重要因素,因为它应该实现乳房组织的完全切除和保持血管良好的皮肤包膜。 (1)(2)
覆盖乳房的皮肤具有不同的厚度:它在乳腺周边和乳房下皱纹附近较厚,并且在乳头 - 乳晕复合体旁边较薄。 Duret波峰的残余部分将浅表乳房叶片连接到筋膜和Cooper韧带的浅层,因为皮肤或乳头保留乳房切除术中的肿瘤安全性较低而受到指责。在根治性乳房切除术中,椭圆形切口包含乳晕和肿瘤位置,在剩余皮瓣下方,与皮下乳房切除术一样,Duret和残留腺体的波峰也很多,因此皮肤和乳头保留乳房切除术的肿瘤学安全性是如今被接受了。 (3)
本研究旨在通过临床检查,乳腺超声检查,乳房MRI和乳房X线照相术,术前评估皮瓣厚度的适当方法,与术中发现的相关性以及对即刻种植重建后的美学效果的重要性。应该进行适当的基于种植体立即乳房重建的手术方法,因为皮瓣厚度可以帮助外科医生选择适当的种植体位置,避免皮瓣坏死,种植体动画和种植体边缘能见度等并发症。
材料和方法
使用简单的定性方法 - 透照法(图3,44),在乳房X线照相术(图1,22)中可区分的皮下乳房组织存在差异,因此研究的目的是进行更准确的术前评估并将其与术中评估进行比较。
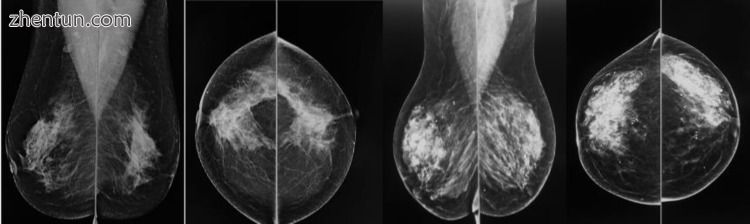
图1
两名厚皮下皮瓣患者的乳房X光检查。 每位患者有两种观点:内侧斜视图(MLO)和头尾视图(CC)。
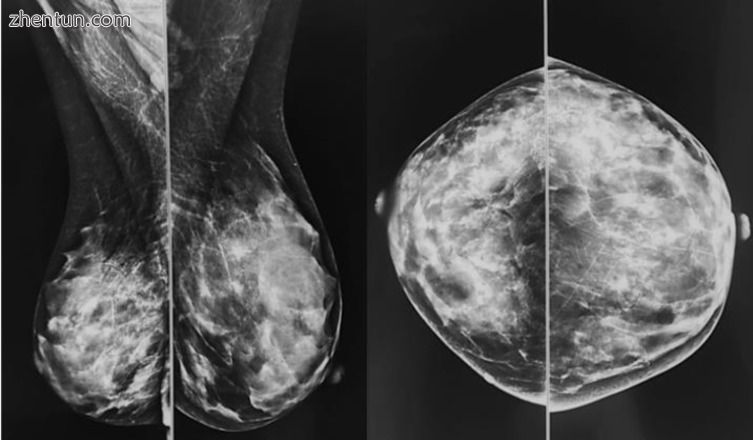
图2
2个视图中皮下皮瓣较薄的患者的乳房X线摄影:内侧斜视图(MLO)和头尾视图(CC)
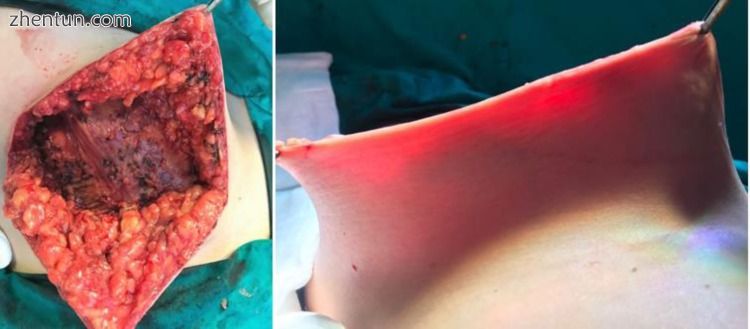
图3
乳房切除术后皮瓣的术中透视 - 厚皮瓣
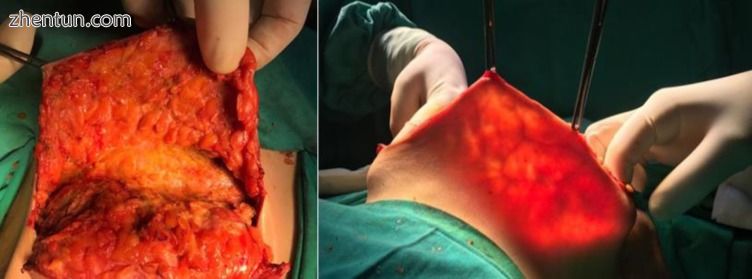
图4
乳房切除术后皮瓣的术中透视 - 薄皮瓣
评估从皮瓣和皮下乳房层进行评估,包括皮肤和乳房层,使用临床检查,乳房超声,乳房MRI和乳房X光检查对50名乳腺癌患者,他们是2014年改良根治性乳房切除术(MRM)的候选人。患者不能立即进行乳房重建。测量在锁骨中线至乳头上方5cm处,乳头与乳房下褶皱之间以及乳头间线上,乳头内侧和外侧5cm处进行测量。
临床检查包括“捏测试”,其测量乳房皮肤皱褶的厚度(图5)。超声波测量使用在直立位置检查前绘制的皮肤标记作为指标。仅单独测量皮肤厚度。 (图6)。在乳房X线照相术中,测量是在上侧和下侧的内外侧斜视图(MLO)和乳房内侧和外侧部分的头尾视图(CC)上进行的。 (图7)。特别是在没有脂肪饱和的T1序列中使用乳房MRI,其中可以容易地看到脂肪组织并且在相同水平下测量表皮和乳房实质之间的距离。 (图8)。因为在手术期间,患者处于背褥疮位置,术中测量(图9)是在术前确定的患者处于直立位置的皮肤标记区域中进行的。所有术前测量均由一个手术团队进行,术中测量由另一个手术团队进行,以确保盲目匹配。
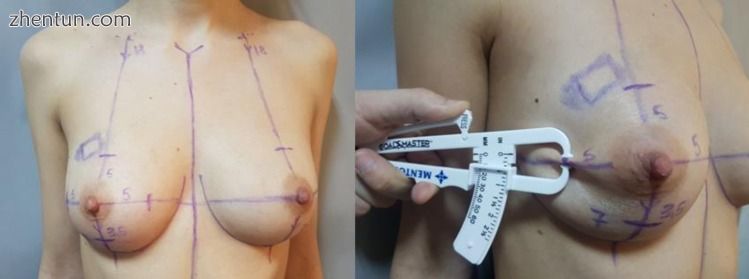
图5
临床检查 - 在已确定的点上进行夹点测试。
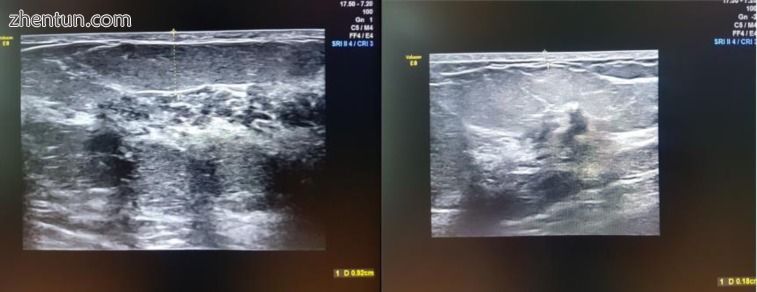
图6
术前乳房超声 - 皮下组织测量和皮肤厚度确定点。
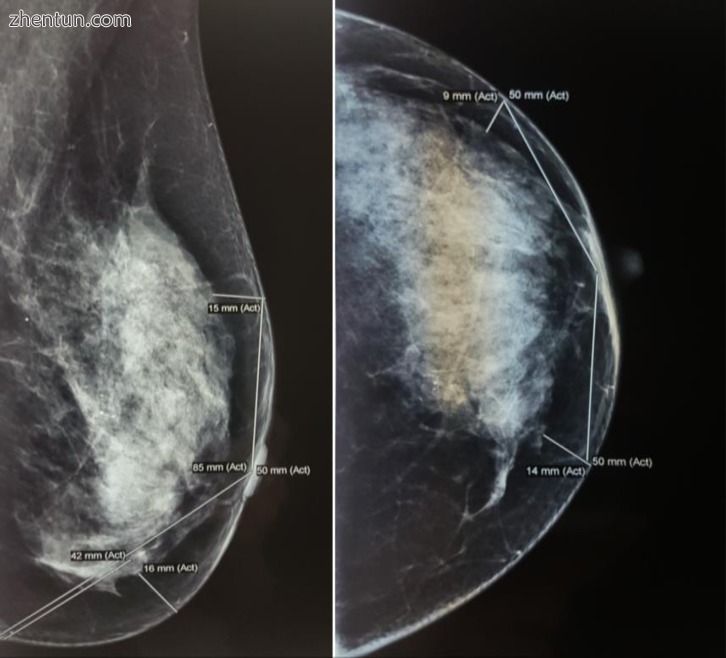
图7
术前左乳房乳房X光检查。 在2个视图中确定的皮下组织的测量:MLO和CC
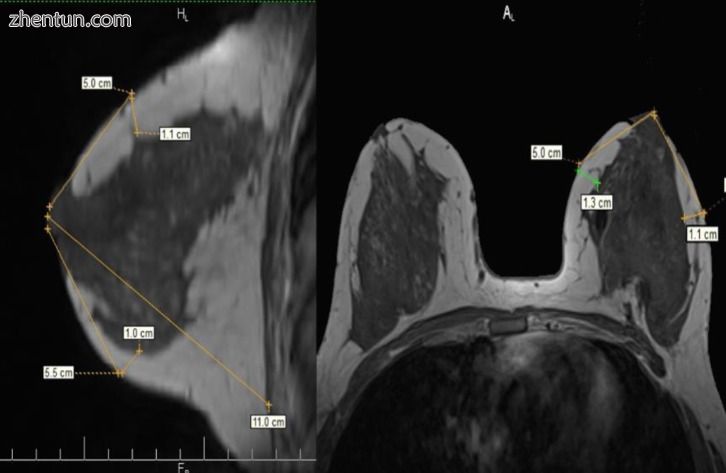
图8
术前乳房MRI在T1序列中无脂肪饱和。 在矢状面和横截面中确定的皮下层的测量。
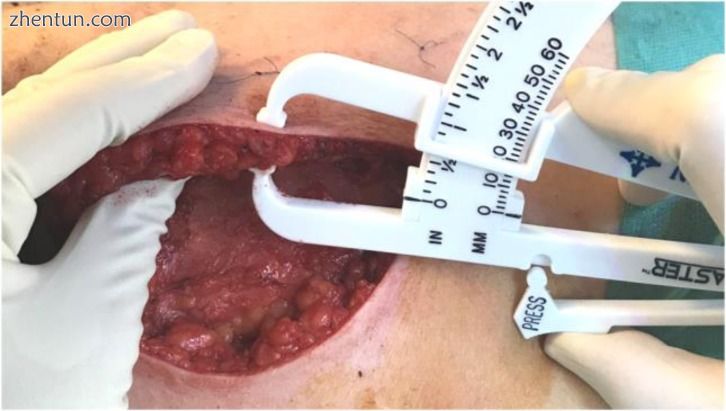
图9
在既定位进行乳房切除术后皮瓣的术中测量。
下一步是使用术前测量对60例患者进行基于种植体的乳房重建(IBBR),这些患者在保留乳头保留(NSM)或保留皮肤的乳房切除术(SSM)后,在2014年至2017年之间通过同一手术进行团队,在肿瘤研究所“教授。 Al. Trestioreanu“和一些私立医院。对53例患者进行了IBBR单侧乳房切除术,7例患者接受IBBR双侧乳房切除术:2例为双侧乳腺癌,5例为单侧乳腺癌和BRCA 1或2突变的降低风险的预防性乳房切除术。术前测量的结果是选择乳房重建手术技术的一个标准。考虑到皮瓣厚度的术前评估,将植入物完全置于胸大肌和前锯肌下(对于整个皮瓣较薄10mm),部分位于胸大肌下方,并由下侧的合成网覆盖(用于皮肤)在上部薄度超过10毫米)或在肌肉上方的皮瓣,完全被网状物覆盖360°或180°(对于厚度超过10毫米的整个皮瓣)。
除了估计皮瓣厚度外,还有其他与治疗决策相关的因素 - 肿瘤学因素:分期,疾病的扩展,肿瘤部位,术前治疗和术后放疗的可能性;解剖因素:巨乳症,下垂,体重指数和患者的个人偏好。
该研究仅包括最大2级眼睑下垂的患者。患有巨乳症的患者不包括在内。
用于评估乳房形状,乳房位置,种植体可视性和乳房动画的美学效果的主观尺度是:差,满意,良好和非常好。手术后6个月和每年进行评估。
结果
结果,在对50名乳腺癌患者进行临床检查,乳腺超声检查,乳房MRI和乳房X光检查后测量皮瓣,这些患者是没有乳房重建的MRM候选者,显示:临床检查中的值为10 mm至22 mm,超声波7.8毫米至15.4毫米,乳腺摄影7毫米至16毫米,MRI 7.9毫米至13.8毫米。术中测量值介于8 mm至14 mm之间。在术中评估后比较结果,他们显示MRI术前评估的准确率为90%,超声检查为87%,乳房X线照相术为81%,夹点测试为71%。
夹捏测试显示最厚的皮下层,与成像方法相比厚20%。超声,乳房X光检查和MRI估计更接近术中发现,在同一乳房中,四个区域之间的最高差异为12.5%。与术中发现相比,乳房MRI评估最准确。
所有测量结果均显示脂肪组织在乳房的所有象限中均匀分布。最厚的层位于乳房下皱褶附近。比较所有术前测量值,下极部皮下组织厚度增加32%。内象限比外象限厚3毫米。
复发性空间在术前难以评估,并且在该水平上重复的冷冻切片对于获得足够的厚度是最可靠的,并且在肿瘤学安全性和乳头 - 乳晕复合体(NAC)坏死的低风险之间具有适当的平衡。
皮肤厚度也沿着乳房表面变化,并且单独估计。与皮下层类似,超声测量显示乳房的下极和内象限皮肤厚,达2.2毫米。
根据术前测量计算所有67个即刻乳房重建。 20 NSM立即重建植入物和未受伤的肌肉,26 NSM植入物部分位于胸大肌下,并由下侧的合成网覆盖,11 SSM,部分位于胸大肌下,并由下侧的合成网覆盖10个SSM,植入物完全置于胸大肌和前锯肌下。没有不可预测的术中事件导致所有67次乳房重建的术前计划发生变化。
分析46 NSM和21 SSM的美学效果,在选择适当的乳房重建手术技术时考虑术前测量,患者和手术团队认为它们非常好。 (图10,1111)。
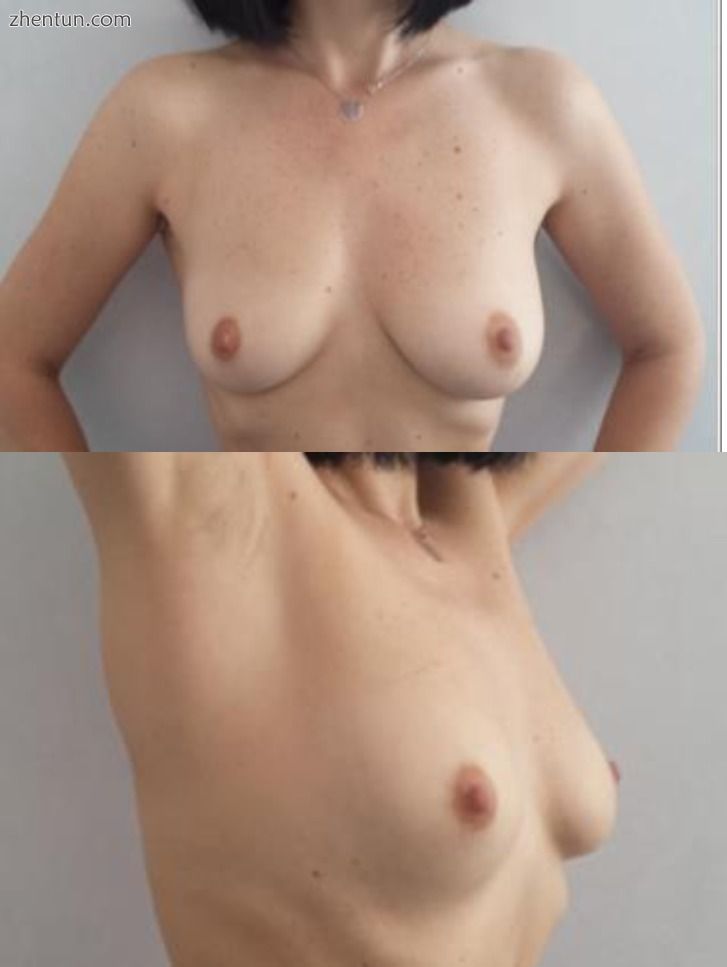
图10
对乳腺癌。 术前观。
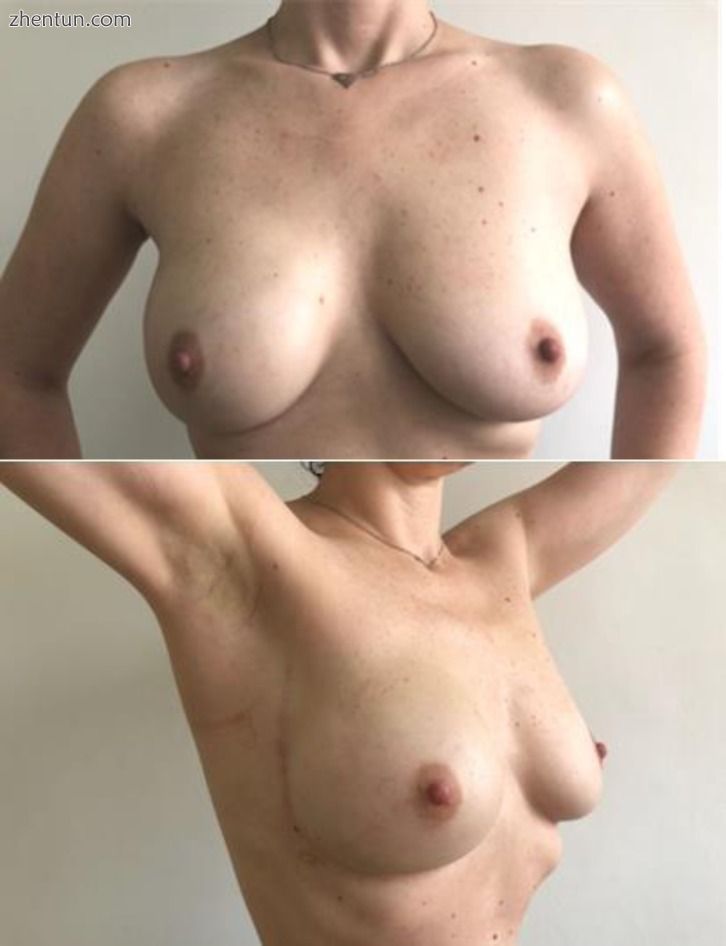
图11
术前皮瓣测量15 mm。使用解剖植入物CPG 321,315 CC和Seragyn网格进行右侧即刻乳房重建的右NSM。 6个月后的术后方面
考虑皮瓣或NAC坏死的并发症发生率为6%。在使用Becker植入物和保守治疗的两个部分NAC坏死的SSM之后存在一个部分皮瓣坏死,其具有明智的切口和立即的乳房重建。切口非常接近NAC可能是乳头血管形成中断的原因。只有一个完整的NAC坏死需要再次手术:皮肤切除和植入物置换(解剖植入物用Expander替换)。
经过2年的中位随访,一名26岁的BRCA1突变患者发生局部复发,拒绝任何辅助肿瘤治疗。患者有明显的家族史 - 母亲被诊断患有乳腺癌,一名28岁的妹妹在被诊断患有乳腺癌后2年死亡。在这种情况下,复发出现在术后18个月。
任何患者均未使用Lipofilling。在3名体重指数低于28的患者和植入肌肉平面上方的植入物中,注意到波纹和皱纹。这些患者的植入物覆盖厚度小于12mm。
两例患者接受术后放疗后皮肤回缩,上行植入和包膜挛缩,美学效果恶化。
讨论
NSM和SSM的目的是完全切除乳腺组织,同时保持足够的皮肤覆盖,以立即进行乳房重建。即使在根治性乳房切除术中,也不可能切除100%的乳房实质,并且剩余组织的数量与复发风险成正比。应特别在腋窝尾部,胸壁和后肢进行仔细解剖。 (4)
浅表乳房筋膜是皮瓣切除术中应该遵循的主要解剖学平面,但其存在是有争议的,并且在56%的患者中存在。合理的指导应该是乳房薄壁组织和皮下脂肪之间的平面,不一定对应于皮下筋膜层。 (5)
在44%的切除标本中没有表面层,并且在存在表层的42%的组织中,它包含乳房组织的岛。在表面层之外,没有发现乳房组织。仅有5%的样本遇到至少10毫米的距离,因此即使存在浅筋膜,由于与上覆皮肤的距离较小,对筋膜浅层的解剖也不会在皮肤上留下可行的皮瓣。 - 保留乳房切除术。 (6)
肿瘤外科医生长期以来注意到皮下水平的丛,其中乳房组织可以在相对无血管的平面中与皮下层分离,并且在该平面处的解剖将允许皮下神经丛的最佳保存以维持皮肤灌注。 (7)
皮瓣厚度是立即基于种植体的重建中美学结果和并发症发生率的关键因素,因此其测量可用于为这种类型的手术建立合适的候选者。外科医生也可以意识到乳房切片可能很难解剖的部位,因为乳房薄壁组织太靠近皮肤包膜。当然,老年患者的乳腺被脂肪组织取代,乳房薄壁组织应远离皮肤,但对于乳房非常密集的年轻患者,确定与皮肤的距离可能非常重要。
只有少数研究提到乳腺超声和乳房X光检查作为术前皮瓣评估的方法,但本文已经证明这些方法可靠且简单。乳房X光检查和乳房MRI测量具有局限性,因为不可能计算距乳房表面上的乳头5cm的距离,具有直线而不是弯曲的直线。此外,对于乳房MRI,患者处于腹侧褥疮位置。
在几项研究中使用术前和术后乳腺磁共振成像来确定皮瓣厚度与其相对于皮瓣坏死风险的重要性之间的差异。 J.D. Frey等人。使用MRI评估显示术前和术后皮肤组织厚度的估计差异。乳头保留乳房切除术(NSM)皮瓣厚度的平均术前皮肤 - 皮下组织总厚度为11.4 mm。术后平均皮瓣厚度为8.7 mm。术后皮瓣厚度小于8.0 mm被发现是缺血性并发症的独立预测因子。 (8)
本研究中的低并发症发生率是根据术前测量选择种植体和手术技术的结果。
当选择植入物的上部放置时,腋窝尾部和内部象限的上外象限中的脂肪组织导致不具有可见的植入物边缘。然而,如果植入物的轮廓是可见的,则可以通过脂肪填充技术改善重建乳房的形状。通过使用夹点测试的临床评估与美学结果高度相关,并且在上杆中具有至少1.2cm的夹捏测试的患者具有更重建的乳房的更自然的方面。捏拉试验可能受到乳房下垂等级的影响。
皮肤厚度达2.2毫米的研究结果与文献中的相似。 (9)
皮下脂肪依赖于患者的BMI和年龄 - 超重,老年患者的皮肤下有较厚的脂肪组织。出于同样的原因,乳房X线照相术对老年患者和年轻患者的超声检查更好。乳房MRI测量结果与年龄无关。
皮瓣厚度不是导致皮肤或乳头乳晕坏死的唯一参数。
皮瓣缺血的危险因素是有争议的。在计划NSM时,可以考虑通过术前MRI评估乳房血管分布,因为乳房双重血液供应的存在与NSM后乳头 - 乳晕复合体和皮瓣缺血和坏死的风险降低相关。在研究164例NSM中,24.4%的患者出现乳头乳晕复合体或皮瓣缺血或坏死,手术并发症与年龄,吸烟史,BMI,NSM适应证,手术标本体重,既往放射治疗,外科手术无关单变量分析的切口类型,重建方法或手术医生。 (10)
与以前的研究不同,最近的研究表明,有部分或全层坏死的预测性患者风险因素,如吸烟,糖尿病,肥胖,放疗,既往疤痕和严重的医学合并症。 (11)
切口也是一个重要的风险因素。皮肤皮瓣全层坏死的风险在明智的皮肤保留乳房切除术中更高,并且达到近30%。研究了两组假设预测因子:患者相关(年龄,体重指数,吸烟,新辅助化疗)和手术相关(植入物重量,乳房重量,治疗性预防程序,腋窝淋巴结清扫术)。只有吸烟和高于468克的假体重量与皮瓣缺血性并发症显著相关。 (12)
另一项研究揭示了重要的危险因素,即:吸烟,年龄小,切口类型 - 肛门周围和上方圆形切口有较高的坏死风险和NAC累及乳晕皮瓣厚度低于5 mm。 (13)
在本研究中,患者在手术前未接受放疗。平均BMI为25.5,两名患有部分NAC坏死的患者均有吸烟史。乳房切除术的切口对皮瓣安全性至关重要。患者对小切口感兴趣,但可能需要过多地收回皮肤,并且长时间使用牵开器会影响皮瓣的血管形成。我们研究中的大多数NSM是使用侧面或下侧切口进行的。一个切口是放射状的,靠近NAC,患者有部分NAC坏死。
使用电手术刀进行皮瓣切开术。谐波手术刀可能是一个很好的选择,减少术后引流,血清肿发展,术中失血和伤口并发症,而不增加手术时间。 (14)但是,其他研究得出的结论是,它不优于电烙术来减少腋窝引流。 (15)
在术中,可以使用激光辅助的吲哚菁绿染料血管造影术,荧光素染料血管造影术或光学扩散成像光谱法评估皮瓣组织的活力。
激光辅助吲哚青绿染料血管造影已与荧光素染料血管造影相比较,吲哚青绿染料比荧光素染料更好地预测乳房切除术皮瓣坏死。 (16)激光辅助吲哚青绿(ICG)血管造影可以在术中定位灌注不良的区域。 SPY Elite(®)值≤7可准确预测皮瓣坏死的发展,敏感性为88%,特异性为83%。假阳性病例(灌注值≤7且未发生坏死的病例)更有可能有吸烟史,或者在乳房切除术中使用含有肾上腺素的肿胀溶液。 (17)
光学扩散成像光谱(ViOptix T.Ox组织血氧计)测量氧合血红蛋白与脱氧血红蛋白在1×1cm面积上的比率,以获得灌注的非侵入性测量(StO2)。研究了ViOptix T.Ox组织血氧计预测乳房切除术坏死的能力,导致坏死的统计学显著因素是:内侧皮瓣StO2减少,下皮瓣StO2减少和皮瓣长度减少。可以利用StO2减少来识别乳房切除术皮瓣中受损的灌注。 (18)
如果出现皮瓣坏死,则有不同的管理选择。
保守治疗适用于2例部分NAC坏死患者。局部伤口护理:每日更换敷料和清创剂以及局部肝素和松散敷料,以防止因压迫而导致额外的局部缺血。
其他物质如葡聚糖-40和局部硝酸甘油可用于预防或治疗坏死。右旋糖酐-40治疗不影响皮瓣坏死的发展。然而,如果已经发生坏死,则用葡聚糖-40治疗改善皮瓣的坏死区域。 (19)早期干预降低了选定病例中乳房切除术皮瓣坏死(MSFN)的发病率。局部硝酸甘油软膏可能有助于在立即重建后减少MSFN,但证据基础仍然有限。 (11)
对于完全NAC坏死需要再次植入植入物的患者,在患者拒绝第二次手术并且保守治疗期间观察到皮瓣坏死的进展。切除受影响的皮肤和合成网状物的暴露部分,同时更换植入物 - 放置扩张器而不是解剖器。
基于种植体的即刻重建中的组织坏死需要更加谨慎地对待,并且可以说比自体组织重建更具侵略性。 (20)然而,对于较大的全层伤口,在观察到乳房切除术后皮肤坏死进行清创,初次闭合和/或皮肤移植后,将患者带回手术室可能更为合适。其他作者已经描述了一种更为保守的大面积皮肤坏死方法,因为早期手术干预会产生轮廓和体积异常,后来更难以纠正。通过二次意图愈合也消除了皮肤移植物可能产生的“拼凑”外观。在边缘皮肤处保持潮湿的环境,使用渗透焦痂并促进分离的抗生素软膏,以及在颗粒状表面上湿润至干燥的敷料是这种伤口护理的有效策略。 (21)
从肿瘤学和美学角度看乳房切除术和IBBR术后的良好结果,需要进行术前测量,例如仔细解剖导致可行的皮瓣和适当选择种植体类型和位置(前/后行)。
结论
临床评估,乳房超声,乳房MRI和乳房X线照相术后乳房切除术皮瓣厚度的术前评估可用于估计立即基于种植体的乳房重建,适当的假体和外科手术的可能性。术前测量与术中发现之间存在很强的相关性,并且所有四种方法的关联都可以获得最佳结果。
参考:
Assessment of Mastectomy Skin Flaps for Immediate Implant-Based Breast Reconstruction
1. Patani N, Mokbel K. Oncological and aesthetic considerations of skin-sparing mastectomy. Breast Cancer Res Treat. 2008:111. [PubMed] [Google Scholar]
2. Endara M, Chen D, Verma K, Nahabedian MY, Spear SL. Breast reconstruction following nipple-sparing mastectomy: a systematic review of the literature with pooled analysis. s.l. Plast Reconstr Surg. 2013:132. [PubMed] [Google Scholar]
3. Bricout Nathalie. Breast Surgery. Nathalie Bricout. Springer Science & Business Media. 2013:10–11. [Google Scholar]
4. van Verschuer Victorien MT, Maijers Marike C., van Deurzen Carolien HM, Koppert Linetta B. Oncological safety of prophylactic breast surgery: skin-sparing and nipple-sparing versus total mastectomy. Gland Surg. 2015;4(6) [PMC free article] [PubMed] [Google Scholar]
5. Robertson SA, Rusby JE, Cutress RI. Determinants of optimal mastectomy skin flaps thickness. Br J Surg. 2014:899–911. [PubMed] [Google Scholar]
6. Beer GM, Varga Z, Budi S, Seifert B, Meyer VE. Incidence of the superficial fascia and its relevance in skin-sparing mastectomy. Cancer. 2002:1619–1625. [PubMed] [Google Scholar]
7. Carlson GW, Bostwick J 3rd, Styblo TM, Moore Skin-sparing mastectomy. Oncologic and reconstructive consideration. Ann Surg. 1997:570–575. [PMC free article] [PubMed] [Google Scholar]
8. Frey JD, Salibian AA, Choi M, Karp NS1. Mastectomy Flap Thickness and Complications in Nipple-Sparing Mastectomy: Objective Evaluation using Magnetic Resonance Imaging. Plast Reconstr Surg Glob Open. 2017 [PMC free article] [PubMed] [Google Scholar]
9. Pope TL Jr, Read ME, Medsker T, Buschi AJ, Brenbridge AN. Breast skin thickness: normal range and causes of thickening shown on film-screen mammography. J Can Assoc Radiol. 1984;35(4):365–8. [PubMed] [Google Scholar]
10. Bahl M1, Pien IJ, Buretta KJ, Hwang ES, Greenup RA, Ghate SV, Hollenbeck ST. Can Vascular Patterns on Preoperative Magnetic Resonance Imaging Help Predict Skin Necrosis after Nipple-Sparing Mastectomy? J Am Coll Surg. 2016:223. [PubMed] [Google Scholar]
11. Robertson SA, Jeevaratnam JA, Agrawal A, Cutress RI. Mastectomy skin flap necrosis: challenges and solutions. Breast Cancer (Dove Med Press) 2017:13. [PMC free article] [PubMed] [Google Scholar]
12. Santanelli F1, Longo B, Sorotos M, Farcomeni A, Paolini G. Flap survival of skin-sparing mastectomy type IV: a retrospective cohort study of 75 consecutive cases. Ann Surg Oncol. 2013:981–989. [PubMed] [Google Scholar]
13. Algaithy ZK, Petit JY, Lohsiriwat V, Maisonneuve P, Rey PC, Baros N, Lai H, Mulas P, Barbalho DM, Veronesi P, Rietjens M. Nipple sparing mastectomy: can we predict the factors predisposing to necrosis? Eur J Surg Oncol. 2012:125–129. [PubMed] [Google Scholar]
14. Huang Jinbo, Yu Yinghua, Wei Changyuan, Qin Qinghong, Mo Qinguo, Yang Weiping. Harmonic Scalpel versus Electrocautery Dissection in Modified Radical Mastectomy for Breast Cancer: A Meta-Analysis. PLoS One. 2015;10(11):e0142271. [PMC free article] [PubMed] [Google Scholar]
15. Manjunath Suraj, Ramesh Rakesh S., Shivakumar K, Goel Vipin. Ultrasonic Shears Versus Electrocautery in Axillary Dissection for Breast Cancer—A Randomized Controlled Trial. Indian J Surg Oncol. 2014;5(2):95–98. [PMC free article] [PubMed] [Google Scholar]
16. Phillips BT1, Lanier ST, Conkling N, Wang ED, Dagum AB, Ganz JC, Khan SU, Bui DT. Intraoperative perfusion techniques can accurately predict mastectomy skin flap necrosis in breast reconstruction: results of a prospective trial. Plast Reconstr Surg. 2012:778–788. [PubMed] [Google Scholar]
17. Munabi NC, Olorunnipa OB, Goltsman D, Rohde CH, Ascherman JA. The ability of intra-operative perfusion mapping with laser-assisted indocyanine green angiography to predict mastectomy flap necrosis in breast reconstruction: a prospective trial. J Plast Reconstr Aesthet Surg. 2014:449–455. [PubMed] [Google Scholar]
18. Rao R, Saint-Cyr M, Ma AM, Bowling M, Hatef DA, Andrews V, Xie XJ, Zogakis T, Rohrich R. Prediction of post-operative necrosis after mastectomy: a pilot study utilizing optical diffusion imaging spectroscopy. World J Surg Oncol. 2009 [PMC free article] [PubMed] [Google Scholar]
19. Yildiz BD1, Sulu B. Effects of dextran-40 on flap viability after modified radical mastectomy. Can J Plast Surg. 2013:83–86. [PMC free article] [PubMed] [Google Scholar]
20. Miller Travis J, Sue Gloria R, Gordon K. Mastectomy. 2016. Mastectomy Skin Necrosis: Risk Factors, Prevention, and Management. p. Chapter 1. [Google Scholar]
21. Patel KM, Hill LM, Gatti ME, Nahabedian MY. Management of massive mastectomy skin flap necrosis following autologous breast reconstruction. Ann Plast Surg. 2012:139–144. [PubMed] [Google Scholar] |