遗传性痉挛性截瘫(HSP)是一组遗传性疾病,其主要特征是进行性步态障碍。该疾病表现为进行性僵硬(痉挛)和下肢收缩。[1] HSP也被称为遗传性痉挛性下肢瘫痪,家族性痉挛性截瘫,法国人定居疾病或Strumpell-Lorrain疾病。症状是脊髓中长轴突功能障碍的结果。受影响的细胞是主要的运动神经元;因此,这种疾病是一种上运动神经元疾病。[2] HSP不是脑瘫的一种形式,即使它在身体上可能出现并且表现与痉挛性双瘫大致相同。 HSP的起源不同于脑瘫。尽管如此,痉挛性脑瘫中使用的一些相同的抗痉挛药物有时也用于治疗HSP症状。
HSP是由蛋白质,结构蛋白,细胞维持蛋白质,脂质和其他物质通过细胞转运的缺陷引起的。长神经纤维(轴突)受到影响,因为长距离使神经细胞对这些提到的机制中的缺陷特别敏感。[3] [4]
德国神经病学家AdolphSeeligmüller在1876年[5]首次提到这种疾病,他描述了四个患有痉挛状态的患儿。德国神经病学家AdolphStrümpell于1883年[6] [7]描述了其他病例。 1888年,法国医生莫里斯·洛林(Maurice Lorrain)更广泛地描述了这些病例。[8]由于它们在描述疾病方面的贡献,它仍然在法语国家被命名为Strümpell-Lorrain疾病。遗传性痉挛性截瘫这一术语是由Anita Harding在1983年创造的。[9]
目录
1 症状和体征
1.1 发病年龄
2 原因
2.1 基因型
3 病理生理学
3.1 轴突寻路
3.2 脂质代谢
3.3 内体运输
3.4 线粒体功能
4 诊断
4.1 分类
5 治疗
6 预后
7 流行病学
8 参考
体征和症状
症状取决于继承的HSP的类型。该疾病的主要特征是由于锥体束功能障碍导致的下肢进行性痉挛。这也导致快速的反射,伸肌腱反射,肌肉无力和可变的膀胱紊乱。此外,HSP的核心症状还包括步态异常和行走困难,脚踝的振动感减弱和感觉异常。[10]患有HSP的个体可能会出现与中枢神经系统和神经肌肉疾病相关的极度疲劳,这可能是致残的。[11] [12] [13]最初的症状通常是平衡困难,趾部残留或绊倒。 HSP的症状可能从任何年龄开始,从婴儿期到60岁以上。如果症状在青少年时期或之后开始,则痉挛性步态紊乱通常会持续多年。最终可能需要手杖,助行器和轮椅,尽管有些人从不需要辅助设备。[14]已经描述残疾在成人发病形式中进展得更快。[15]
更具体地,具有常染色体显性纯粹形式的HSP的患者显示正常的面部和眼外运动。虽然老年人的下颚挺举可能很活跃,但没有语言障碍或吞咽困难。上肢肌张力和力量正常。在下肢,腿筋,股四头肌和脚踝的肌张力增加。髂腰肌,胫骨前肌以及较小程度的腿筋肌肉最为显著。[15]在疾病的复杂形式中,存在其他症状。这些包括:周围神经病变,肌萎缩,共济失调,精神发育迟滞,鱼鳞病,癫痫,视神经病变,痴呆,耳聋或言语,吞咽或呼吸问题。[16]
Anita Harding [9]将HSP分类为纯粹而复杂的形式。纯HSP表现为下肢痉挛,伴有神经源性膀胱紊乱以及缺乏振动敏感性(pallhypesthesia)。另一方面,当下肢痉挛与任何其他神经症状相结合时,HSP被归类为复杂的。
这种分类是主观的,患有复杂性HSP的患者有时被诊断为患有痉挛,精神发育迟滞(痉挛)或脑白质营养不良的小脑性共济失调[9]。下面列出的一些基因已经在其他疾病中描述,而不是之前的HSP。因此,一些关键基因与其他疾病群重叠。
发病年龄
在过去,HSP被分类为早期发病,从儿童早期开始或在成年后发病。发病年龄在2岁和40岁左右有两个最高点。[17]新的研究结果表明,较早的发病会导致疾病持续时间延长而不会失去行走或需要使用轮椅。[17]这也在前面描述过,后来的发病形式发展得更快。[15]
原因
HSP是一组遗传性疾病。它遵循一般遗传规则,可以常染色体显性遗传,常染色体隐性遗传或X连锁隐性方式遗传。所涉及的遗传方式直接影响遗传疾病的机会。已经描述了70多种基因型,并且超过50个基因座与这种情况有关。[18]已经鉴定了具有常染色体显性遗传的10个基因。其中一个SPG4占所有遗传解决病例的约50%,约占所有HSP病例的25%。[17]已知十二种基因以常染色体隐性方式遗传。后一组共占约1/3的病例。
大多数改变的基因具有已知功能,但对于某些功能尚未确定。所有这些都列在下面的基因列表中,包括它们的继承方式。一些例子是spastin(SPG4)和paraplegin(SPG7)都是AAA ATP酶。[19]
基因型
这些基因被命名为SPG(痉挛性步态基因)。基因位置的格式为:染色体 - 臂(短或p:长或q) - 带数。这些名称仅适用于人类基因。这些位置可能(并且可能会)在其他生物体中变化。尽管已知有多少基因参与这种疾病,但仍有40%的病例尚未确定病因[20]。在SPG下面的表格中?用于表示与HSP相关但尚未获得官方HSP基因命名的基因。
病理生理学
HSP的主要特征是长度依赖性轴索变性。[21] 这些包括交叉和未交叉的皮质脊髓束到腿和股四头肌束。 脊髓小脑束受到较小程度的影响。 退化轴突的神经元细胞体得以保留,并且没有原发性脱髓鞘的证据。[18] 在一些病例中观察到脊髓前角细胞的损失。 背根神经节,后根和周围神经不直接受影响。
HSP影响运动神经元中的几种途径。 鉴定了许多基因并与HSP相关联。 准确定义每个受影响途径中的关键参与者仍然是一个挑战,主要是因为许多基因具有多种功能并参与多个途径(图)。
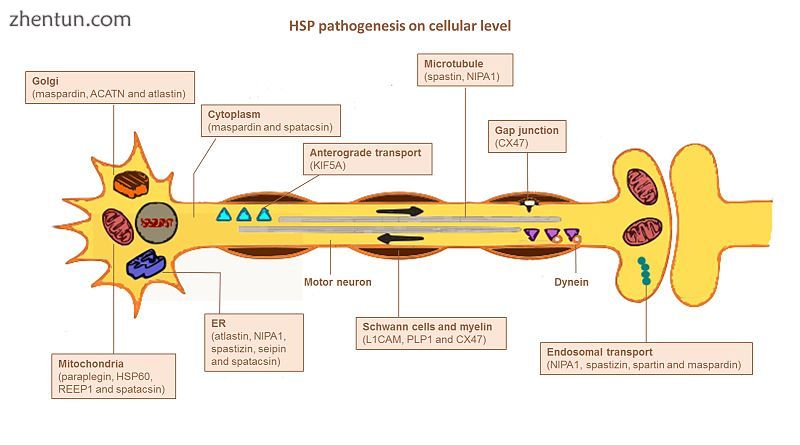
细胞水平的HSP发病机制概述。描绘了在每个途径中鉴定的受影响基因。
轴突寻路
寻路对于轴突生长到正确的目的地(例如另一个神经细胞或肌肉)很重要。这种机制的重要性是L1CAM基因,即免疫球蛋白超家族的细胞表面糖蛋白。在其他X连锁综合征中也发现导致L1CAM功能丧失的突变。所有这些疾病都表现出皮质脊髓束损伤(HSP的一个标志性特征)。 L1CAM参与一系列相互作用,结合其他L1CAM分子以及细胞外细胞粘附分子,整合素和蛋白聚糖或细胞内蛋白质如锚蛋白。
通过L1CAM与神经毡蛋白-1的结合发生寻路缺陷。 Neurophilin-1与Plexin-A蛋白相互作用形成Semaporin3A受体复合物。然后Semaporin3A在腹侧脊髓中释放,以使皮质脊髓神经元远离中线脊髓/髓质连接处。如果L1CAM由于突变而无法正常工作,则皮质脊髓神经元不会被引导到正确位置并且发生损伤。[3]
脂质代谢
中枢和周围神经系统的轴突涂有绝缘层,髓鞘层,以增加动作电位传播的速度。在某些形式的hsp HSP中检测到CNS中的异常髓鞘形成。[22]有几个基因与髓鞘畸形有关,即PLP1,GFC2和FA2H。[3]突变改变髓鞘组成,厚度和完整性。
内质网(ER)是脂质合成的主要细胞器。编码具有塑造ER形态和脂质代谢作用的蛋白质的基因中的突变与HSP相关。 ATL1,BSCL2和ERLIN2的突变改变ER结构,特别是管状网络和ER小管中三向连接的形成。许多突变基因与脂质代谢异常有关。最常见的作用是花生四烯酸(CYP2U1)和胆固醇(CYP7B1)代谢,磷脂酶活性(DDHD1和DDHD2),神经节苷脂形成(B4GALNT-1)和碳水化合物与脂肪代谢之间的平衡(SLV33A1)。[3] [23 ] [22]
内体运输
神经元通过内吞作用从周围吸收物质。内吞囊泡与内体融合以释放其内容物。有三个主要的区室有内体运输:高尔基体往/来自内体;质膜到/来自早期内体(通过再循环内体)和晚期内体到溶酶体。如HSP中所报道的,内体运输的功能障碍可能在具有长轴突的运动神经元中具有严重后果。 AP4B1和KIAA0415中的突变与囊泡形成和膜运输中的紊乱有关,包括选择性摄取蛋白质进入囊泡。这两种基因编码的蛋白质与其他几种蛋白质相互作用,破坏分泌和内吞途径。[22]
线粒体功能
线粒体功能障碍与发育和退行性神经障碍有关。只有少数HSP基因编码线粒体蛋白。两种线粒体驻留蛋白在HSP中突变:paraplegin和伴侣蛋白60. Paraplegin是线粒体内膜的m-AAA金属蛋白酶。它在核糖体组装和蛋白质质量控​​制中起作用。受控的伴侣蛋白60活性导致线粒体质量控制受损。两个基因DDHD1和CYP2U1显示患者成纤维细胞中线粒体结构的改变。这些基因编码参与脂肪酸代谢的酶。
诊断
HSP的初步诊断依赖于家族史,是否存在其他体征,排除其他非痉挛性原因,后者在散发病例中尤为重要。[9]
脑和脊髓MRI是一种重要的手术,用于排除其他常见的神经系统疾病,如多发性硬化,但也可以检测相关的异常,如小脑或胼call体萎缩以及白质异常。 HSP的鉴别诊断还应排除痉挛性双瘫,其具有几乎相同的日常效果,甚至可用类似药物如巴氯芬和整形外科手术治疗;有时,这两种情况可能看起来和感觉如此相似,以至于唯一感知的差异可能是HSP的遗传性质与痉挛性双瘫的明显非遗传性质(然而,与痉挛性双瘫和其他形式的痉挛性脑瘫不同,HSP不能可靠用选择性背根神经切断术治疗)。
只能通过针对已知基因突变进行基因检测来提供HSP诊断的最终确认。
分类
遗传性痉挛性截瘫可根据症状进行分类;继承方式;患者的发病年龄;受影响的基因;和生化途径。
治疗
没有特定的治疗可以预防,减缓或逆转HSP。可用的疗法主要包括对症治疗和促进身心健康。为HSP患者提供的治疗包括:
巴氯芬 - 一种自主肌肉松弛剂,可以放松肌肉,减少紧张。这可以口服或鞘内给药。 (HSP研究[24] [25] [26])
替扎尼定 - 治疗夜间或间歇性痉挛(可用研究[27] [28])
地西泮和氯硝西泮 - 降低痉挛强度
奥昔布宁氯化物 - 一种无意识的肌肉松弛剂和解痉剂,用于减少膀胱控制问题患者的膀胱痉挛
托特罗定酒石酸盐 - 一种无意识的肌肉松弛剂和解痉剂,用于减少膀胱控制问题患者的膀胱痉挛
肉毒杆菌毒素 - 减少肌肉过度活跃(现有的HSP患者研究[29] [30])
对于经历临床抑郁症的患者,抗抑郁药(如选择性5-羟色胺再摄取抑制剂,三环类抗抑郁药和单胺氧化酶抑制剂)
物理治疗 - 恢复和保持移动能力;减少肌肉张力;保持或改善运动范围和流动性;增加力量和协调;预防并发症,如关节冻结,挛缩或褥疮。
预测
尽管HSP是一种进行性疾病,但HSP患者的预后差异很大。它主要影响腿部,尽管某些人可能会有一些上身受累。有些病例严重致残,而其他病例则较少致残,并且与高效和充实的生活兼容。大多数患有HSP的人的预期寿命正常。[16]
流行病学
在世界范围内,所有遗传性痉挛性截瘫合并的患病率估计在10万人中为2至6人。[31] 2009年3月发表的挪威对超过250万人的研究发现,HSP患病率为7.4 / 100,000人口 - 这一比例较高,但与之前的研究范围相同。 没有发现与性别有关的比率差异,平均发病年龄为24岁。[32] 在美国,遗传性痉挛性截瘫被美国国立卫生研究院的罕见疾病办公室(ORD)列为“罕见疾病”,这意味着该疾病影响美国人口中不到20万人。[31]
参考
Fink, John K. (2003-08-01). "The hereditary spastic paraplegias: nine genes and counting". Archives of Neurology. 60 (8): 1045–1049. doi:10.1001/archneur.60.8.1045. ISSN 0003-9942. PMID 12925358.
Depienne, Christel; Stevanin, Giovanni; Brice, Alexis; Durr, Alexandra (2007-12-01). "Hereditary spastic paraplegias: an update". Current Opinion in Neurology. 20 (6): 674–680. doi:10.1097/WCO.0b013e3282f190ba. ISSN 1350-7540. PMID 17992088.
Blackstone, Craig (21 July 2012). "Cellular Pathways of Hereditary Spastic Paraplegia". Annual Review of Neuroscience. 35 (1): 25–47. doi:10.1146/annurev-neuro-062111-150400. PMC 5584684. PMID 22540978.
De Matteis, Maria Antonietta; Luini, Alberto (2011-09-08). "Mendelian disorders of membrane trafficking". The New England Journal of Medicine. 365 (10): 927–938. doi:10.1056/NEJMra0910494. ISSN 1533-4406. PMID 21899453.
Seeligmuller A. Sklerose der Seitenstränge des Rückenmarks bei vier Kindern derselben Familie. Dtsch Med Wschr. 1876;2:185-6.
Strümpell A. Zur Kenntniss der multiplen degenerativen Neuritis. Archiv f Psychiatrie. 1883;14(2):339-58.
Strümpell A. Beiträge zur Pathologie des Rückenmarks. European Archives of Psychiatry and Clinical Neuroscience. 1880;10(3):676-717.
Lorrain, Maurice. Contribution à l'étude de la paraplégie spasmodique familiale: travail de la clinique des maladies du système nerveux à la Salpêtrière. G. Steinheil, 1898.
Harding, AE (1983). Classification of the hereditary ataxias and paraplegias. New York: Lancet.
McAndrew CR, Harms P (2003). "Paraesthesias during needle-through-needle combined spinal epidural versus single-shot spinal for elective caesarean section". Anaesthesia and Intensive Care. 31 (5): 514–517. PMID 14601273.
Fjermestad, Krister W.; Kanavin, Øivind J.; Næss, Eva E.; Hoxmark, Lise B.; Hummelvoll, Grete (2016-07-13). "Health survey of adults with hereditary spastic paraparesis compared to population study controls". Orphanet Journal of Rare Diseases. 11 (1): 98. doi:10.1186/s13023-016-0469-0. ISSN 1750-1172. PMC 4944497. PMID 27412159.
Chaudhuri, Abhijit; Behan, Peter O. (2004-03-20). "Fatigue in neurological disorders". Lancet. 363 (9413): 978–988. doi:10.1016/S0140-6736(04)15794-2. ISSN 1474-547X. PMID 15043967.
"Hereditary spastic paraplegia". nhs.uk. 2017-10-18. Retrieved 2018-01-28.
Fink JK (2003). "The Hereditary Spastic Paraplegias". Archives of Neurology. 60 (8): 1045–1049. doi:10.1001/archneur.60.8.1045. PMID 12925358.
Harding AE (1981). "Hereditary "pure" spastic paraplegia: a clinical and genetic study of 22 families". Journal of Neurology, Neurosurgery, and Psychiatry. 44 (10): 871–883. doi:10.1136/jnnp.44.10.871. PMC 491171. PMID 7310405.
Depienne C, Stevanin G, Brice A, Durr A (2007). "Hereditary Spastic Paraplegia: An Update". Current Opinion in Neurology. 20 (6): 674–680. doi:10.1097/WCO.0b013e3282f190ba. PMID 17992088.
Schüle, Rebecca; Wiethoff, Sarah; Martus, Peter; Karle, Kathrin N.; Otto, Susanne; Klebe, Stephan; Klimpe, Sven; Gallenmüller, Constanze; Kurzwelly, Delia (2016-04-01). "Hereditary spastic paraplegia: Clinicogenetic lessons from 608 patients". Annals of Neurology. 79 (4): 646–658. doi:10.1002/ana.24611. ISSN 1531-8249. PMID 26856398.
Schüle R, Schöls L (2011) Genetics of hereditary spastic paraplegias. Semin Neurol 31(5):484-493
Wang YG, Shen L (2009) AAA ATPases and hereditary spastic paraplegia. Zhonghua Yi Xue Yi Chuan Xue Za Zhi 26(3):298-301
Helbig KL, Hedrich UB, Shinde DN, Krey I, Teichmann AC, Hentschel J, Schubert J, Chamberlin AC, Huether R, Lu HM4, Alcaraz WA, Tang S, Jungbluth C, Dugan SL, Vainionpää L, Karle KN, Synofzik M, Schöls L, Schüle R, Lehesjoki AE, Helbig I, Lerche H, Lemke JR (2016) A recurrent mutation in KCNA2 as a novel cause of hereditary spastic paraplegia and ataxia. Ann Neurol 80(4)
Wharton SB, McDermott CJ, Grierson AJ, Wood JD, Gelsthorpe C, Ince PG, Shaw PJ (2003) The cellular and molecular pathology of the motor system in hereditary spastic paraparesis due to mutation of the spastin gene. J Neuropathol Exp Neurol 62:1166–1177
Noreau, A., Dion, P.A. & Rouleau, G.A., 2014. Molecular aspects of hereditary spastic paraplegia. Experimental Cell Research, 325(1), pp.18–26
Lo Giudice, T. et al., 2014. Hereditary spastic paraplegia: Clinical-genetic characteristics and evolving molecular mechanisms. Experimental Neurology, 261, pp.518–539.
Margetis K, Korfias S, Boutos N, Gatzonis S, Themistocleous M, Siatouni A, et al. Intrathecal baclofen therapy for the symptomatic treatment of hereditary spastic paraplegia. Clinical Neurology and Neurosurgery. 2014;123:142-5.
Heetla HW, Halbertsma JP, Dekker R, Staal MJ, van Laar T. Improved Gait Performance in a Patient With Hereditary Spastic Paraplegia After a Continuous Intrathecal Baclofen Test Infusion and Subsequent Pump Implantation: A Case Report. Archives of Physical Medicine and Rehabilitation. 2015;96(6):1166-9.
Klebe S, Stolze H, Kopper F, Lorenz D, Wenzelburger R, Deuschl G, et al. Objective assessment of gait after intrathecal baclofen in hereditary spastic paraplegia. Journal of Neurology. 2005;252(8):991-3.
Knutsson E, Mårtensson A, Gransberg L. Antiparetic and antispastic effects induced by tizanidine in patients with spastic paresis. Journal of the Neurological Sciences. 1982;53(2):187-204.
Bes A, Eyssette M, Pierrot-Deseilligny E, Rohmer F, Warter JM. A multi-centre, double-blind trial of tizanidine, a new antispastic agent, in spasticity associated with hemiplegia. Current Medical Research and Opinion. 1988;10(10):709-18.
Hecht MJ, Stolze H, Auf Dem Brinke M, Giess R, Treig T, Winterholler M, et al. Botulinum neurotoxin type A injections reduce spasticity in mild to moderate hereditary spastic paraplegia— Report of 19 cases. Movement Disorders. 2008;23(2):228-33.
de Niet M, de Bot ST, van de Warrenburg BP, Weerdesteyn V, Geurts AC. Functional effects of botulinum toxin type-A treatment and subsequent stretching of spastic calf muscles: A study in patients with hereditary spastic paraplegia. Journal of rehabilitation medicine. 2015;47(2):147-53.
National Institute of Health (2008). "Hereditary Spastic Paraplegia Information Page". Retrieved 2008-04-30.
Erichsen, AK; Koht, J; Stray-Pedersen, A; Abdelnoor, M; Tallaksen, CM (June 2009). "Prevalence of hereditary ataxia and spastic paraplegia in southeast Norway: a population-based study" (PDF). Brain. 132 (Pt 6): 1577–88. doi:10.1093/brain/awp056. PMID 19339254. |