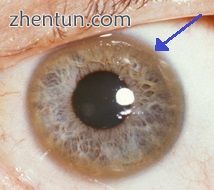
角膜边缘的棕色环(Kayser-Fleischer环)在威尔森氏病中很常见,特别是当出现神经症状时
威尔森氏病是一种遗传性疾病,其中铜在体内积聚。[1]症状通常与大脑和肝脏有关。[1]与肝脏相关的症状包括呕吐,虚弱,腹部积液,腿部肿胀,皮肤发黄,发痒[1]。与脑相关的症状包括震颤,肌肉僵硬,说话困难,性格改变,焦虑以及看到或听到别人没有的事情。[1]
由于Wilson病蛋白(ATP7B)基因突变,Wilson病是一种常染色体隐性遗传病。[1]对于受影响的人,他们必须从每个父母那里继承受影响的基因拷贝。[1]诊断可能很困难,通常包括血液检查,尿液检查和肝活检。[1]基因检测可用于筛查受影响者的家庭成员。[1]
威尔森氏病通常通过饮食改变和药物治疗。[1]饮食变化涉及进食低铜饮食而不使用铜炊具。[1]使用的药物包括螯合剂,如曲恩汀和d-青霉胺和锌补充剂。[1]威尔森氏病的并发症可能包括肝功能衰竭,肝癌和肾脏问题。[1]肝移植可能对其他治疗无效或肝功能衰竭的患者有帮助。[1]
威尔逊病大约发生在30,000人中。[1]症状通常在5至35岁之间开始,男性和女性同样受到影响。[1]它最初由Friedrich Theodor von Frerichs于1854年描述,并以Samuel Wilson的名字命名。[4]
目录
1 症状和体征
1.1 肝病
1.2 神经精神症状
1.3 其他器官系统
2 遗传学
3 病理生理学
4 诊断
4.1 血浆铜蓝蛋白
4.2 血清和尿铜
4.3 肝活检
4.4 基因检测
5 治疗
5.1 饮食
5.2 药物治疗
5.3 物理和职业治疗
5.4 移植
6 预后
7 历史记录
8 其他动物
9 参考
体征和症状
铜积累的主要部位是肝脏和大脑,因此肝脏疾病和神经精神症状是导致诊断的主要特征。[5]患有肝脏问题的人往往更早地接受医疗,通常是儿童或青少年,而不是那些有神经和精神症状的人,他们往往是二十几岁或更老。确定一些只是因为亲属被诊断患有威尔森氏病;其中许多,经过测试,结果已经出现症状,但没有得到诊断。[6]
肝病
肝病可能表现为疲倦,出血倾向增加或混淆(由于肝性脑病)和门静脉高压症。后者,门静脉压力明显增加的情况,导致食管静脉曲张,食道血管可能以危及生命的方式出血,以及脾脏肿大(脾肿大)和积聚腹腔内的液体(腹水)。在检查时,可以观察到慢性肝病的迹象,例如蜘蛛血管瘤(小的扩张血管,通常在胸部)。慢性活动性肝炎在出现症状时大多数引起肝硬化。虽然大多数肝硬化患者患肝细胞癌(肝癌)的风险增加,但威尔森氏病的风险相对较低。[5]
大约5%的人只有在发生暴发性急性肝功能衰竭时才会被诊断出来,通常是在溶血性贫血(由于红细胞破坏引起的贫血)的情况下。这导致蛋白质产生异常(通过紊乱的凝血鉴定)和肝脏代谢。紊乱的蛋白质代谢导致血液中的氨等废物积累。当这些刺激大脑时,该人会出现肝性脑病(混乱,昏迷,癫痫发作,最后是危及生命的大脑肿胀)。[5]
神经精神症状
大约一半患有威尔森氏病的人有神经或精神症状。大多数人最初都有轻微的认知恶化和笨拙,以及行为的改变。通常随后会出现特定的神经系统症状,通常以帕金森病(齿轮僵硬,运动迟缓或运动减慢以及缺乏平衡是最常见的帕金森病特征[7])的形式出现,伴有或不伴有典型的手颤,蒙面面部表情,言语不清,共济失调(缺乏协调)或肌张力障碍(身体某部分的扭曲和重复运动)。癫痫发作和偏头痛似乎在威尔逊病中更常见。[5]威尔逊的许多人都遇到了被描述为“跳动的震颤”的特征性震颤;这在休息时不存在,但可以通过扩展武器来激发。[8]
威尔森氏病也会影响认知。这有两个,而不是相互排斥的类别:额叶紊乱(可能表现为冲动性,判断力下降,滥交,冷漠和执行功能障碍,计划和决策不良)和皮质下痴呆(可能表现为思维迟钝,记忆丧失和执行功能障碍,没有失语症,失用症或失认症的迹象)。有人认为这些认知因素与疾病的精神病学表现有关并且密切相关。[7]
威尔森氏病导致的精神问题可能包括行为改变,抑郁,焦虑症和精神病。[5]精神症状通常与神经症状一起出现,并且很少单独表现出来。这些症状通常定义不明确,有时可归因于其他原因。因此,当仅存在精神症状时,很少诊断出威尔森氏病。[7]
其他器官系统
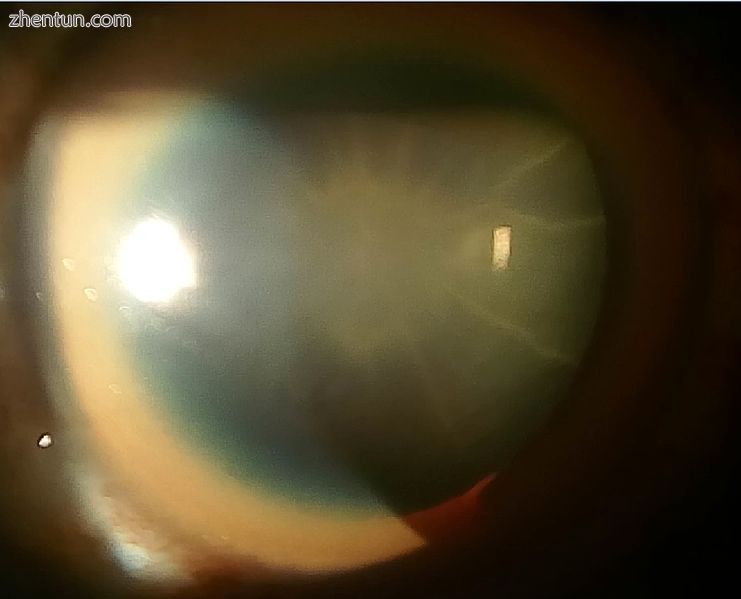
向日葵性白内障和40岁男性的厚KF环伴有Wilson病和失代偿性CLD
角膜的漫射照射
角膜后弹力膜上的铜配置
医疗条件与威尔森氏病中的铜积累有关:
眼睛:Kayser-Fleischer环(KF环),一种特征性的标志,可以直接或在裂隙灯检查时在眼角膜中可见,作为角膜周围环形铜的沉积物。它们归因于Descemet膜中的铜沉积。所有患有威尔逊病的人都不会发生这种情况。威尔森氏病也与前后晶状体囊的棕色或绿色色素沉着表现出的向日葵白内障有关[9]。两者都不会造成明显的视力损失。[5] KF环发生在大约66%的诊断病例​​中(更常见于有神经系统症状而不是肝脏问题的患者)。[6]
肾脏:肾小管酸中毒(2型),由近端小管处理的碳酸氢盐病症导致肾钙质沉着症(肾脏中的钙积累),骨骼减弱(由于钙和磷酸盐损失),偶尔氨基酸尿症(必需的损失)蛋白质合成所需的氨基酸)。[5]
心脏:心肌病(心肌无力)是威尔森氏病中罕见但公认的问题;它可能导致心力衰竭(由于泵功能下降引起的液体积聚)和心律失常(不规则和/或异常快速或缓慢心跳的发作)。[5]
激素:甲状旁腺功能减退症(导致低钙水平的甲状旁腺功能衰竭),不孕症和习惯性流产。[5]
遗传学
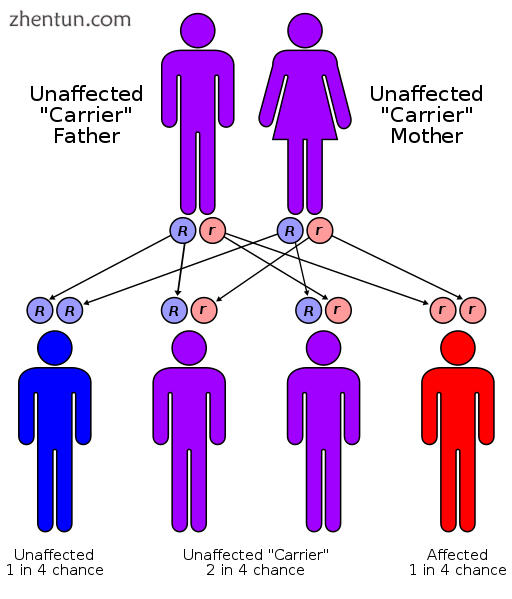
威尔森氏病具有常染色体隐性遗传模式。
主要文章:ATP7B
威尔森氏病基因(ATP7B)已被定位于13号染色体(13q14.3),主要在肝脏,肾脏和胎盘中表达。该基因编码P型(阳离子转运酶)ATP酶,将铜转运到胆汁中并将其掺入血浆铜蓝蛋白[5]。在90%的病例中可以检测到突变。大多数(60%)是ATP7B突变纯合子(两个异常拷贝),30%只有一个异常拷贝。百分之十没有可检测到的突变。[6]
尽管已经描述了300个ATP7B突变,但在大多数人群中,威尔森氏病的病例是由于该群体特有的少量突变。例如,在西方人群中,H1069Q突变(蛋白质中1069位谷氨酰胺取代组氨酸)存在于37-63%的病例中,而在中国,这种突变非常罕见,而R778L(精氨酸至亮氨酸,778) )经常被发现。一些研究表明,尽管H1069Q突变似乎可以预测晚期发病和主要是神经系统问题,但各种突变的相对影响相对知之甚少。[5] [10]
PRNP基因的正常变异可以通过延迟发病年龄和影响发展的症状类型来改变疾病的进程。该基因产生朊病毒蛋白,该蛋白在大脑和其他组织中具有活性,并且似乎也参与运输铜[11]。最初怀疑ApoE基因的作用但无法确认。[10]
该病症以常染色体隐性遗传模式遗传。为了继承它,个体的父母都必须携带受影响的基因。大多数人没有病史的家族史。[10]只有一个异常基因的人被称为携带者(杂合子),并且可能有轻微但医学上无关紧要的铜代谢异常。[12]
威尔森氏病是一组导致肝脏铜超负荷的遗传性疾病中最常见的疾病。所有这些都可以在年轻时引起肝硬化。该组的其他成员是印度儿童肝硬化(ICC),地方性蒂罗尔婴儿肝硬化和特发性铜中毒。这些与ATP7B突变无关:例如,ICC与KRT8和KRT18基因的突变有关。[10]
病理生理学
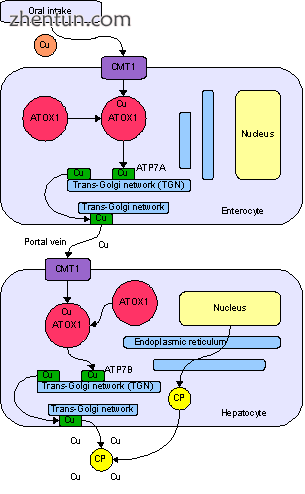
铜的正常吸收和分布。 Cu =铜,CP =铜蓝蛋白,绿色=携带铜的ATP7B。
人体需要铜来发挥许多功能,主要作为许多酶的辅助因子,如铜蓝蛋白,细胞色素c氧化酶,多巴胺β-羟化酶,超氧化物歧化酶和酪氨酸酶。[10]
铜通过消化道进入人体。小肠铜膜转运蛋白1(Ctr1; SLC31A1)细胞上的转运蛋白在细胞内携带铜,其中一些与金属硫蛋白结合,一部分由ATOX1携带到称为反式高尔基体网络的细胞器。在这里,为了响应铜浓度的增加,一种叫做ATP7A的酶将铜释放到门静脉到肝脏。肝细胞也携带CMT1蛋白,金属硫蛋白和ATOX1将其结合在细胞内,但这里是ATP7B,它将铜与铜蓝蛋白连接并将其释放到血液中,并通过将其分泌到胆汁中去除多余的铜。 ATP7B的两种功能在威尔森氏病中都受损。铜在肝组织中积聚;铜蓝蛋白仍然是分泌的,但是缺乏铜(称为apoceruloplasmin)并在血液中迅速降解[10]。
当肝脏中的铜量超过正常结合它的蛋白质时,它会通过称为芬顿化学的过程引起氧化损伤;这种损害最终导致慢性活动性肝炎,纤维化(结缔组织沉积)和肝硬化。肝脏还会将铜释放到不与血浆铜蓝蛋白结合的血液中。这种游离铜在整个身体中沉淀,特别是在肾脏,眼睛和大脑中。在大脑中,大多数铜沉积在基底神经节中,特别是在壳核和苍白球中(一起称为透镜状核);这些领域通常参与运动的协调,并在神经认知过程中发挥重要作用,如刺激和情绪调节的处理。通过Fenton化学对这些区域的损害产生了威尔森氏病中出现的神经精神症状。[10]
目前尚不清楚为什么威尔森氏病导致溶血,但各种证据表明高水平的游离(非铜蓝蛋白结合)铜对血红蛋白的氧化,红细胞中能量供应酶的抑制有直接影响。 ,或直接损害细胞膜。[13]
诊断
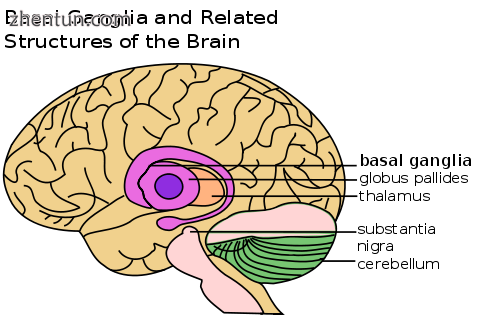
基底神经节的位置,受威尔森病影响的大脑部分
根据上述任何症状,或者当发现一名近亲患有Wilson病时,可能会怀疑威尔森氏病。大多数患者的肝功能检查略有异常,如天冬氨酸转氨酶升高,丙氨酸转氨酶和胆红素水平升高。如果肝脏损伤很严重,由于肝细胞不能产生这种蛋白质,白蛋白可能会减少;同样,凝血酶原时间(凝血试验)可能会延长,因为肝脏不能产生被称为凝血因子的蛋白质。[5] Wilson相关的急性肝功能衰竭患者的碱性磷酸酶水平相对较低[14]。如果有神经症状,通常会进行大脑的磁共振成像(MRI);这表明在T2环境中称为基底神经节的大脑部分的高信号。[12] MRI也可能表现出“大熊猫”面貌的特征。[15]
威尔逊病没有完全可靠的测试,但血液中铜蓝蛋白和铜的含量,以及24小时内尿液中排出的铜的量,一起被用来形成铜的含量。身体。金标准或最理想的测试是肝脏活组织检查。[5]
铜蓝蛋白
铜蓝蛋白
在80-95%的病例中,铜蓝蛋白的水平异常低(<0.2 g / L)。[5]然而,它可以在持续炎症的人中以正常水平存在,因为它是急性期蛋白质。 Menkes病和aceruloplasminemia也发现低铜蓝蛋白,这与威尔逊病有关,但比威尔逊病更罕见[5] [12]。
神经系统症状,Kayser-Fleischer环和低血浆铜蓝蛋白水平的组合被认为足以诊断威尔森氏病。然而,在许多情况下,还需要进一步的测试。[12]
血清和尿铜
血清铜含量低,这可能看似矛盾,因为威尔森氏病是一种铜过量的疾病。然而,95%的血浆铜由铜蓝蛋白携带,铜蓝蛋白通常在威尔森氏病中较低。威尔森氏病中尿铜升高,在无铜衬里的瓶子中收集24小时。高于100μg/ 24h(1.6μmol/ 24h)的水平证实了威尔逊病,并且高于40μg/ 24h(0.6μmol/ 24h)的水平是强烈指示性的。[5]高尿铜水平并非威尔森氏病独有;它们有时在自身免疫性肝炎和胆汁淤积中观察到(任何阻碍胆汁从肝脏流到小肠的疾病)。[12]
在儿童中,可以使用青霉胺试验。给予500mg口服剂量的青霉胺,并收集尿液24小时。如果它含有超过1600μg(25μmol),它是威尔森氏病的可靠指标。[需要澄清]该试验尚未在成人中得到验证。[12]
肝活检
一旦其他研究表明威尔逊氏病,理想的测试是通过肝脏活检取出少量肝组织。这在显微镜下评估脂肪变性和肝硬化的程度,并且铜的组织化学和定量用于测量铜积累的严重性。每克干肝组织中250μg铜的水平证实了威尔森氏病。偶尔会发现铜含量较低;在这种情况下,活检结果与所有其他测试的结合仍然可以导致Wilson的正式诊断。[5]
在该疾病的早期阶段,活组织检查通常显示脂肪变性(脂肪物质的沉积),细胞核中的糖原增加和坏死区域(细胞死亡)。在更晚期的疾病中,观察到的变化与自身免疫性肝炎中观察到的变化非常相似,例如炎性细胞浸润,零碎性坏死和纤维化(瘢痕组织)。在晚期疾病中,最后,肝硬化是主要发现。在急性肝衰竭中,通常在肝硬化改变的背景下,可见肝细胞变性和肝组织结构崩溃。检测铜的组织化学方法不一致且不可靠,单独服用被认为不足以确定诊断。[12]
基因检测
可以进行ATP7B基因的突变分析,以及与肝脏中铜积累相关的其他基因。一旦确认突变,就可以筛查家庭成员的疾病,作为临床遗传学家庭咨询的一部分。[5]与威尔森氏病相关的基因的区域分布非常重要,因为这可以帮助临床医生设计适当的筛查策略。由于WD基因的突变因群体而异,因此在美国或英国等国家进行的研究和基因检测可能会产生问题,因为它们往往有更多的混合种群。[16]
治疗
饮食
一般来说,建议避免食用低含铜食物,避免食用蘑菇,坚果,巧克力,干果,肝脏,芝麻籽和芝麻油以及贝类。[5]
药物治疗
威尔森氏病可以提供医疗服务。有些人会增加铜从体内的清除,而另一些则会阻止铜从饮食中吸收。
通常,青霉胺是第一种使用的治疗方法。这会结合铜(螯合)并导致尿液中铜的排泄。因此,可以监测尿液中铜的量以确保获得足够高的剂量。青霉胺并非没有问题:约20%经历青霉胺治疗的副作用或并发症,例如药物引起的狼疮(引起关节疼痛和皮疹)或肌无力(导致肌肉无力的神经病症)。在那些出现神经系统症状的人中,几乎有一半人的症状出现矛盾的恶化。虽然在Wilson的其他治疗中观察到这种现象,但通常将其作为停用青霉胺和开始二线治疗的指征。[5] [12]对青霉胺不耐受的那些可以改为在盐酸曲恩汀上开始,其也具有螯合特性。有人建议使用trientine作为一线治疗,但使用青霉胺的经验更为广泛。[12]在Wilson Therapeutics的临床研究中,在Wilson病中具有已知活性的另一种药物是四硫代钼酸盐。这被认为是实验性的[12],尽管一些研究已显示出有益效果。[5]
一旦所有结果恢复正常,可以使用锌(通常以醋酸锌处方称为Galzin的形式)代替螯合剂来维持体内稳定的铜水平。锌刺激金属硫蛋白,金属硫蛋白是肠道细胞中的一种蛋白质,可以结合铜并阻止它们被吸收并运输到肝脏。除非症状复发或尿液排泄增加,否则继续接受锌治疗。[12]
在极少数情况下,没有一种口服治疗有效,特别是在严重的神经系统疾病中,偶尔需要二巯基丙烯醇(英国抗Lewisite)。这种治疗每隔几周肌内注射(肌肉注射),并产生令人不快的副作用,如疼痛。[17]
无症状的人(例如,通过家庭筛查或仅因异常检查结果而诊断出的人)通常得到治疗,因为铜的积累可能在未来造成长期损害。目前尚不清楚这些人是否最好用青霉胺或醋酸锌治疗。[12]
物理和职业治疗
物理治疗和职业治疗对患有神经系统疾病的患者有益。铜螯合治疗可能需要长达六个月才能开始工作,这些疗法可以帮助治疗共济失调,肌张力障碍和震颤,并防止肌张力障碍导致挛缩的发展。[18]
移植
肝移植是威尔森氏病的有效治疗方法,但仅在特定情况下使用,因为该手术存在风险和并发症。它主要用于暴发性肝功能衰竭,对药物治疗无效或晚期慢性肝病患者。在严重的神经精神疾病中避免肝移植,其中的益处尚未得到证实。[5] [12]
预测
如果不及时治疗,威尔逊病往往会逐渐恶化并最终致命。通过早期发现和治疗,大多数受影响的人可以过上相对正常的生活。治疗前发生的肝脏和神经损伤可能会改善,但通常是永久性的。[需要引证]
历史
这种疾病的名字来自英国医生Samuel Alexander Kinnier Wilson(1878-1937),他是一位神经病学家,于1912年描述了这种病症,包括大脑和肝脏的病理变化。[19]威尔逊的工作早于德国神经学家卡尔·韦斯特法尔(Carl Westphal,1883年)的报道,并将其称为“假性硬化症”;由英国神经学家William Gowers(1888年);和AdolphStrümpell(1898年),他注意到肝硬化。[20] 1948年,神经病理学家John Nathaniel Cumings与肝脏和大脑中的铜积累联系起来。[21] 1967年注意到溶血的发生。[22]
Cumings和同时在美国工作的新西兰神经学家Derek Denny-Brown首次报道了1951年使用金属螯合剂英国抗Lewisite的有效治疗。[23] [24]这种治疗必须注射,但是神经病学领域的第一种治疗方法之一,这是一个经典的能够观察和诊断但很少提供治疗的领域。[20] [25]第一种有效的口服螯合剂青霉胺于1956年由英国神经病学家John Walshe发现[26]。 1982年,Walshe还引入了trientine,[27]并且是第一个开发用于临床的四硫代钼酸盐。[28]醋酸锌治疗最初在荷兰出现,医生Schouwink和Hoogenraad分别在1961年和1970年代使用它,但后来由密歇根大学的Brewer及其同事进一步开发。[17] [29]
几个研究小组在20世纪80年代和90年代阐明了威尔森氏病的遗传基础和与ATP7B突变的联系。[30] [31]
其他动物
遗传性铜积累已在Bedlington Terriers [32]中描述,其中它通常仅影响肝脏。这是由于COMMD1(或MURR1)基因的突变。[33]尽管有这些发现,但在具有非威尔逊铜积累状态(如印度儿童肝硬化)的人类中,未能检测到COMMD1突变,以解释其遗传起源[34]。
另见
Copper in health
Menkes syndrome
参考
"Wilson Disease". NIDDK. July 2014. Archived from the original on 2016-10-04. Retrieved 2016-11-06.
Lynn, D. Joanne; Newton, Herbert B.; Rae-Grant, Alexander (2004). The 5-minute Neurology Consult. Lippincott Williams & Wilkins. p. 442. ISBN 9780683307238. Archived from the original on 2016-11-07.
Sahani, Dushyant V.; Samir, Anthony E. (2016). Abdominal Imaging: Expert Radiology Series (2 ed.). Elsevier Health Sciences. p. 400. ISBN 9780323431613. Archived from the original on 2016-11-07.
"Whonamedit - dictionary of medical eponyms". www.whonamedit.com. Archived from the original on 2016-11-07. Retrieved 2016-11-06.
Ala A, Walker AP, Ashkan K, Dooley JS, Schilsky ML (2007). "Wilson's disease". Lancet. 369 (9559): 397–408. doi:10.1016/S0140-6736(07)60196-2. PMID 17276780.
Merle U, Schaefer M, Ferenci P, Stremmel W (2007). "Clinical presentation, diagnosis and long‐term outcome of Wilson's disease: a cohort study". Gut. 56 (1): 115–20. doi:10.1136/gut.2005.087262. PMC 1856673. PMID 16709660. Archived from the original on 2008-05-04.
Lorincz MT (2010). "Neurologic Wilson's disease". Annals of the New York Academy of Sciences. 1184: 173–87. doi:10.1111/j.1749-6632.2009.05109.x. PMID 20146697.
Pagonabarraga, J; Goetz, C (2012). Biller, J, ed. Practical Neurology (4th ed.). Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins Heath. p. 282. ISBN 978-1451142631.
Yanoff, Myron; Jay S. Duker (2008). Ophthalmology (3rd ed.). Edinburgh: Mosby. p. 411. ISBN 978-0323057516.
de Bie P, Muller P, Wijmenga C, Klomp LW (November 2007). "Molecular pathogenesis of Wilson and Menkes disease: correlation of mutations with molecular defects and disease phenotypes". J. Med. Genet. 44 (11): 673–88. doi:10.1136/jmg.2007.052746. PMC 2752173. PMID 17717039. Archived from the original on 2008-01-30.
Grubenbecher S, Stüve O, Hefter H, Korth C (2006). "Prion protein gene codon 129 modulates clinical course of neurological Wilson disease". NeuroReport. 17 (5): 549–52. doi:10.1097/01.wnr.0000209006.48105.90. PMID 16543824.
Roberts, Eve A.; Schilsky, Michael L. (2003). "A practice guideline on Wilson disease" (PDF). Hepatology. 37 (6): 1475–92. doi:10.1053/jhep.2003.50252. PMID 12774027.
Lee GR (1999). "Chapter 48: acquired hemolytic anaemias resulting from direct effects of infectious, chemical or physical agents". In Lee GR, Foerster J, Lukens J, et al. Wintrobe's clinical hematology. vol 1 (10th ed.). Williams & Wilkins. p. 1298. ISBN 978-0-683-18242-2.
Shaver WA, Bhatt H, Combes B (1986). "Low serum alkaline phosphatase activity in Wilson's disease". Hepatology. 6 (5): 859–63. doi:10.1002/hep.1840060509. PMID 3758940.
Das SK, Ray K (September 2006). "Wilson's disease: an update". Nat Clin Pract Neurol. 2 (9): 482–93. doi:10.1038/ncpneuro0291. PMID 16932613. Archived from the original on 2010-01-11.
Ferenci, Peter (2006-06-22). "Regional distribution of mutations of the ATP7B gene in patients with Wilson disease: impact on genetic testing". Human Genetics. 120 (2): 151–159. doi:10.1007/s00439-006-0202-5. ISSN 0340-6717. PMID 16791614.
Walshe JM (July 1996). "Treatment of Wilson's disease: the historical background". QJM. 89 (7): 553–5. doi:10.1093/qjmed/89.7.553. PMID 8759497.
Brewer GJ, Askari FK (2005). "Wilson's disease: clinical management and therapy". Journal of Hepatology. 42 (Suppl 1): 13–21. doi:10.1016/j.jhep.2004.11.013. PMID 15777568.
Kinnier Wilson SA (1912). "Progressive lenticular degeneration: a familial nervous disease associated with cirrhosis of the liver" (PDF). Brain. 34 (1): 295–507. doi:10.1093/brain/34.4.295. Archived from the original on 2009-09-03.
Robertson WM (February 2000). "Wilson's disease". Arch. Neurol. 57 (2): 276–7. doi:10.1001/archneur.57.2.276. PMID 10681092. Archived from the original on 2008-05-10.
Cumings JN (1948). "The copper and iron content of brain and liver in the normal and in hepato-lenticular degeneration" (PDF). Brain. 71 (Dec): 410–5. doi:10.1093/brain/71.4.410. PMID 18124738. Archived from the original on 2009-09-03.
McIntyre N, Clink HM, Levi AJ, Cumings JN, Sherlock S (February 1967). "Hemolytic anemia in Wilson's disease". N. Engl. J. Med. 276 (8): 439–44. doi:10.1056/NEJM196702232760804. PMID 6018274.
Cumings JN (March 1951). "The effects of B.A.L. in hepatolenticular degeneration". Brain. 74 (1): 10–22. doi:10.1093/brain/74.1.10. PMID 14830662.
Denny-Brown D, Porter H (December 1951). "The effect of BAL (2,3-dimercaptopropanol) on hepatolenticular degeneration (Wilson's disease)". N. Engl. J. Med. 245 (24): 917–25. doi:10.1056/NEJM195112132452401. PMID 14882450.
Vilensky JA, Robertson WM, Gilman S (September 2002). "Denny-Brown, Wilson's disease, and BAL (British antilewisite [2,3-dimercaptopropanol])". Neurology. 59 (6): 914–6. doi:10.1212/wnl.59.6.914. PMID 12297577.
Walshe JM (January 1956). "Wilson's disease; new oral therapy". Lancet. 270 (6906): 25–6. doi:10.1016/S0140-6736(56)91859-1. PMID 13279157.
Walshe JM (March 1982). "Treatment of Wilson's disease with trientine (triethylene tetramine) dihydrochloride". Lancet. 1 (8273): 643–7. doi:10.1016/S0140-6736(82)92201-2. PMID 6121964.
Harper PL, Walshe JM (December 1986). "Reversible pancytopenia secondary to treatment with tetrathiomolybdate". Br. J. Haematol. 64 (4): 851–3. doi:10.1111/j.1365-2141.1986.tb02250.x. PMID 3801328.
Brewer GJ (January 2000). "Recognition, diagnosis, and management of Wilson's disease". Proc. Soc. Exp. Biol. Med. 223 (1): 39–46. doi:10.1046/j.1525-1373.2000.22305.x. PMID 10632959. Archived from the original on 2008-04-09.
Bull PC, Thomas GR, Rommens JM, Forbes JR, Cox DW (1993). "The Wilson disease gene is a putative copper transporting P-type ATPase similar to the Menkes gene". Nat. Genet. 5 (4): 327–37. doi:10.1038/ng1293-327. PMID 8298639.
Tanzi RE, Petrukhin K, Chernov I, et al. (1993). "The Wilson disease gene is a copper transporting ATPase with homology to the Menkes disease gene". Nat. Genet. 5 (4): 344–50. doi:10.1038/ng1293-344. PMID 8298641.
Sternlieb I, Twedt DC, Johnson GF, et al. (1977). "Inherited copper toxicity of the liver in Bedlington terriers". Proc. R. Soc. Med. 70 Suppl 3 (Suppl 3): 8–9. PMC 1543595. PMID 122681.
van De Sluis B, Rothuizen J, Pearson PL, van Oost BA, Wijmenga C (2002). "Identification of a new copper metabolism gene by positional cloning in a purebred dog population". Hum. Mol. Genet. 11 (2): 165–73. doi:10.1093/hmg/11.2.165. PMID 11809725. Archived from the original on 2008-08-30.
Müller T, van de Sluis B, Zhernakova A, et al. (2003). "The canine copper toxicosis gene MURR1 does not cause non-Wilsonian hepatic copper toxicosis". J. Hepatol. 38 (2): 164–8. doi:10.1016/S0168-8278(02)00356-2. PMID 12547404. |