概要
X连锁先天性肾上腺发育不全(AHC)是人肾上腺皮质的罕见发育障碍,是由DAX-1基因的缺失或突变引起的,DAX-1基因是最近发现的核激素受体超家族成员。低促性腺功能减退症通常与AHC相关。 AHC作为连续基因综合征的一部分与甘油激酶缺乏症(GKD)和杜兴氏肌营养不良症一起发生。过去20年收集的本系列包括来自16个家庭的18名AHC男孩:4名患有AHC,GKD和Duchenne的肌营养不良症; 2与AHC和GKD; 12例患有AHC(5名患有促性腺激素性性腺功能减退症的年轻人)。大多数男孩在新生儿期间出现盐萎缩和色素沉着过度。在生命的最初几周进行的血浆类固醇测定通常显示出令人困惑的结果,可能是由新生儿持续存在的胎儿皮质中产生的类固醇引起的。醛固酮缺乏通常在皮质醇缺乏之前,这解释了为什么患者更常出现盐萎缩而不是低血糖症状。通常需要ACTH测试来检测非常小的婴儿中的皮质醇缺乏。在一些患者中,必须进行连续测试以确定正确的诊断。在出生后的前3个月内研究的4名男孩中,我们发现青春期LH,FSH和睾酮血浆水平表明出生后短暂激活下丘脑 - 垂体 - 性腺轴与正常男孩一样。以前的研究表明DAX-1基因在具有连续基因综合征的AHC患者中被删除,并且在非缺失患者中发生突变。在AHC患者中鉴定的大多数点突变是移码突变和停止突变。在可用于DAX-1基因分子分析的15名患者中,6名患者有大量缺失,另外7名患者有点突变。在本研究中鉴定的所有点突变导致非功能性截短的DAX-1蛋白。两个兄弟患有原发性肾上腺皮质功能不全和病史,强烈建议AHC在DAX-1基因中没有突变。因此,另外的,尚未知的基因必须在正常的肾上腺皮质发育中起作用。
问题部分:文章
先天性肾上腺发育不全(AHC)是先天性肾上腺皮质功能不全的罕见原因,最早由Sikl(1)描述。大多数受影响的儿童在出生后的头几个月都没有茁壮成长,盐萎缩,低血糖抽搐和色素沉着过度。盐皮质激素和糖皮质激素的血浆浓度降低,并且对ACTH刺激没有反应。 AHC的主要形式表现为X连锁和常染色体隐性遗传疾病,具有不同的肾上腺形态(2-4)。 X连锁形式的肾上腺缺乏肾上腺皮质的确定区,其特征是大的空泡化细胞类似于胎儿肾上腺皮质细胞(5,6)。除肾上腺功能不全外,低促性腺激素性性腺功能减退症是X连锁AHC的常见特征,检测为青春期延迟并用睾酮替代治疗(7)。垂体激素的缺乏对促性腺激素(LH和FSH)具有选择性,因为其他垂体激素(ACTH,GH,TSH和PRL)的产生是正常的。低促性腺激素性性腺功能减退症是否是下丘脑或垂体功能障碍的结果,或两者兼而有之,尚不清楚(8)。对受影响儿童进行认真的临床管理非常重要,因为肾上腺功能的快速和危及生命的恶化常常发生在婴儿期的无症状期(8)。因此,早期诊断确保盐皮质激素和糖皮质激素治疗的早期开始并防止猝死。
通过对具有连续基因综合征的男性患者(包括AHC,甘油激酶缺乏症(GKD)和Duchenne肌营养不良症(DMD))的缺失研究,将X-连锁的AHC的基因座定位到Xp21.3-21.2(9)。基因顺序Xpter-AHC-GKD-DMD-cen是根据缺失研究建立的(10)。常染色体隐性遗传性AHC的基因座尚不清楚。最近,克隆了负责X连锁AHC的基因。该基因被称为DAX-1(用于剂量敏感性性逆转,X染色体上的肾上腺发育不良先天性关键区域,基因1),编码核激素受体家族的新成员(11)。在X连锁AHC患者中发现了DAX-1基因的缺失和编码区的不同点突变;大多数是移码突变和停止突变,可能会导致无功能的截短蛋白(11-20)。 DAX-1基因的突变似乎足以解释AHC和低促性腺激素性性腺功能减退症。
我们在这里报告我们目前的18名男性AHC患者系列,通过我们的小血浆样本中的多类分析方法诊断出来(21)。我们描述了激素研究,特别关注新生儿期间的类固醇测定。此外,我们在DAX-1基因的两个外显子中描述了五个先前未报道的点突变。
主题和方法
耐心
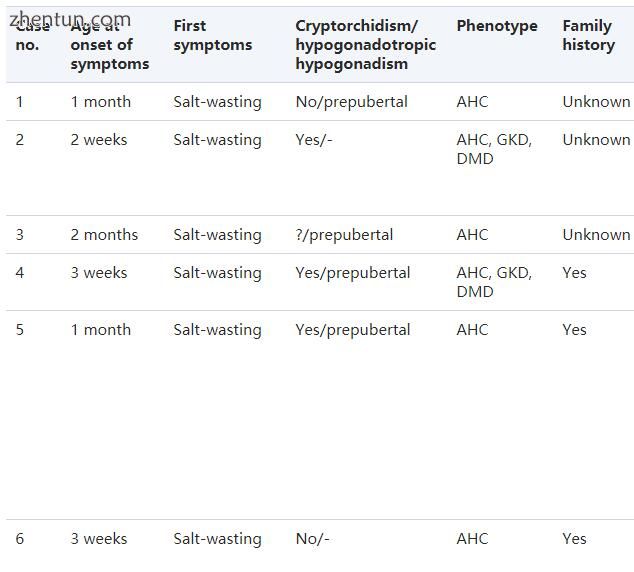
在过去的20年中,我们的实验室共诊断出来自16个家庭的18名男孩患有由先天性肾上腺皮质发育不全引起的先天性肾上腺皮质功能不全。所有患者均为高加索人。所有患者的临床数据总结在表1中。15名男孩在出生后的第一周(范围,1周至2个月)出现盐萎缩和茁壮成长。一名男孩(病例15)在5个月时出现低血糖惊厥,同时显示出盐消耗的实验室和临床症状。他的弟弟(病例16)在产前被诊断出来,并且在生命第3天进行诊断性ACTH测试后立即开始治疗(22)。一名男孩(病例8)在3岁时表达肾上腺功能不全的迹象或症状,当时他的弟弟(病例9)被诊断为患有AHC。出现盐萎缩的患者表现出典型的实验室体征,如低钠血症,高钾血症,代谢性酸中毒和PRA升高。在这些男孩中,血糖水平在呈现时是正常的。七名男孩患有单侧或双侧隐睾症。那些已经达到青春期后年龄的患者因性腺功能减退性性腺机能减退而导致青春期延迟。具有连续基因综合征的患者还具有假性高甘油三酯血症,血液甘油浓度升高和/或血清肌酸酐激酶水平升高。从总共18名男孩中,12名完全患有肾上腺皮质功能不全,6名患有连续的基因综合征(2名患有AHC和GKD,4名患有AHC,GKD和DMD)。在8个家庭中,我们发现了男性婴儿出生后头几个月无法解释的死亡病史或原发性肾上腺皮质功能不全的典型体征或症状,如色素沉着过度。在4名男孩中,假设由21-羟化酶或11β-羟化酶缺乏引起的先天性肾上腺增生的初步诊断。其中两个患有连续基因综合征的男孩,包括AHC,GKD和DMD,在出生后头几个月死亡。然而,患有孤立性AHC的男孩也预后不良,因为在这一系列患者中,我们观察到在艾迪生危机中1例死亡和1例长期惊厥后严重脑损伤。
表格1。
18例AHC男孩的临床特征
对分别在4个月(病例7),1岁(病例2)和6岁(病例6)死亡的三个男孩进行死后检查。病例7中的发现证实了肾上腺发育不全的巨细胞瘤形式的诊断,已经发表(23)。在死后检查期间,病例2和6证实缺乏肾上腺皮质的确定区。在这两种情况下,不能看到类似于胎儿肾上腺皮质细胞的特征性大空泡细胞。然而,这并不奇怪,因为两名患者都在胎儿皮质内陷完成的年龄死亡。
材料和方法
类固醇测定
为了诊断目的,在所有患者中进行激素测定。通过在短期ACTH刺激之前和之后测量肾上腺血浆类固醇来确认肾上腺皮质功能不全的诊断。进行ACTH刺激试验以确认皮质醇缺乏并排除肾上腺类固醇生物合成的酶缺陷。 ACTH测试在未治疗的患者中或在短暂停止治疗后进行,在0800-1000h之间静脉推注125μgACTH-(1-24)(Synacthen,Ciba-Geigy,Wehr,Germany)。在ACTH注射之前和之后60分钟采集血液样品,收集在预冷的肝素化管中,并立即在4℃下离心。将血浆在-20℃冷冻保存直至测定。使用先前描述的方法测量血浆类固醇,用于在我们的实验室中开发的1-2mL的小血浆体积中同时测定多种肾上腺类固醇(21)。对于血浆类固醇,内部和实验间变异系数分别为6.9-14.5%和11.9-16.3%。结果以纳摩尔/ L表示;转换为毫升每毫升,除以以下因素:醛固酮,2.774;皮质酮,2.886; 11-脱氧皮质酮,3.026;黄体酮,3.18; 17-羟孕酮,3.026; 11-脱氧皮质醇,2.887;皮质醇,2.759;和可的松,2.774。先前已经报道了使用我们的多类分析方法(21)的不同儿科年龄组的正常范围(24)。
使用提取,色谱和RIA的类似方法用于血浆睾酮和雄烯二酮测量(25)。使用商业RIA(Sorin Biomedica,Milan,Italy)测量脱氢表雄酮硫酸盐。使用免疫放射测定法(Maia Clone,Serono Diagnostics,Freiburg,Germany)或酶免疫测定法(EIA)(Serozyme,Serono Diagnostics)测量LH和FSH。
分子遗传学研究
在从患者及其父母获得知情同意后,进行用于分子遗传学研究的血液样品。这些家庭被告知分子遗传测试具有研究性质,临床决策和遗传咨询不应仅仅基于这些信息。
外显子和外显子/内含子边界的核苷酸序列
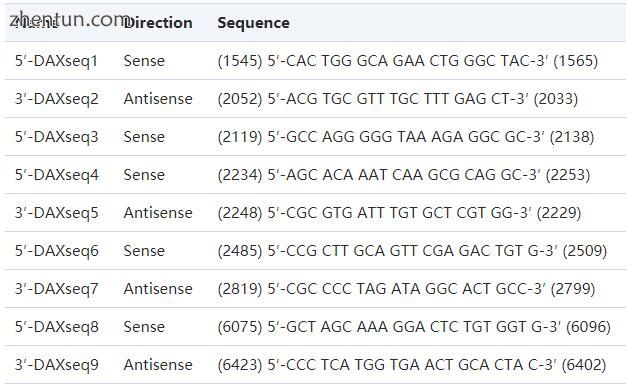
从外周血白细胞中提取基因组DNA,并通过PCR在含有两个外显子的三个片段中扩增DAX-1基因。以下引物用于扩增DAX-1基因:DAX1s,5'-CAC TGG GCA GAA CTG GGC TAC-3'; DAX1as,5'-CTG C​​AG CAT GCT GGG CTC CG-3'; DAX2s,5'-CCG CTT GCA GTT CGA GAC TGT G-3'; DAX2as,5'-CGC CCC TAG ATA GGC ACT GCC-3'; DAX3s,5'-GCT AGC AAA GGA CTC TGT GGT G-3';和DAX3as,5'-CCC TCA TGG TGA ACT GCA CTA C-3'。在94℃初始变性3分钟(94℃变性1分钟,68℃退火(引物DAX1s和DAX1as))或65℃(引物DAX2s和DAX2as,引物DAX3s和DAX3as)后进行PCR扩增循环35个循环。使用DNA聚合酶(XL PCR Kit,Perkin-Elmer,Foster City,CA)在72℃延伸。最终延伸在72℃下进行5分钟.PCR产物在1-2%琼脂糖凝胶上进行。使用外切核酸酶I和虾碱性磷酸酶预处理PCR产物。使用Thermo Sequenase放射性标记的终止子循环测序试剂盒,按照制造商的说明(Amersham Life Science, Cleveland,OH)。用于测序反应的引物列于表2中。
表2。
用于DAX-1基因循环测序的寡核苷酸(根据GenBank登录号U31929中公布的序列在括号中的数字)
删除DAX-1基因和相邻基因
当使用DAX-1引物(DAX1s和DAX1s,DAX2s和DAX2as,DAX3s和DAX3as)扩增患者的DNA不成功时,假定缺失DAX-1基因。另外的标记物用于鉴定端粒和着丝粒断裂点(10,12,13)。根据公布的GenBank序列数据设计了用于PCR扩增GKD基因和DMD基因的部分外显子的引物(26,27)。
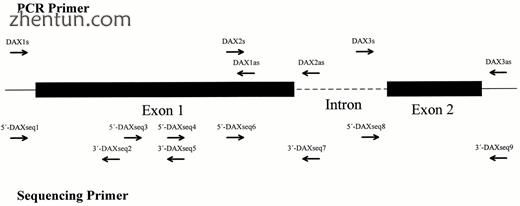
图1中显示了DAX-1基因的基因组组织的示意图和用于扩增外显子和外显子 - 内含子边界以及测序PCR产物的引物的定位。
图1。
DAX-1基因的基因组组织的示意图。用于扩增外显子和外显子 - 内含子边界的三对引物的定位在图的上部表示。用于测序PCR产物的引物的定位显示在图的下部。
结果
类固醇测定
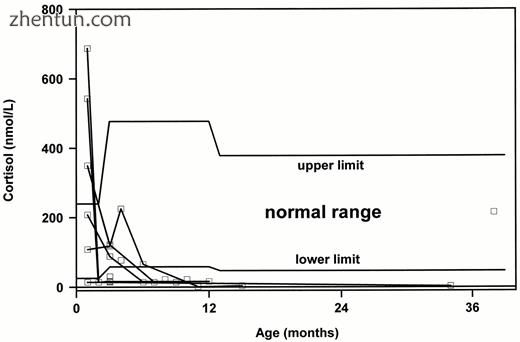
8种确定的盐皮质激素和糖皮质激素的血浆类固醇水平在所有18名患者中表现出完全的肾上腺皮质功能不全。在一些患者中进行了重复的多细胞分析(表3)。在不同年龄重复测量的基础醛固酮和皮质醇血浆水平显示在图3和4中。分别为2和3。所有患者首次出现时,醛固酮均低于或低于检测检测下限(0.055 nmol / L),而我们高度特异性方法测定的血浆皮质醇在首次出现时高于某些患者的正常上限。在6个月时,除一名患者外,血浆皮质醇低于正常值(病例9)。我们测量了几种硫酸脱氢表雄酮血浆水平;然而,除了病例8(105 nmol / L)外,它们均低于RIA检测下限(<25 nmol / L)。这个特殊的男孩在3岁时皮质醇血浆水平正常。
表3。
在1至15个月大的同一AHC患者(病例6)中连续测定血浆类固醇
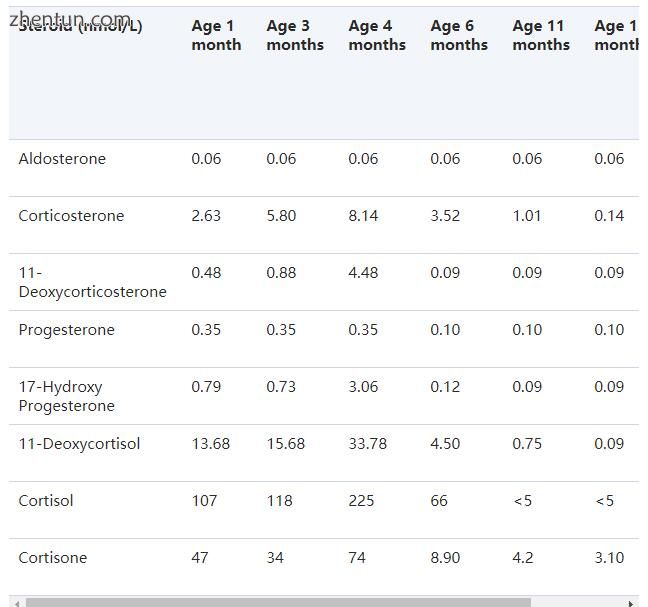
图2。
通过多类分析确定AHC男孩的基础醛固酮血浆水平。 在首次出现时,所有患者的血浆醛固酮(空心方块)均等于或低于检测检测下限(0.055nmol / L)。
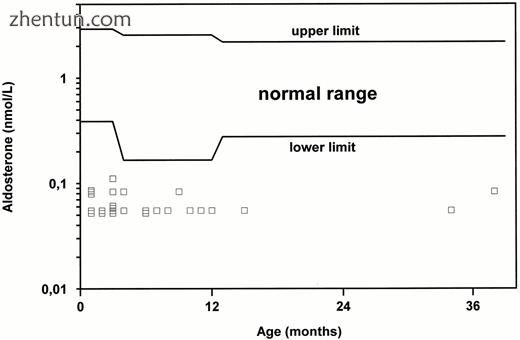
图3。
通过多类分析确定AHC男孩的基础皮质醇血浆水平。 通过我们的高度特异性方法确定的血浆皮质醇(空心方块)在首次呈现时在一些患者中高于正常上限。 在6个月时,血浆皮质醇低于正常值,一名患者除外(病例8)。
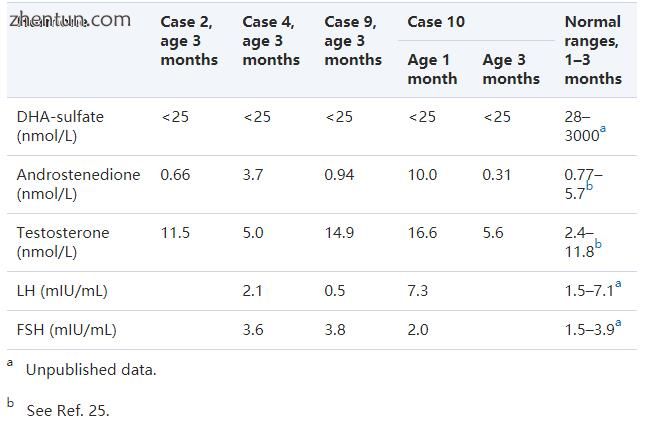
在生命的前3个月内,在四个AHC男孩中测定一次或两次血浆睾酮和雄烯二酮水平。 所有男孩均在正常青春期前的范围内显示血浆睾酮和雄烯二酮水平(表4)。 我们没有纵向数据。 还测量了三名男孩的基础血浆LH和FSH水平,表明当时活跃的下丘脑 - 垂体 - 性腺轴(表4)。
表4。
四名AHC男孩的激素数据显示出生命最初几个月内活跃的下丘脑 - 垂体 - 性腺轴
DAX-1-GKD-DMD基因座的突变分析
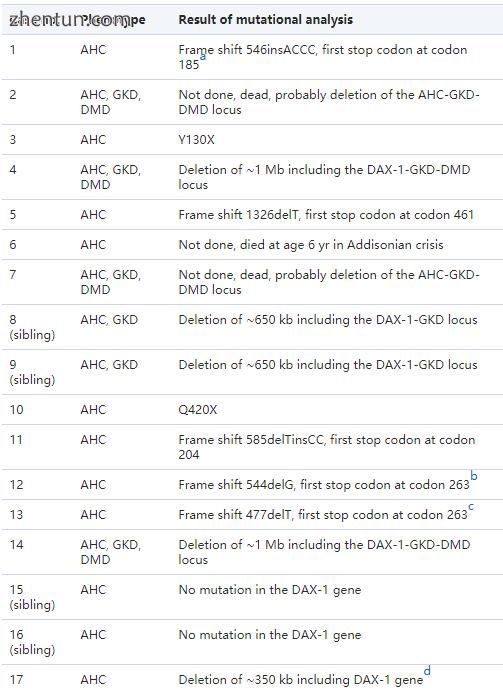
由于这三名患者先前已经死亡,因此我们没有针对病例2,6和7进行DNA研究的材料。病例1中发现的点突变已经被报道过(11)。在5名患者中发现了5个新的点突变。病例3具有无义突变(核苷酸390处的C至A),其导致位置130处的终止密码子(Y130X;图4)。病例5在核苷酸1326处具有单碱基缺失(T)(图5)。该突变导致在位置461处的移码和过早终止密码子。病例10具有无义突变(核苷酸1258处的C至T),其导致420位(Q420X)的终止密码子。病例11具有单碱基缺失(T)和在核苷酸585处插入两个核苷酸(CC)。该突变导致移位和位置204处的过早终止密码子(图6)。病例12在核苷酸544处具有单碱基缺失(G)。该突变导致263位的移码和过早终止密码子。在案例4中用DAX-1基因的三个引物对扩增基因组DNA, 8,9,14,17和18未能产生PCR产物。删除这些标记证实所有受AHC影响。另外的标志物表明两名患者具有整个DAX-1基因的缺失:病例17(~350kb;图7)和18(~60kb)。病例4和14具有约1Mb的缺失,包括整个AHC-GKD-DMD基因座,而两个同胞(病例8和9)具有约650kb的缺失,包括AHC-GKD基因座(表5)。两个兄弟(病例15和16)患有原发性肾上腺皮质功能不全和病史,强烈建议AHC在DAX-1基因中没有突变。
图4。
患者3和家庭成员DAX 1基因的序列分析。患者具有无义突变(核苷酸390处的C至A),导致过早终止密码子(Y130X)。母亲和姐妹(左边的前两个序列)是突变的杂合子携带者。父亲和兄弟(右边的最后两个序列)只有野生型。
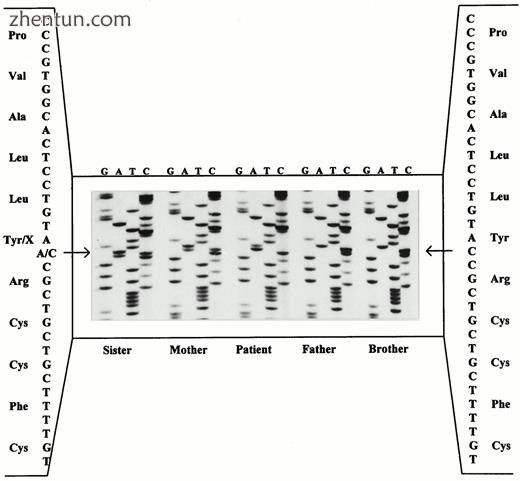
图5。
患者5中DAX1基因的序列分析。该患者(左)在核苷酸1326处具有单碱基缺失(T),导致移位和位置461处的过早终止密码子。
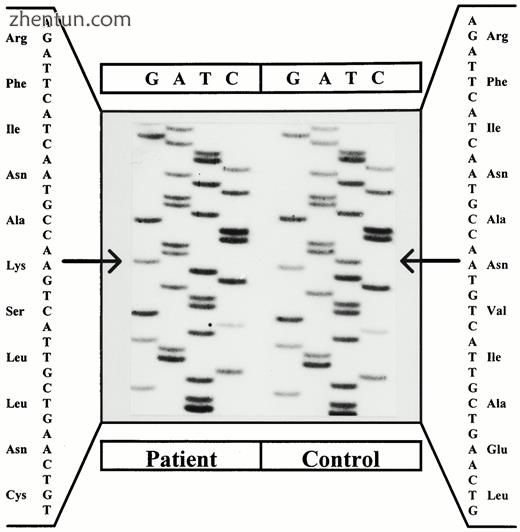
图6。
患者11中DAX1基因的序列分析。该患者(右)具有单碱基缺失(T)和在核苷酸585处插入两个核苷酸(CC)。该突变导致移位和过早的终止密码子位置204。
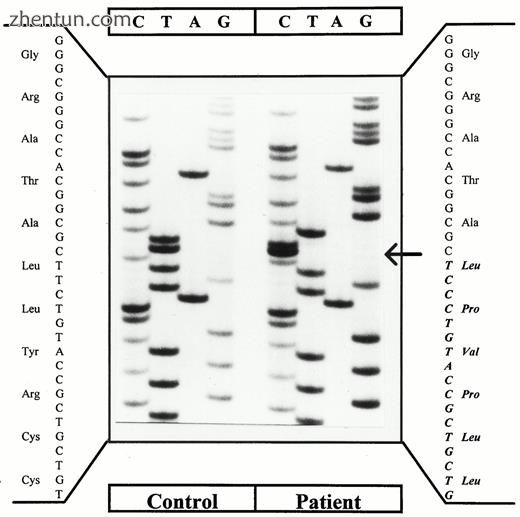
图7。
在患有AHC的患者中删除DAX-1基因座(情况17)。 溴化乙锭染色的凝胶显示PCR标记,其从端粒(右)到着丝粒(左)排序。 患者(左)具有DAX-1,K23-b2和JK2标记的缺失; 正常控制显示在右侧。
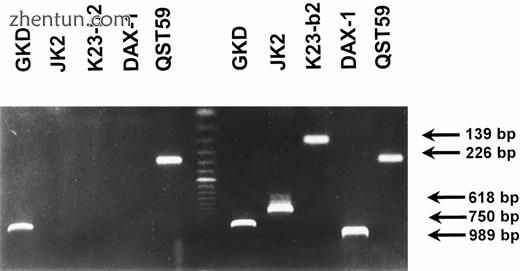
表5。
在18名AHC患者中检测到AHC-GKD-DMD基因座的缺失和突变
讨论
在Sikl(1)首次描述AHC后50年,这种罕见的X连锁遗传性疾病的临床特征,激素发现和诊断标准以及病因和发病机理看起来更为精确。我们在这里报告了最大的AHC男孩系列之一,包括临床,激素和分子数据。
临床表现
AHC婴儿的临床症状和体征包括喂养不良,茁壮成长,频繁呕吐,脱水和色素沉着过度。低钠血症,高钾血症,代谢性酸中毒和低血糖是糖皮质激素和盐皮质激素联合缺乏的常见生化特征(2,3,5,8)。在我们目前的一系列患者中,16名患者在出生后的头几周内出现了失盐危机;只有1名男孩(病例15)出现低血糖惊厥作为肾上腺皮质功能不全的首发症状,尽管这名男孩患有盐皮质激素缺乏症的生化症状。他首先提出了肾上腺功能不全的体征和症状,这是我们系列中最古老的一种。他的弟弟在产前被诊断出来(22),并且在肾上腺功能不全的任何体征或症状出现之前就已开始治疗。一名男孩在3岁之前没有表现出任何糖皮质激素或盐皮质激素缺乏的迹象,当时他的弟弟在新生儿期被诊断为患有AHC。其他人也报道了AHC症状的这种延迟发作(8,14,28-31)。一些研究人员也描述了家族内变异性(8,12,14,16,28-30)。肾上腺发育的异常似乎是可变的,并且这种疾病的不太严重的形式可能导致亚临床肾上腺功能不全。
由于21-羟化酶缺乏,上述症状和体征与先天性肾上腺增生的失盐形式中观察到的症状和症状难以区分。在我们在7名患者中观察到的患有AHC的男孩中发生的相对常见的症状是单侧或双侧隐睾症(5)。通常,在低促性腺激素性性腺机能减退的患者中观察到高比率的未降低的睾丸,这是AHC患者的共同特征(7,28,29,32)。现在相信所有患有AHC的男孩都会进入青春期后的年龄,这会导致由促性腺激素性性腺机能减退引起的青春期延迟。在文献中报道的关于下丘脑或垂体中缺陷的定位的AHC患者中存在明显的促性腺激素性性腺机能减退的表型异质性。一些研究(8,33-35)提出了原发性垂体缺陷,其中患者对脉冲GnRH的长期治疗几乎没有或没有反应。然而,对脉冲GnRH有反应的两位患者(病例12和17)的研究表明下丘脑有一个主要缺陷(36,37)。来自文献的更新数据表明,DAX-1突变通过作用于下丘脑和垂体水平而损害促性腺激素的产生(16,38)。
Takahashi及其同事(19)已经在生命的前4个月内对AHC婴儿中活跃的下丘脑 - 垂体 - 性腺轴进行了有趣的观察。我们来自四名受影响男孩的数据支持这一观察所有四个男孩的睾丸激素血浆水平都在青春期中期。我们没有对这些男孩进行GnRH测试;然而,对于3个月以下的男孩,基础LH和FSH处于正常范围,表明在这个年龄段有活跃的下丘脑 - 垂体 - 性腺轴。我们提出这样的假设,即婴儿男孩和青春期男孩的下丘脑 - 垂体 - 性腺活动的中心调节可能存在差异。
在我们的系列中报道的三分之一的AHC患者具有连续的基因综合征。包括AHC,GKD和DMD在内的表型相对频繁,这些男孩的预后较差。通过测量甘油三酯,甘油和肌酸激酶的血浆浓度,应该在每个AHC男孩中排除GKD和DMD。
X连锁AHC的频率
我们的数据没有表明德国人群中AHC的频率。特发性肾上腺发育不全的总发病率估计为12,500例中的1例,或在大量连续围产期尸检中约为0.2-0.26%(5,39)。根据我们实验室在过去十年中进行的类固醇分析的数量,比较由于21-羟化酶缺乏导致的先天性肾上腺增生的频率与AHC的频率,可以说AHC的诊断更为罕见。德国人群中由于21-羟化酶缺乏导致的先天性肾上腺增生的频率在13,000名新生儿中约为1(40)。因此,在12,500名新生儿中,AHC的频率必须显著低于1。
生化结果和诊断建议
我们在这里描述的18名患者中进行了一项或多项血浆多类固醇分析(21)。我们使用一种高度特异性的类固醇测定方法,在RIA之前使用提取和自动化高效液相色谱法,以避免与其他丰富的皮质类固醇的交叉反应。除了一个男孩,所有肾上腺类固醇的血浆水平都很低或不可察觉。在新生儿中,醛固酮缺乏在所有病例中都在皮质醇缺乏之前。当我们在生命的第一周和2个月之间确定盐萎缩婴儿中的血浆醛固酮时,血浆醛固酮水平非常低,ACTH刺激后很少或没有增加。同时,大多数患者的血浆皮质醇水平升高或处于正常范围,反映了胎儿皮质中仍有活性的类固醇产生。然而,肾上腺功能随后下降,并且在6个月时,所有作为新生儿出现盐萎缩的婴儿也是皮质醇缺乏的。然而,一些儿童(如我们系列中的病例8)显示出糖皮质激素充足的延长期(31)。因此,在生命的最初几周,通常需要ACTH测试来证明皮质醇缺乏。肾上腺功能不全的诊断也可以用24小时尿液样本进行,但是在这个非常年轻的年龄组中难以收集。
由于21-羟化酶缺乏,一些患者被误诊为先天性肾上腺增生。正确的诊断取决于确定类固醇的具体方法。我们没有观察到任何患者的17-羟孕酮血浆水平升高。然而,我们在生命的最初几周检测到11-脱氧皮质醇和11-脱氧皮质酮的血浆水平升高,表明11β-羟化酶缺乏。在我们的18名患者中的7名(病例2,4,5,6,8,10和14)中观察到这种现象,并且在1名患者(病例6)中它甚至在6个月后消失。我们假设这可能是由持续存在的胎儿皮质中的类固醇产生干扰引起的。
我们建议对AHC提出以下诊断建议。应在ACTH刺激之前和之后进行血浆皮质醇和醛固酮(和前体类固醇)的特异性测量。未经事先纯化的直接RIA程序通常会对年幼婴儿的醛固酮,皮质醇及其前体产生错误的升高结果。在婴儿期,在ACTH给药之前和之后对血浆类固醇的连续测量也可能是正确诊断所必需的。尿液类固醇分泌模式(气相色谱法)也是确定肾上腺皮质功能不全的重要工具。此外,应确定血浆ACTH和PRA。在青春期正常发作时,应检查促性腺激素和性类固醇的分泌(例如GnRH试验和自发性夜间LH和FSH)。
成像技术在肾上腺发育不良的诊断中不是很重要;然而,它们可能有助于区分肾上腺发育不全和导致肾上腺功能不全的双侧肾上腺出血。
分子遗传学
DAX-1基因编码的蛋白质与孤儿核受体超家族的成员非常相似(11)。 DAX-1基因由两个由一个3.4kb内含子分开的外显子组成,编码470个氨基酸的蛋白质。已经鉴定出推定的DNA结合和配体结合结构域(15)。关于DAX-1基因产物及其配体的功能知之甚少。有人提出,DAX-1与转录因子类固醇生成因子1(SF-1)一起是类固醇生成组织正常发育所需的信号级联的一部分(41)。 SF-1敲除小鼠的显著表型与DAX-1基因突变患者相似,表明SF-1是肾上腺,性腺和腹内侧下丘脑核发育的关键介质( 42)。最近,已经分离出小鼠DAX-1基因(43,44)。鼠DAX-1基因编码472个氨基酸的蛋白质,与人DAX-1基因具有75%的总核苷酸序列同源性。改变DAX-1基因表达的小鼠模型系统将更深入地了解DAX-1蛋白在组织和发育特异性基因调节中的作用。
在一些研究中,已经证明DAX-1基因缺失或突变是AHC的原因(11-20)。现在普遍认为DAX-1基因突变也是AHC患者中促性腺激素性性腺机能减退的常见原因。大多数报道的点突变是移码或停止突变,其产生截短的无功能蛋白。有三个例外:两个氨基酸取代,R267P(12)和N440I(18),以及一个氨基酸V269的缺失(12)。这三个突变位于DAX-1基因产物的推定配体结合结构域中。
DAX-1与DNA发夹结构结合。 DAX-1与编码类固醇生成急性调节蛋白(StAR)的基因的启动子的结合导致StAR表达的转录抑制和类固醇生成的阻断(45)。 DAX-1的转录抑制由存在于DAX-1的推定配体结合结构域中的二分沉默结构域发挥。已经显示点突变R267P和ΔV269损害沉默(46)。
在本研究中,我们证明了我们系列中具有连续基因综合征的患者在AHC-GKD-DMD基因座中具有缺失,而大多数具有分离的AHC(具有促性腺激素性性腺功能减退症)的患者在DAX-中具有点突变。 1个基因。两名患有AHC和低促性腺激素性性腺功能减退症的患者完全缺失DAX-1基因。这里报道的点突变都是产生截短的无功能蛋白的移码或终止突变。终止密码子分布在整个基因上。与Nakae(17)一致,我们发现甚至在DAX-1蛋白的C末端的突变也引起AHC。末端11个氨基酸对于正常肾上腺皮质胚胎发生特别重要。
一些在出生后头几个月出现原发性肾上腺皮质功能不全的男性患者没有DAX-1基因缺失/突变。 AHC引起的原发性肾上腺皮质功能不全的诊断也在女孩中进行。必须假设人类基因组包含正常肾上腺皮质发育所必需的其他未知基因。
随着越来越多的单基因疾病在分子水平上得到解释,提出的一个重要问题是基因型与表型的相关性。如本研究和其他研究所示,在AHC患者中观察到了广泛的表型变异性(8,12,14,16,28-31)。推定的DAX-1基因产物的结构差异,正如基因内不同点突变所预期的那样,似乎没有解释症状发作年龄,症状严重程度或低促性腺激素性性腺功能减退症发生的不同表型。例如,完全删除DAX-1基因的病例8具有低的正常皮质醇血浆水平,在3岁时对ACTH的反应迟钝,而病例5,表达假定的DAX-1基因产物仅短10bp与正常情况相比,3个月时皮质醇血浆水平降低。这些事实表明,其他表观遗传或非遗传因素可能影响AHC的临床过程。
AHC的病理生理学尚不清楚。研究SF-1,DAX-1及其下游基因(例如StAR)之间的相互作用将使我们更加详细地了解肾上腺皮质分化过程中调节机制的功能。
参考:
1 Sikl H. 1948 Addison’s disease due to congenital adrenal hypoplasia of the adrenals in an infant aged 33 days. J Pathol Bactertiol . 60:323–326.
Crossref
2 Brook CGD, Bambach M, Zachmann M, Prader A. 1973 Familial congenital adrenal hypoplasia. Helv Paediatr Acta . 28:277–282.
Google ScholarPubMed
3 Sperling MA, Wolfsen AR, Fisher DA. 1973 Congenital adrenal hypoplasia: an isolated defect of organogenesis. J Pediatr . 82:444–449.
Google ScholarCrossrefPubMed
4 Burke BA, Wick MR, King R, et al. 1988 Congenital adrenal hypoplasia and selective absence of pituitary luteinizing hormone: a new autosomal recessive syndrome. Am J Med Genet . 31:75–97.
Google ScholarCrossrefPubMed
5 Kelch RP, Virdis R, Rapaport R, Greig F, Levine LS, New MI. 1984 Congenital adrenal hypoplasia. In: New MI, Levine LS (eds) Adrenal diseases in childhood. Pediatric and adolescent endocrinology. Basel: Karger; vol 13:156–161.
6 Burke BA. 1992 The pituitary, pineal, adrenal thyroid, and parathyroid glands. In: Stocker JT, Dechner LP, eds. Pediatric pathology, chapt 25. Philadelphia: Lippincott; 941–1001.
7 Prader A, Zachmann M, Illig R. 1975 Luteinizing hormone deficiency in hereditary congenital adrenal hypoplasia. J Pediatr . 86:421–422.
Google ScholarCrossrefPubMed
8 Kletter GB, Gorski JL, Kelch RP. 1991 Congenital adrenal hypoplasia and isolated gonadotropin deficiency. Trends Endocrinol Metab . 2:123–128.
Google ScholarCrossref
9 Francke U, Harper JF, Darras BT, et al. 1987 Congenital adrenal hypoplasia, myopathy, and glycerol kinase deficiency: molecular genetic evidence for deletions. Am J Hum Genet . 40:212–227.
Google ScholarPubMed
10 Worley KC, Ellison KA, Zhang YH, et al. 1993 Yeast artifical chromosome cloning in the glycerol kinase and adrenal hypoplasia congenita region of Xp21. Genomics . 16:407–416.
Google ScholarCrossrefPubMed
11 Zanaria E, Muscatelli F, Bardoni B, et al. 1994 An unusual member of the nuclear hormone receptor superfamily responsible for X-linked adrenal hypoplasia congenita. Nature . 372:635–641.
Google ScholarCrossrefPubMed
12 Muscatelli F, Strom TM, Walker AP, et al. 1994 Mutations in the DAX-1 gene give rise to both X-linked adrenal hypoplasia congenita and hypogonadotropic hypogonadism. Nature . 372:672–676.
Google ScholarCrossrefPubMed
13 Guo W, Mason JS, Stone CG, et al. 1995 Diagnosis of X-linked adrenal hypoplasia congenita by mutation analysis of the DAX1 gene. JAMA . 274:324–330.
Google ScholarCrossrefPubMed
14 Yanase T, Takayanagi R, Oba K, Nishi Y, Ohe K, Nawata H. 1996 New mutations of DAX-1 genes in two Japanese patients with X-linked congenital adrenal hypoplasia and hypogonadotropic hypogonadism. J Clin Endocrinol Metab . 81:530–535.
Google ScholarPubMed
15 Guo W, Burris TP, Zhang YH, et al. 1996 Genomic sequence of the DAX1 gene: an orphan nuclear receptor responsible for X-linked adrenal hypoplasia congenita and hypogonadotropic hypogonadism. J Clin Endocrinol Metab . 81:2481–2486.
Google ScholarPubMed
16 Habiby RL, Boepple P, Nachtigall L, Sluss PM, Crowley WF, Jameson JL. 1996 Adrenal hypoplasia congenita with hypogonadotropic hypogonadism: evidence that DAX-1 mutations lead to combined hypothalmic and pituitary defects in gonadotropin production. J Clin Invest . 98:1055–1062.
Google ScholarCrossrefPubMed
17 Nakae J, Tajima T, Kusuda S, et al. 1996 Truncation at the C-terminus of the DAX-1 protein impairs its biological actions in patients with X-linked adrenal hypoplasia congenita. J Clin Endocrinol Metab . 81:3680–3685.
Google ScholarPubMed
18 Schwartz M, Blichfeldt S, Müller J. 1997 X-linked adrenal hypoplasia in a large Greenlandic family. Detection of a missense mutation (N440I) in the DAX-1 gene; implication for genetic counselling and carrier diagnosis. Hum Genet . 99:83–87.
Google ScholarCrossrefPubMed
19 Takahashi T, Shoji Y, Haraguchi N, Takahashi I, Takada G. 1997 Active hypothalamic-pituitary-gonadal axis in an infant with X-linked adrenal hypoplasia congenita. J Pediatr . 130:485–488.
Google ScholarCrossrefPubMed
20 Kinoshita E, Yoshimoto M, Motomura K, et al. 1997 DAX-1 gene mutations and deletions in Japanese patients with adrenal hypoplasia congenita and hypogonadotrophic hypogonadism. Horm Res . 48:29–34.
Google ScholarCrossrefPubMed
21 Sippell WG, Bidlingmaier F, Becker H, et al. 1978 Simultaneous radioimmunoassay of plasma aldosterone, corticosterone, 11-deoxycorticosterone, progesterone, 17-hydroxyprogesterone, 11-deoxycortisol, cortisol, and cortisone. J Steroid Biochem . 9:63–74.
Google ScholarCrossrefPubMed
22 Peter M, Partsch CJ, Dörr HG, Sippell WG. 1996 Prenatal diagnosis of congenital adrenal hypoplasia. Horm Res . 46:41–45.
Google ScholarCrossrefPubMed
23 Kohlschütter A, Willig HP, Schlamp D, et al. 1987 Infantile glycerol kinase deficiency–a condition requiring prompt identification. Clinical, biochemical, and morphological findings in two cases. Eur J Pediatr . 146:575–581.
Google ScholarCrossrefPubMed
24 Sippell WG, Dörr HG, Bidlingmaier F, Knorr D. 1980 Plasma levels of aldosterone, corticosterone, 11-deoxycorticosterone, progesterone, 17-hydroxyprogesterone, 11-deoxycortisol, cortisol, and cortisone during infancy and childhood. Pediatr Res . 14:39–49.
Google ScholarCrossrefPubMed
25 Schnakenburg K, Bidlingmaier F, Knorr D. 1980 17-Hydroxyprogesterone, androstenedione, and testosterone in normal children and in prepubertal children with congenital adrenal hyperplasia. Pediatrics . 133:259–267.
26 Guo W, Worley KC, Adams V, et al. 1993 Genomic scanning for expressed sequences in Xp21 identifies the glycerol kinase gene. Nat Genet . 4:367–372.
Google ScholarCrossrefPubMed
27 Koenig M, Monaco AP, Kunkel LM. 1988 The complete sequence of dystrophin predicts a rod-shaped cytoskeletal protein. Cell . 53:219–226.
Google ScholarCrossrefPubMed
28 Golden MP, Lippe BM, Kaplan SA. 1977 Congenital adrenal hypoplasia and hypogonadotropic hypogonadism. Am J Dis Child . 131:1117–1118.
Google ScholarCrossrefPubMed
29 Kelly WF, Joplin GF, Pearson GW. 1977 Gonadotropin deficiency and adrenocortical insufficiency in children: a new syndrome. Br Med J . 9:98.
Google ScholarCrossref
30 Hay ID, Smail PJ, Forsyth CC. 1983 Familial cytomegalic adrenocortical hypopasia: an X-linked syndrome of pubertal failure. Arch Dis Child . 56:715–721.
Google ScholarCrossref
31 Sills IN, Voorhess ML, MacGillivray MH, Peterson RE. 1983 Prolonged survival without therapy in congenital adrenal hypoplasia. Am J Dis Child . 137:1186–1188.
Google ScholarPubMed
32 Zachmann M, Illig R, Prader A. 1980 Gonadotropin deficiency and cryptorchidism in three prepubertal brothers with congenital adrenal hypoplasia. J Pediatr . 97:255–257.
Google ScholarCrossrefPubMed
33 Gordon D, Cohen HN, Beastall GH, Hay ID, Thomson JA. 1984 Contrasting effects of subcutaneous pulsatile GnRH therapy in congenital adrenal hypoplasia and Kallmann’s syndrome. Clin Endocrinol (Oxf) . 21:597–603.
Google ScholarCrossrefPubMed
34 Kikuchi K, Kaji M, Momoi T, Mikawa H, Shigematsu Y, Sudo M. 1987 Failure to induce puberty in a man with X-linked congenital adrenal hypoplasia and hypogonadotropic hypogonadism by pulsatile administration of low-dose gonadotropin-releasing hormone. Acta Endocrinol (Copenh) . 114:153–160.
Google ScholarPubMed
35 Bovet P, Reymond MJ, Rey F, Gomez F. 1988 Lack of gonadotropic response to pulsatile gonadotropin-releasing hormone in isolated hypogonadotropic hypogonadism associated to congenital adrenal hypoplasia. J Endocrinol Invest . 11:201–204.
Google ScholarCrossrefPubMed
36 Kruse K, Sippell WG, Schnakenburg K. 1984 Hypogonadism in congenital adrenal hypoplasia: evidence for a hypothalamic origin. J Clin Endocrinol Metab . 58:12–17.
Google ScholarCrossrefPubMed
37 Partsch CJ, Sippell WG. 1989 Hypothalamic hypogonadism in congenital adrenal hypoplasia. Horm Metab Res . 21:623–625.
Google ScholarCrossrefPubMed
38 Guo W, Burris TP, McCabe ER. 1995 Expression of DAX-1, the gene responsible for X-linked adrenal hypoplasia congenita and hypogonadotropic hypogonadism, in the hypothalamic-pituitary-adrenal/gonadal axis. Biochem Mol Med . 56:8–13.
Google ScholarCrossrefPubMed
39 Laverty CRA, Fortune DW, Beischer NA. 1973 Congenital idiopathic adrenal hypoplasia. Obstet Gynecol . 41:655–663.
Google ScholarPubMed
40 Mauthe I, Laspe H, Knorr D. 1976 Zur Häufigkeit des kongenitalen adrenogenitalen Syndroms (AGS): München 1963–72. Klin Paediatr . 189:172–176.
41 Burris TP, Guo W, Le T, McCabe ER. 1995 Identification of a putative steroidogenic factor-1 response element in the DAX-1 promoter. Biochem Biophys Res Commun . 214:576–581.
Google ScholarCrossrefPubMed
42 Caron KM, Clark BJ, Ikeda Y, Parker KL. 1997 Steroidogenic factor 1 acts at all levels of the reproductive axis. Steroids . 62:53–56.
Google ScholarCrossrefPubMed
43 Swain A, Zanaria E, Hacker A, Lovell BR, Camerino G. 1996 Mouse Dax1 expression is consistent with a role in sex determination as well as in adrenal and hypothalamus function. Nat Genet . 12:404–409.
Google ScholarCrossrefPubMed
44 Bae DS, Schaefer ML, Partan BW, Muglia L. 1996 Characterization of the mouse DAX-1 gene reveals evolutionary conservation of a unique amino-terminal motif and widespread expression in mouse tissue. Endocrinology . 137:3921–3927.
Google ScholarPubMed
45 Zazopoulos E, Lalli E, Stocco DM, Sassone-Corsi P. 1997 DNA binding and transcriptional repression by DAX-1 blocks steroidogenesis. Nature . 390:311–315.
Google ScholarCrossrefPubMed
46 Lalli E, Bardoni B, Zazopoulos E, et al. 1997 A transcriptional silencing domain an DAX-1 whose mutation causes adrenal hypoplasia congenita. Mol Endocrinol . 13:1950–1960. |