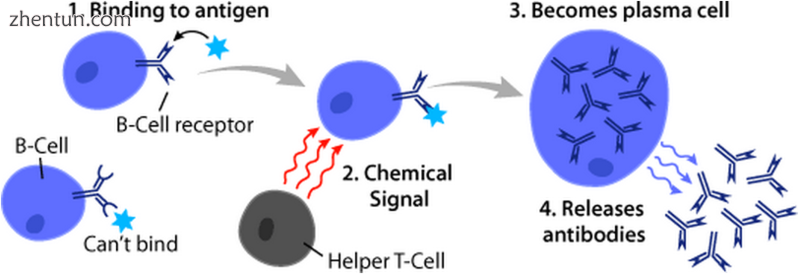
基本B细胞功能:与抗原结合,从同源辅助T细胞获得帮助,并分化成分泌大量抗体的浆细胞
3D B细胞的绘制
B细胞,也称为B淋巴细胞,是一种淋巴细胞亚型的白细胞。[1] 它们通过分泌抗体在适应性免疫系统的体液免疫组分中起作用。[1] 此外,B细胞呈递抗原(它们也被归类为专职抗原呈递细胞(APC))并分泌细胞因子[1]。 在哺乳动物中,B细胞在骨髓中成熟,骨髓是大多数骨骼的核心。[2] 在鸟类中,B细胞在法氏囊(一种淋巴器官)的囊中成熟。 (来自B细胞的“B”来自这个器官的名称,它首先由Chang和Glick发现,[2]而不是通常认为的骨髓。)
与其他两类淋巴细胞,T细胞和自然杀伤细胞不同,B细胞在其细胞膜上表达B细胞受体(BCR)。[1] BCR允许B细胞与特定抗原结合,针对该抗原,它将引发抗体反应。[1]
目录
1 发展
2 激活
2.1 T细胞依赖性激活
2.2 T细胞非依赖性激活
2.3 记忆B细胞激活
3 B细胞类型
4 B细胞相关病理学
5 表观遗传
6 参考
发展
B细胞从源自骨髓的造血干细胞(HSC)发展而来。[3] HSC首先分化为多能祖细胞(MPP),然后分化为常见的淋巴祖细胞(CLP)[3]。 从这里开始,它们发育成B细胞分几个阶段(如右图所示),每个阶段都有各种基因表达模式和免疫球蛋白H链和L链基因位点排列,后者归因于B细胞经历V(D) 随着它们的发展,J重组。[4]
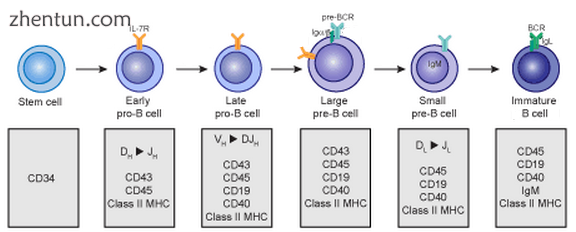
早期B细胞发育:从干细胞到未成熟B细胞
B细胞在骨髓中发育时经历两种类型的选择以确保适当的发育。阳性选择通过涉及前BCR和BCR的抗原非依赖性信号传导发生。[5] [6]如果这些受体不与其配体结合,则B细胞不会接收到正确的信号并停止发育。[5] [6]通过自身抗原与BCR的结合发生阴性选择;如果BCR可以强烈结合自身抗原,则B细胞经历四种命运之一:克隆缺失,受体编辑,无能或无知(B细胞忽略信号并继续发育)。[6]这种负选择过程导致中枢耐受状态,其中成熟B细胞不与骨髓中存在的自身抗原结合[4]。
为了完成发育,未成熟的B细胞作为过渡性B细胞从骨髓迁移到脾脏,经过两个过渡阶段:T1和T2。[7]在它们迁移到脾脏和脾脏进入后,它们被认为是T1 B细胞。[8]脾脏内,T1 B细胞向T2 B细胞过渡。[8] T2 B细胞分化为滤泡(FO)B细胞或边缘区(MZ)B细胞,这取决于通过BCR和其他受体接收的信号。[9]一旦分化,它们现在被认为是成熟的B细胞或幼稚的B细胞。[8]
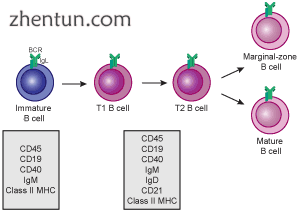
过渡性B细胞发育:从未成熟B细胞到MZ B细胞或成熟(FO)B细胞
激活
B细胞活化发生在次级淋巴器官(SLO),如脾脏和淋巴结。[1] B细胞在骨髓中成熟后,它们通过血液迁移到SLO,SLO通过循环淋巴接受持续的抗原供应。[10]在SLO,当B细胞通过其BCR与抗原结合时,B细胞活化开始。[11]尽管尚未完全确定活化后立即发生的事件,但据信B细胞根据最初在T淋巴细胞中测定的动力学分离模型被激活。该模型表明在抗原刺激之前,受体通过膜以相等的频率与Lck和CD45接触扩散,从而形成磷酸化和非磷酸化的净平衡。只有当细胞与抗原呈递细胞接触时,由于两个膜之间的距离很近,较大的CD45才会移位。这允许BCR的净磷酸化和信号转导途径的起始。在三个B细胞亚群中,FO B细胞优先经历T细胞依赖性激活,而MZ B细胞和B1 B细胞优先经历T细胞非依赖性激活。[12]
B细胞活化:从未成熟B细胞到浆细胞或记忆B细胞
通过CD21的活性增强B细胞活化,CD21是与表面蛋白CD19和CD81复合的表面受体(所有这三者统称为B细胞共同受体复合物)。[13]当BCR结合标记有C3补体蛋白片段的抗原时,CD21与C3片段结合,与结合的BCR共连接,信号通过CD19和CD81转导以降低细胞的激活阈值[14]。
T细胞依赖性激活
在T细胞的帮助下激活B细胞的抗原被称为T细胞依赖性(TD)抗原,包括外来蛋白。[1]它们之所以如此命名是因为它们无法在缺乏T细胞的生物体中诱导体液反应。[1] B细胞对这些抗原的反应需要数天,尽管产生的抗体具有更高的亲和力,并且功能上比通过T细胞非依赖性激活产生的更具功能性。[1]
一旦BCR结合TD抗原,抗原就会通过受体介导的内吞作用被吸收到B细胞中,降解,并作为肽片呈递给T细胞,与细胞膜上的MHC-II分子复合。[15] T辅助(TH)细胞,通常是卵泡T辅助细胞(TFH),用相同的抗原激活,通过它们的T细胞受体(TCR)识别并结合这些MHC-II-肽复合物。[16]在TCR-MHC-II-肽结合后,T细胞表达表面蛋白CD40L以及细胞因子如IL-4和IL-21 [16]。 CD40L通过结合B细胞表面受体CD40作为B细胞活化的必要共刺激因子,其促进B细胞增殖,免疫球蛋白类别转换和体细胞高变以及维持T细胞生长和分化[1]。由B细胞细胞因子受体结合的T细胞衍生细胞因子也促进B细胞增殖,免疫球蛋白类别转换和体细胞高变以及指导分化[16]。在B细胞接收到这些信号后,它们被认为是激活的。[16]
现在被激活,B细胞参与两步分化过程,产生短暂的浆母细胞用于立即保护,长寿浆细胞和记忆B细胞用于持续保护。[12]第一步,称为卵泡外反应,发生在淋巴滤泡外,但仍在SLO中。[12]在此步骤中,活化的B细胞增殖,可能经历免疫球蛋白类转换,并分化成浆细胞,产生早期的弱抗体,主要是IgM类。[17]第二步包括活化的B细胞进入淋巴滤泡并形成生发中心(GC),这是一种特殊的微环境,其中B细胞经历广泛增殖,免疫球蛋白类转换和由体细胞超突变引起的亲和力成熟。[18]这些过程由GC中的TFH细胞促进,并产生高亲和力记忆B细胞和长寿浆细胞。[12]得到的浆细胞分泌大量抗体,并留在SLO内,或者更优先地,转移到骨髓中。[18]
T细胞非依赖性激活
主要文章:T独立抗原(TI)
在没有T细胞帮助的情况下激活B细胞的抗原被称为T细胞非依赖性(TI)抗原[1],包括外源多糖和未甲基化的CpG DNA。[12]它们之所以如此命名是因为它们能够在缺乏T细胞的生物体中诱导体液反应。[1] B细胞对这些抗原的反应很快,尽管产生的抗体倾向于具有较低的亲和力,并且功能上比T细胞依赖性激活产生的更少。[1]
与TD抗原一样,TI抗原激活的B细胞需要额外的信号来完成激活,但不是通过T细胞接收它们,而是通过识别和结合常见的微生物成分与Toll样受体(TLR)或通过BCR广泛交联到细菌细胞上的重复表位。[1]由TI抗原激活的B细胞继续在淋巴滤泡外扩散,但仍然在SLO(GC不形成),可能经历免疫球蛋白类转换,并分化成短期浆母细胞,产生早期的弱抗体,主要是IgM类,但也一些长寿浆细胞群。[19]
记忆B细胞激活
记忆B细胞的激活始于其靶抗原的检测和结合,这是由它们的亲B细胞共有的。[20]一些记忆B细胞可以在没有T细胞帮助的情况下被激活,例如某些病毒特异性记忆B细胞,但其他记忆B细胞需要T细胞帮助。[21]在抗原结合后,记忆B细胞通过受体介导的内吞作用摄取抗原,使其降解,并将其作为与细胞膜上的MHC-II分子复合的肽片呈递给T细胞。[20]记忆T辅助(TH)细胞,通常是记忆滤泡T辅助细胞(TFH),来自用相同抗原激活的T细胞,通过它们的TCR识别并结合这些MHC-II-肽复合物。[20]在TCR-MHC-II-肽结合和来自记忆TFH细胞的其他信号的中继后,记忆B细胞被激活并通过滤泡外反应分化成浆母细胞和浆细胞或进入生发中心反应,在那里它们产生浆细胞和更多的记忆B细胞。[20] [21]尚不清楚记忆B细胞是否在这些次级GC中经历进一步的亲和力成熟。[20]
B细胞类型
浆细胞 - 一种由B细胞分化引起的短寿命增殖抗体分泌细胞。[1]浆母细胞在感染早期产生,与浆细胞相比,它们的抗体往往对其靶抗原具有较弱的亲和力。[12]浆细胞可以由T细胞非依赖性B细胞活化或T细胞依赖性B细胞活化引起的滤泡外反应引起[1]。
浆细胞 - 由B细胞分化引起的长寿,非增殖抗体分泌细胞。[1]有证据表明B细胞首先分化为浆母细胞样细胞,然后分化成浆细胞[12]。血浆细胞在感染后期产生,与浆母细胞相比,由于生发中心(GC)的亲和力成熟而产生更多抗体,因此具有对其靶抗原具有更高亲和力的抗体。[12]浆细胞通常来自B细胞的T细胞依赖性激活的生发中心反应,然而它们也可以由B细胞的T细胞非依赖性激活产生。[19]
淋巴细胞样细胞 - 一种具有B淋巴细胞和浆细胞形态特征混合物的细胞,被认为与浆细胞密切相关或亚型。这种细胞类型存在于与IgM单克隆蛋白分泌相关的恶变前和恶性浆细胞恶液质中;这些恶液质包括意义不明的IgM单克隆丙种球蛋白病和Waldenström的巨球蛋白血症。[22]
记忆B细胞 - 由B细胞分化引起的休眠B细胞。[1]它们的功能是通过身体循环并发起更强,更快速的抗体反应(称为回忆二抗反应),如果他们检测到已激活其亲本B细胞的抗原(记忆B细胞及其亲本B细胞共享相同) BCR,因此他们检测相同的抗原)。[21]记忆B细胞可以通过卵泡外反应和生发中心反应以及B1细胞的T细胞非依赖性激活从T细胞依赖性激活产生。[21]
B-2细胞 - FO B细胞和MZ B细胞。[23]
卵泡(FO)B细胞(也称为B-2细胞) - 最常见的B细胞类型,当不通过血液循环时,主要存在于次级淋巴器官(SLO)的淋巴滤泡中。[12]它们负责在感染期间产生大多数高亲和力抗体。[1]
边缘区(MZ)B细胞 - 主要发现在脾的边缘区域,作为抵抗血源性病原体的第一道防线,因为边缘区域从大循环中接收大量血液。[24]它们可以进行T细胞非依赖性和T细胞依赖性激活,但优先进行T细胞非依赖性激活。[12]
B-1细胞 - 来自不同于FO B细胞和MZ B细胞的发育途径[23]。在小鼠中,它们主要包括腹膜腔和胸膜腔,产生天然抗体(无感染产生的抗体),抵抗粘膜病原体,并且主要表现出T细胞非依赖性激活。[23]尽管已经描述了与B-1细胞类似的各种细胞群,但尚未在人类中发现真正的小鼠B-1细胞同源物[23]。
调节性B(Breg)细胞 - 一种免疫抑制性B细胞类型,通过分泌IL-10,IL-35和TGF-β来阻止致病性促炎性淋巴细胞的扩增[25]。此外,它通过直接与T细胞相互作用促进调节性T(Treg)细胞的产生,从而扭曲它们向Tregs的分化[25]。没有描述共同的Breg细胞身份,并且在小鼠和人类中都发现了许多共享调节功能的Breg细胞亚群。[25]目前尚不清楚Breg细胞亚群是否与发育有关,以及究竟是如何分化成Breg细胞的。[25]有证据表明几乎所有B细胞类型都可以通过涉及炎症信号和BCR识别的机制分化成Breg细胞[25]。
B细胞相关病理学
自身免疫性疾病可能是由自身抗原的异常B细胞识别,然后是自身抗体的产生引起的。[26]疾病活动与B细胞活动相关的自身免疫性疾病包括硬皮病,多发性硬化症,系统性红斑狼疮,1型糖尿病和类风湿性关节炎[26]。
B细胞及其前体的恶性转化可引起许多癌症,包括慢性淋巴细胞白血病(CLL),急性淋巴细胞白血病(ALL),毛细胞白血病,滤泡性淋巴瘤,非霍奇金淋巴瘤,霍奇金淋巴瘤和浆细胞恶性肿瘤等。 多发性骨髓瘤,瓦尔登斯特伦的巨球蛋白血症和某些形式的淀粉样变性。[27] [28]
表观遗传
一项使用全基因组亚硫酸氢盐测序(WGBS)研究沿其分化周期的B细胞甲基化组的研究表明,从最早阶段到最分化阶段存在低甲基化。 最大的甲基化差异在生发中心B细胞和记忆B细胞的阶段之间。 此外,这项研究表明,B细胞肿瘤和长寿B细胞的DNA甲基化特征之间存在相似性。[29]
参考
Murphy, Kenneth (2012). Janeway's Immunobiology (8th ed.). New York: Garland Science. ISBN 9780815342434.
Cooper, Max D. (2015-01-01). "The early history of B cells". Nature Reviews Immunology. 15 (3): 191–7. doi:10.1038/nri3801. PMID 25656707.
Kondo, Motonari (2010-11-01). "Lymphoid and myeloid lineage commitment in multipotent hematopoietic progenitors". Immunological Reviews. 238 (1): 37–46. doi:10.1111/j.1600-065X.2010.00963.x. ISSN 1600-065X. PMC 2975965. PMID 20969583.
Pelanda, Roberta; Torres, Raul M. (2012-04-01). "Central B-Cell Tolerance: Where Selection Begins". Cold Spring Harbor Perspectives in Biology. 4 (4): a007146. doi:10.1101/cshperspect.a007146. ISSN 1943-0264. PMC 3312675. PMID 22378602.
Martensson, Inga-Lill; Almqvist, Nina; Grimsholm, Ola; Bernardi, Angelina (2010). "The pre-B cell receptor checkpoint". FEBS Letters. 584 (12): 2572–9. doi:10.1016/j.febslet.2010.04.057. PMID 20420836.
LeBien, Tucker W.; Tedder, Thomas F. (2008-09-01). "B lymphocytes: how they develop and function". Blood. 112 (5): 1570–1580. doi:10.1182/blood-2008-02-078071. ISSN 0006-4971. PMC 2518873. PMID 18725575.
Loder, By Florienne; Mutschler, Bettina; Ray, Robert J.; Paige, Christopher J.; Sideras, Paschalis; Torres, Raul; Lamers, Marinus C.; Carsetti, Rita (1999-07-01). "B Cell Development in the Spleen Takes Place in Discrete Steps and Is Determined by the Quality of B Cell Receptor–Derived Signals". The Journal of Experimental Medicine. 190 (1): 75–90. doi:10.1084/jem.190.1.75. ISSN 0022-1007. PMC 2195560. PMID 10429672.
Chung, James B.; Silverman, Michael; Monroe, John G. (2003-01-06). "Transitional B cells: step by step towards immune competence". Trends in Immunology. 24 (6): 342–348. doi:10.1016/S1471-4906(03)00119-4. ISSN 1471-4906.
Cerutti, Andrea; Cols, Montserrat; Puga, Irene (2013-01-01). "Marginal zone B cells: virtues of innate-like antibody-producing lymphocytes". Nature Reviews Immunology. 13 (2): 118–32. doi:10.1038/nri3383. PMC 3652659. PMID 23348416.
Harwood, Naomi E.; Batista, Facundo D. (2010-01-01). "Early Events in B Cell Activation". Annual Review of Immunology. 28 (1): 185–210. doi:10.1146/annurev-immunol-030409-101216. PMID 20192804.
Yuseff, Maria-Isabel; Pierobon, Paolo; Reversat, Anne; Lennon-Duménil, Ana-Maria (2013-01-01). "How B cells capture, process and present antigens: a crucial role for cell polarity". Nature Reviews Immunology. 13 (7): 475. doi:10.1038/nri3469. PMID 23797063.
Nutt, Stephen L.; Hodgkin, Philip D.; Tarlinton, David M.; Corcoran, Lynn M. (2015-01-01). "The generation of antibody-secreting plasma cells". Nature Reviews Immunology. 15 (3): 160. doi:10.1038/nri3795. PMID 25698678.
Asokan, Rengasamy; Banda, Nirmal K.; Szakonyi, Gerda; Chen, Xiaojiang S.; Holers, V. Michael (2013-01-01). "Human complement receptor 2 (CR2/CD21) as a receptor for DNA: Implications for its roles in the immune response and the pathogenesis of systemic lupus erythematosus (SLE)". Molecular Immunology. 53 (1–2): 99–110. doi:10.1016/j.molimm.2012.07.002. PMC 3439536. PMID 22885687.
Zabel, Mark D.; Weis, John H. (2001-03-01). "Cell-specific regulation of the CD21 gene". International Immunopharmacology. Unraveling Mechanisms and Discovering Novel Roles for Complement. 1 (3): 483–493. doi:10.1016/S1567-5769(00)00046-1. PMID 11367532.
Blum, Janice S.; Wearsch, Pamela A.; Cresswell, Peter (2013-01-01). "Pathways of Antigen Processing". Annual Review of Immunology. 31 (1): 443–473. doi:10.1146/annurev-immunol-032712-095910. PMC 4026165. PMID 23298205.
Crotty, Shane (2015-01-01). "A brief history of T cell help to B cells". Nature Reviews Immunology. 15 (3): 185–9. doi:10.1038/nri3803. PMC 4414089. PMID 25677493.
MacLennan, Ian C. M.; Toellner, Kai-Michael; Cunningham, Adam F.; Serre, Karine; Sze, Daniel M.-Y.; Zúñiga, Elina; Cook, Matthew C.; Vinuesa, Carola G. (2003-08-01). "Extrafollicular antibody responses". Immunological Reviews. 194: 8–18. doi:10.1034/j.1600-065x.2003.00058.x. ISSN 0105-2896. PMID 12846803.
Shlomchik, Mark J.; Weisel, Florian (2012-05-01). "Germinal center selection and the development of memory B and plasma cells". Immunological Reviews. 247 (1): 52–63. doi:10.1111/j.1600-065X.2012.01124.x. ISSN 1600-065X. PMID 22500831.
Bortnick, Alexandra; Chernova, Irene; Quinn, William J.; Mugnier, Monica; Cancro, Michael P.; Allman, David (2012-06-01). "Long-Lived Bone Marrow Plasma Cells Are Induced Early in Response to T Cell-Independent or T Cell-Dependent Antigens". The Journal of Immunology. 188 (11): 5389–5396. doi:10.4049/jimmunol.1102808. ISSN 0022-1767. PMC 4341991. PMID 22529295.
McHeyzer-Williams, Michael; Okitsu, Shinji; Wang, Nathaniel; McHeyzer-Williams, Louise (2011-01-01). "Molecular programming of B cell memory". Nature Reviews Immunology. 12 (1): 24–34. doi:10.1038/nri3128. PMC 3947622. PMID 22158414.
Kurosaki, Tomohiro; Kometani, Kohei; Ise, Wataru (2015-01-01). "Memory B cells". Nature Reviews Immunology. 15 (3): 149. doi:10.1038/nri3802. PMID 25677494.
Ribourtout B, Zandecki M (2015). "Plasma cell morphology in multiple myeloma and related disorders". Morphologie : Bulletin De l'Association Des Anatomistes. 99 (325): 38–62. doi:10.1016/j.morpho.2015.02.001. PMID 25899140.
Baumgarth, Nicole (2010-01-01). "The double life of a B-1 cell: self-reactivity selects for protective effector functions". Nature Reviews Immunology. 11 (1): 34–46. doi:10.1038/nri2901. PMID 21151033.
Pillai, Shiv; Cariappa, Annaiah; Moran, Stewart T. (2005-01-01). "Marginal Zone B Cells". Annual Review of Immunology. 23 (1): 161–196. doi:10.1146/annurev.immunol.23.021704.115728. PMID 15771569.
Rosser, Elizabeth C.; Mauri, Claudia (2015). "Regulatory B Cells: Origin, Phenotype, and Function". Immunity. 42 (4): 607–612. doi:10.1016/j.immuni.2015.04.005. ISSN 1074-7613. PMID 25902480.
Yanaba, Koichi; Bouaziz, Jean-David; Matsushita, Takashi; Magro, Cynthia M.; St.Clair, E. William; Tedder, Thomas F. (2008-06-01). "B-lymphocyte contributions to human autoimmune disease". Immunological Reviews. 223 (1): 284–299. doi:10.1111/j.1600-065X.2008.00646.x. ISSN 1600-065X.
III, Arthur L. Shaffer; Young, Ryan M.; Staudt, Louis M. (2012-01-01). "Pathogenesis of Human B Cell Lymphomas". Annual Review of Immunology. 30 (1): 565–610. doi:10.1146/annurev-immunol-020711-075027. PMID 22224767.
Castillo JJ (2016). "Plasma Cell Disorders". Primary Care. 43 (4): 677–691. doi:10.1016/j.pop.2016.07.002. PMID 27866585.
Kulis, Marta; Merkel, Angelika; Heath, Simon; Queirós, Ana C.; Schuyler, Ronald P.; Castellano, Giancarlo; Beekman, Renée; Raineri, Emanuele; Esteve, Anna (2015-07-01). "Whole-genome fingerprint of the DNA methylome during human B cell differentiation". Nature Genetics. 47 (7): 746–756. doi:10.1038/ng.3291. ISSN 1061-4036. PMID 26053498. |