
缺乏21-羟化酶可导致17α-羟基孕酮的积累
由21-羟化酶缺乏引起的先天性肾上腺增生(21-OH CAH),在所有形式中,占先天性肾上腺增生的确诊病例的95%以上,[1]和大多数情况下的“CAH”是指21-羟化酶缺乏症。
目录
1 分类
2 遗传学
3 病理生理学
4 类型
4.1 严重的早发性21-羟化酶缺乏的CAH
4.1.1 婴儿期的盐浪费危机
4.1.2 女婴的病毒化
4.1.3 性别分配问题和争议
4.2 儿童期(简单男性化)CAH
4.3 晚发(非经典)CAH
5 新生儿筛查
6 产前诊断和治疗
7 CAH的长期管理
7.1 激素替代
7.1.1 压力覆盖,危机预防,父母教育
7.2 重建手术
7.3 优化CAH的增长
7.4 预防高雄激素血症和优化生育能力
7.5 心理性的发展和问题
8 发病率
9 睾丸肾上腺静息肿瘤
10 参考资料
分类
该病症可分为“盐萎缩”,“简单男性化”和“非经典”形式。
| 类型 | 性类固醇的影响 | 其他影响 | | 严重的21-羟化酶缺乏导致盐消耗CAH | 由于遗传性女性(XX)婴儿的产前男性化,导致生殖器暧昧的最常见原因。 | 在生命的最初几周内发生危及生命的呕吐和脱水。 醛固酮和皮质醇水平均降低。 | | 中度的21-羟化酶缺乏症被称为简单的男性化CAH | 通常被认为是引起青春期前儿童的男性化。 | 皮质醇减少,但醛固酮不减少。 | | 更温和形式的21-羟化酶缺乏症被称为非经典CAH | 青春期和成年女性可引起雄激素效应和不孕症。 | 醛固酮和皮质醇都没有减少。 |
盐浪费和简单的男性化类型有时被归为“经典”。[2]
遗传学
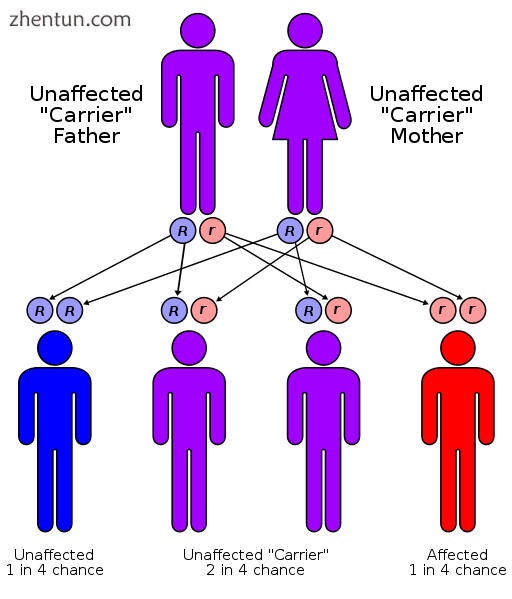
21-羟化酶CAH以常染色体隐性方式遗传
P450c21酶(也称为21-羟化酶)的CYP21A2基因在编码主要人组织相容性基因座(HLA)的基因HLA B和HLA DR中为6p21.3 [3]。 CYP21A2与无功能的假基因CYP21A1P配对。已经记载了CYP21A2的异常等位基因的分数,其大部分来自CYP21A2和CYP21A1P的同源区域的重组。各种等位基因的残留酶活性的差异解释了疾病的不同程度的严重程度。所有形式的21-羟化酶CAH的遗传都是常染色体隐性遗传。
受任何形式的疾病影响的人具有两个异常等位基因,并且父母通常都是杂合子(或携带者)。当父母双方都携带异常等位基因时,每个孩子有25%的几率患有这种疾病,50%的几率成为像父母一样的携带者,并且有25%的几率患有两个正常基因。
现在可以通过在ACTH刺激后测量17α-羟孕酮升高来测试杂合性,或者最近通过直接基因测序来测试杂合性。
病理生理学
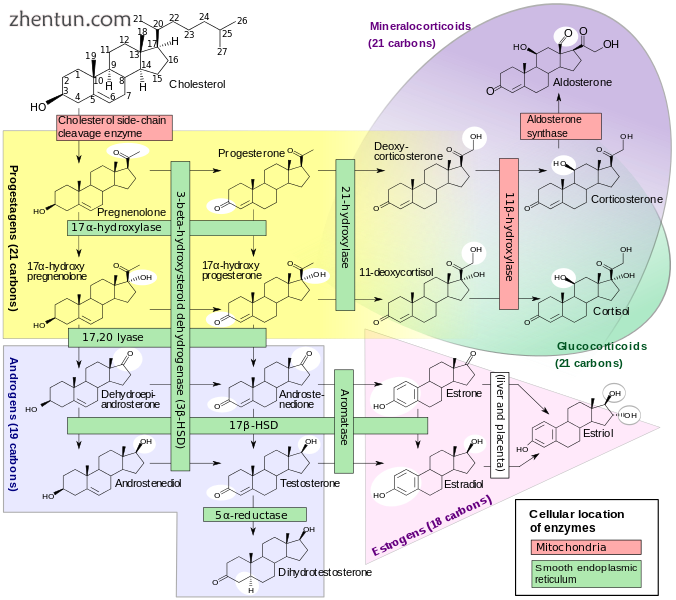
人类类固醇生成,在上部中心显示21-α羟化酶,右侧有醛固酮和皮质醇通路,左侧是雄激素通路。
酶P450c21,通常称为21-羟化酶(21-OH),嵌入肾上腺皮质细胞的光滑内质网中。它催化17α-羟孕酮(17OHP)羟化为糖皮质激素途径中的11-脱氧皮质醇,从孕烯醇酮开始,用皮质醇完成。它还在从孕烯醇酮到醛固酮的途中催化黄体酮羟基化为盐皮质激素途径中的11-脱氧皮质酮(DOC)。
这种酶的活性降低会降低皮质醇合成的效率,从而导致肾上腺皮质增生和ACTH水平升高。 ACTH刺激胆固醇的摄取和孕烯醇酮的合成。类固醇前体直至并包括黄体酮,17α-羟基孕烯醇酮,尤其是17α-羟基孕酮在肾上腺皮质和循环血液中积累。 17OHP的血液水平可达到正常浓度的10-1000倍。
由于21-羟化酶活性不参与雄激素的合成,因此大部分17α-羟基孕烯醇酮的大部分被转用于DHEA,雄烯二酮和睾酮的合成,开始于两性的胎儿生命的第三个月。
醛固酮的合成还取决于21-羟化酶活性。尽管胎儿产生受损,但它不会产生产前效应,因为胎盘连接允许母体血液“透析”胎儿并维持电解质平衡和血容量。
类型
严重的,早发性的21-羟化酶缺乏的CAH
21-羟化酶缺乏症的两个最严重的新生儿后果发生在产前生命中可测量的羟化酶活性最小的情况下:对于XX和XY婴儿,在生命的第一个月中存在危及生命的盐浪费危机以及女性婴儿的严重男性化。
婴儿期的盐浪费危机
过量的肾上腺睾酮对严重CAH的男婴的生殖器几乎没有影响。如果新生儿筛查未发现患有CAH的男婴,他将看起来健康和正常,并迅速出院回家。
然而,醛固酮的缺乏导致尿液中钠的高损失率。尿钠浓度可能超过50 mEq / L.由于这种盐损失率,婴儿不能维持血容量,并且在生命的第一周结束时开始出现低钠血症脱水。当盐皮质激素活性不足时,钾和酸的排泄也受到损害,并且高钾血症和代谢性酸中毒逐渐发展。皮质醇缺乏的影响进一步限制了维持血液循环的能力。早期症状是随地吐痰和体重增加不佳,但大多数患有严重CAH的婴儿在出生后第二周或第三周出现呕吐,严重脱水和循环衰竭(休克)。
当被带到医院时,1-3周大的婴儿将因体重不足和脱水。血压可能很低。基础化学将揭示低钠血症,血清Na +通常在105和125 mEq / L之间。这些婴儿的高钾血症可能是极端水平的K +高于10 mEq / L并不罕见 - 代谢性酸中毒的程度也是如此。可能存在低血糖症。这被称为盐浪费危机,如果不加以治疗,会迅速导致死亡。
尽管这些婴儿病情很严重,但他们对氢化可的松和静脉注射生理盐水和葡萄糖的治疗反应迅速,迅速恢复血容量,血压和体内钠含量,并逆转高钾血症。通过适当的治疗,大多数婴儿在24小时内就会脱离危险。
女婴的病毒化
遗传性雌性(XX)婴儿的病毒化通常会产生明显的生殖器歧义。在骨盆内,卵巢是正常的,因为它们没有暴露于睾丸抗苗勒管激素(MIF),所以通常也会形成子宫,输卵管,上阴道和其他苗勒结构。然而,血液中高水平的睾酮可以扩大阴茎,部分或完全闭合阴道口,包围尿道沟,使其在阴茎底部,轴上或甚至像男孩一样在尖端处打开。睾丸激素可以使阴唇皮肤变得像阴囊一样薄且臃肿,但不能在褶皱中产生可触知的性腺(即睾丸)。
因此,取决于雄激素过多症的严重程度,女性婴儿可能受到轻度影响,明显模糊不清,或严重病毒感染,看起来像男性。 Andrea Prader设计了以下Prader量表作为描述男性化程度的一种方式。
阶段1的婴儿具有轻度大的阴蒂并且阴道开口尺寸略微减小。这个学位可能会被忽视,或者可以简单地假设在正常变化范围内。
阶段2和3代表逐渐更严重的男性化程度。生殖器明显异常,眼中间有阴茎,阴道口较小。
第4阶段看起来比男性更像男性,阴囊空白,阴茎大小与正常阴茎大小相当,但是会阴部的自由度不足以被拉到腹部朝向脐部(即,男性中称为chordee) )。在基部或阴茎轴上的单个小尿道/阴道口将被认为是男性的尿道下裂。染料注入该开口后拍摄的X射线显示出与上阴道和子宫的内部连接。这种常见的开口易导致尿路梗阻和感染。
阶段5表示完全男性男性化,具有通常形成的阴茎,在尖端处或附近具有尿道口。阴囊通常形成但是空的。内部盆腔器官包括正常的卵巢和子宫,阴道内部与尿道相连,如第4阶段所示。这些婴儿不明显模糊,通常被认为是睾丸未降的普通男孩。在大多数情况下,直到一周后出现盐萎缩的迹象,才会怀疑CAH的诊断。
当生殖器在出生时被确定为模棱两可时,CAH是一种主要的诊断可能性。评估显示存在子宫,17OHP极度升高,睾酮水平接近或超过男性范围但低AMH水平。核型是普通女性的核型:46,XX。有了这些信息,就可以很容易地诊断出CAH并确认女性。
其他地方详细描述了模棱两可的生殖器的评估。在大多数情况下,可以在出生后12-36小时内确认并指定女性。例外的是罕见的,完全病毒化的遗传女性(Prader阶段5),他们提出了最具挑战性的任务和手术困境,如下所述。
当模糊程度明显时,通常会提供并执行矫正手术。由于婴儿生殖器的重建手术已成为争议的焦点,因此下面将更详细地描述这些问题。
性别分配问题和争议
对于大多数患有CAH的婴儿来说,分配适当的性别没有困难。遗传男性有正常的男性生殖器和性腺,只需要激素替代。即使他们的生殖器模糊不清或看起来比男性更多,男性大多数女性被分配和成长为女孩。他们有正常的卵巢和子宫和潜在的生育能力与激素替代和手术。然而,围绕性别分配最严重的XX型婴儿的困境有助于塑造我们对性别认同和性取向的理解,并继续成为争论的主题。
直到20世纪50年代,一些有病毒的XX婴儿被分配和抚养成女孩,有些作为男孩。大多数发达的性别认同与其养育性别一致。在一些男性饲养的情况下,在新发现的核型分析显示“女性”染色体时,在儿童中期尝试进行性别重新分配。这些重新分配很少成功,导致John Money和其他有影响力的心理学家和医生得出结论:性别认同(1)与染色体无关,(2)主要是社会学习的结果,(3)在婴儿期后不易改变。
到了20世纪60年代,CAH被很好地理解,核型分析是常规的,标准管理是根据他们的性腺和核型分配和培养所有患有CAH的儿童,无论其有多么男性化。明显有病毒的女孩通常被转诊给儿科外科医生,通常是儿科泌尿科医生进行重建阴道成形术和阴蒂减少或衰退手术,以创建或扩大阴道口并减少阴蒂的大小或突出。这种方法旨在保持两性的生育能力,并且仍然是标准管理,但这种管理的两个方面受到挑战:完全病毒化的遗传女性的分配以及矫正手术的价值和年龄。
关于任务的第一个问题是在20世纪80年代早期提出的,当时Money和其他人报告说,在患有CAH的成年女性中实现正常的成人性关系(即异性恋取向,婚姻和子女)的意外率很高(尽管都有女性性别)身份)。然而,样本很小,结果似乎可以通过多种方式解释:选择偏倚,早期激素对方向的影响,或由残余身体异常或生殖器手术本身造成的性功能障碍。从二十年后的观点来看,该报告是标准管理范式并非始终产生希望结果的第一批证据之一。
尽管存在这些问题,但直到20世纪90年代中期才出现了对标准管理的重大反对,当时来自多个来源的证据和意见的汇合导致了对结果的重新审视。几个双性人支持和倡导团体(例如,北美洲际社会)开始公开批评婴儿生殖器手术,这是基于一些作为婴儿手术的成年人的不满意结果。他们的抱怨是,他们的性关系能力下降,或者他们憎恨没有选择性别分配或手术重建,直到他们年龄足够大。 (参见双性人手术的历史。)
1997年,Reiner,Diamond和Sigmundson的有影响力的文章主张考虑(1)明确男性XX婴儿的男性性别分配(大多数人被认为是男性,直到CAH在1-2周龄时被认可),以及( 2)推迟重建手术,直到患者年龄足以参与决策。 (有关此辩论的更多信息,请参阅模糊生殖器和Intersex以及完整引用。)
虽然标准管理方法仍然是“标准”,但在许多情况下,更多的时间和考虑是为了解释父母的替代方案,并且少数具有明确男性外生殖器的XX儿童再次成为男孩。
儿童期(简单男性化)CAH
导致一些残留的21-羟化酶活性的突变导致较轻的疾病,传统上称为简单的男性化CAH(SVCAH)。在这些儿童中,盐皮质激素缺乏不太明显,并且不会发生盐萎缩。然而,生殖器歧义是可能的。
迟发(非经典)CAH
雄激素过量是足够温和的,在出生时和儿童早期,男性化不明显或未被认识到。然而,雄激素水平高于正常水平并在儿童时期缓慢上升,在2至9岁之间产生明显的影响。
儿童中期阴毛的出现是导致评估和诊断的最常见特征。其他伴随特征可能是身材高大和骨龄加快(通常提前3 - 5年)。经常出现的是肌肉量增加,痤疮和成人体臭。在男孩中,阴茎会被扩大。女孩可能会出现轻微的阴蒂增大,有时会发现一定程度的产前男性化,这可能在婴儿时期未被注意到。
治疗非经典CAH的主要目标是尽可能保持增长,并防止中枢性性早熟(如果尚未触发)。这些挑战比在婴儿期检测到的CAH更困难,因为中等水平的雄激素将有几年的时间来促进骨骼成熟并在检测到疾病之前触发中枢性青春期。
通常通过发现17α-羟孕酮的极端升高以及中等高的睾酮水平来诊断非经典CAH。在轻度病例中可能需要进行cosyntropin刺激试验,但通常17OHP的随机水平足够高以确认诊断。
治疗的主要方法是通过糖皮质激素如氢化可的松抑制肾上腺睾酮的产生。仅在血浆肾素活性高的情况下添加盐皮质激素。
管理的第三个关键方面是抑制中枢性性早熟,如果它已经开始的话。男孩青春期中心的常见线索是,睾丸的大小是青春期的,或者即使17OHP已经恢复正常,睾丸激素仍然会升高。在女孩中,青春期中心不太常出现问题,但乳房发育将成为主要线索。适当时,亮丙瑞林可抑制中枢性性早熟。
如上所述,最近增加的用于保持生长的治疗包括芳香酶抑制以通过减少转化为雌二醇的睾酮的量来减缓骨骼成熟,以及使用雌激素阻断剂用于相同目的。
一旦实现肾上腺抑制,患者需要如上所述的重大疾病或损伤的应激类固醇覆盖。
其他等位基因导致甚至更温和的雄激素过多症,甚至可能不会引起男性问题,并且可能直到青春期或女性晚期才被识别。年轻女性的轻度雄激素效应可能包括多毛症,痤疮或无排卵(这反过来会导致不孕)。这些女性的睾丸激素水平可能略有升高,或略高于平均水平。当然,这些临床特征是多囊卵巢综合征,一小部分患有多囊卵巢综合征(PCOS)的女性在研究时被发现具有迟发性CAH。
可能从高17α-羟孕酮水平怀疑迟发性CAH的诊断,但是有些病例非常轻微,以至于仅在cosyntropin刺激后才能证实升高。治疗可以包括非常低剂量的糖皮质激素的组合以减少肾上腺雄激素的产生,以及任何阻断雄激素作用和/或诱导排卵的各种药剂。
它于1979年由Maria New博士描述。[4]在某些人群中,患病率被描述为百分之一。[5]
新生儿筛查
证明新生儿筛查任何疾病的条件包括(1)具有可接受的敏感性和特异性的简单检验,(2)如果不及早诊断则是可怕的后果,(3)如果确诊则进行有效治疗,以及(4)人群中的频率高到足以证明费用的合理性。在过去的十年中,由于21-羟化酶缺乏症,更多的州和国家正在采用新生儿筛查消耗盐的CAH,如果不被认可则会导致生命第一个月死亡。
如果不治疗,CAH的盐萎缩形式的发病率为15,000分之一,并且在一个月内可能致命。类固醇替代是一种简单有效的治疗方法。然而,筛选测试本身并不完美。虽然17α-羟孕酮水平易于测量和敏感(很少缺少实际病例),但该检测具有较差的特异性。美国的筛查计划报告说,99%的阳性筛查在调查婴儿时证明是误报。与许多其他先天性代谢疾病的筛查试验相比,这是一个更高的误报率。
当检测到阳性结果时,必须将婴儿转诊给儿科内分泌专家以确认或反驳诊断。由于大多数患有盐萎缩性CAH的婴儿在2周龄时患上了重症,尽管假阳性率很高,但必须迅速进行评估。
17α-羟孕酮,雄烯二酮和皮质醇的水平可能在筛查中发挥作用。[6]
产前诊断和治疗
由于CAH是一种常染色体隐性遗传疾病,因此大多数患有CAH的儿童出生于父母,​​他们不知道风险且没有家族病史。每个孩子有25%的机会出生时患有这种疾病。家庭通常希望最小化女孩的男孩化程度。 CAH对男性胎儿没有已知的产前伤害,因此治疗可以在出生时开始。
患有CAH的女性胎儿的肾上腺在妊娠第9周开始产生过量的睾酮。男性化(泌尿生殖器闭合和阴茎尿道)最重要的方面发生在8到12周之间。从理论上讲,如果足够的糖皮质激素可以提供给胎儿,以便在第9周减少肾上腺睾酮的产生,可以预防男性化,并避免关于手术时机的困难决定。
预防女孩严重男性化的挑战有两个:在怀孕初期检测CAH,并向胎儿输送有效量的糖皮质激素而不会对母亲造成伤害。
第一个问题尚未完全解决,但已经表明,如果孕妇服用地塞米松,足以穿过胎盘以抑制胎儿肾上腺功能。
目前,没有计划筛查尚未生育CAH的家庭的风险。对于希望避免第二胎儿男孩化的家庭,目前的策略是在确认怀孕后立即开始使用地塞米松,即使此时怀孕是CAH女孩的可能性仅为12.5%。每天由母亲服用地塞米松,直到可以安全地确定她是否携带受影响的女孩。
胎儿是否是受影响的女孩可以通过妊娠9-11周的绒毛膜绒毛取样或妊娠15-18周的羊膜穿刺术来确定。在每种情况下,可以快速确定胎儿性别,如果胎儿是男性,则可以停用地塞米松。如果对雌性胎儿DNA进行分析,以确定她是否携带CYP21基因的已知异常等位基因之一。如果是这样的话,地塞米松在怀孕的剩余时间内以每天约1mg的剂量持续。
大多数遵循这种治疗计划的母亲至少经历过糖皮质激素的轻度cushing效应,但生育的女儿生殖器的病毒化程度要低得多。
CAH的长期管理
CAH婴儿和儿童的管理很复杂,需要在儿科内分泌诊所进行长期护理。确认诊断后,任何避免盐分的危机都会避免或逆转,主要的管理问题包括:
启动和监测激素替代
压力覆盖,危机预防,父母教育
重建手术
优化增长
优化CAH女性的雄激素抑制和生育能力
激素替代
激素替代的主要目标是防止肾上腺皮质功能不全并抑制过多的肾上腺雄激素生成。
向所有儿童和成人提供糖皮质激素,除了最温和和最新发病形式的CAH之外的所有儿童和成人。糖皮质激素为皮质醇提供了可靠的替代品,从而降低了ACTH水平。减少ACTH还可以减少持续增生和雄激素过量产生的刺激。换句话说,糖皮质激素替代是减少两性中过度肾上腺雄激素生成的主要方法。许多糖皮质激素可用于治疗用途。氢化可的松或液体泼尼松龙在婴儿期和儿童期是优选的,泼尼松或地塞米松通常对成人更方便。
糖皮质激素剂量通常在生理替代的低端开始(6-12mg / m 2),但在整个儿童时期进行调整,以防止过多的糖皮质激素和雄激素从太少中逃逸而抑制生长。随后获得17α-羟孕酮,睾酮,雄烯二酮和其他肾上腺类固醇的血清水平以获得额外信息,但即使采用最佳治疗也可能无法完全归一化。 (有关此主题的更多信息,请参阅糖皮质激素。)
所有患有盐萎缩的婴儿和大多数肾素水平升高的患者都会使用盐皮质激素替代。氟氢可的松是唯一可药用的盐皮质激素,通常以每日0.05至2毫克的剂量使用。遵循电解质,肾素和血压水平以优化剂量。
压力覆盖,危机预防,父母教育
即使在诊断和开始治疗后,一小部分患有婴儿期或儿童期CAH的儿童和成人死于肾上腺危象。如果孩子和家人明白每天的糖皮质激素不能被疾病打断,那么死亡是完全可以避免的。当一个人身体状况良好时,错过剂量,甚至几剂,可能几乎不会产生即时症状。然而,在疾病和压力期间糖皮质激素需求增加,并且在诸如“流感”(或病毒性胃肠炎)的疾病期间错过剂量可在数小时内导致血压降低,休克和死亡。
为了防止这种情况,所有服用替代糖皮质激素的人都被教导在疾病,手术,严重受伤或严重疲劳的情况下增加剂量。更重要的是,他们被告知呕吐需要在氢化可的松(例如SoluCortef)或其他糖皮质激素的数小时内注射。该建议适用于儿童和成人。由于幼儿比成人更容易呕吐,因此儿科内分泌科医生通常会教父母如何给予氢化可的松注射。
作为额外的预防措施,建议患有肾上腺皮质功能不全的人佩戴医疗识别标签或携带钱包卡,以提醒那些可能正在提供紧急医疗护理的人,因为他们需要糖皮质激素。
重建手术
对于遗传性男性(XY)婴儿,不需要考虑手术,因为多余的雄激素不会产生解剖学异常。然而,经常进行严重病毒性XX婴儿的手术,并且在过去十年中已成为争论的主题。
自20世纪上半叶以来,已经为患有CAH的严重男性化女孩的父母提供了异常生殖器的外科重建。手术的目的通常是以下的组合:
使外生殖器看起来更像女性而不是男性
使这些女孩在长大后能够参加正常的性生活
提高他们的生育机会
减少尿路感染的频率
在20世纪50年代和60年代,手术通常涉及阴蒂切除术(去除大部分阴蒂),这种手术也减少了生殖器感觉。在20世纪70年代,开发了新的手术方法以保持神经支配和阴蒂功能。然而,过去十年的一些回顾性调查表明:(1)即使在保留神经的程序后,许多女性的性享受也会减少;(2)未接受过手术的CAH女性也有大量的性功能障碍。 (参见Intersex外科手术,了解手术和潜在并发症的概述,以及更充分讨论争议的双性人手术史。)许多患者倡导者和外科医生主张将手术推迟到青春期或以后,而一些外科医生继续认为婴儿手术有优势。
优化CAH的增长
长期管理的一个具有挑战性的方面是优化增长,以便患有CAH的孩子达到他或她的身高潜能,因为治疗不足和过度治疗都可以减少增长或剩余的增长时间。虽然糖皮质激素对健康至关重要,但剂量总是近似的问题。即使是轻度过量的糖皮质激素也会减缓生长。另一方面,肾上腺雄激素很容易转化为雌二醇,这会加速骨骼成熟并导致早期骨骺闭合。通过2或3次口服剂量的氢化可的松产生的正常昼夜血浆皮质醇水平的不完全复制,使得这种最佳剂量的窄目标更难以获得。因此,传统管理层报告的平均高度损失约为4英寸(10厘米)。
传统上,儿科内分泌学家试图通过每隔几个月测量一个孩子以评估当前的生长速度来优化生长,通过每年或每两年检查一次骨龄,定期测量17OHP和睾酮水平作为肾上腺抑制的指标,并使用氢化可的松用于糖皮质激素替代而不是长效泼尼松或地塞米松。
CAH的简单男性化形式中的生长问题甚至更严重,这在早期阴毛出现在儿童期时被检测到,因为骨龄在诊断时通常提前几年。虽然一个男孩(或女孩)拥有简单的男性化CAH比同龄人更高,但他的成长时间要少得多,而且可能从一个非常高的7岁到62岁的13岁 - 已完成增长的人。即使有肾上腺抑制,这些儿童中的许多人已经因下丘脑长期暴露于肾上腺雄激素和雌激素而引发中枢性性早熟。如果已经开始,用促性腺激素释放激素激动剂如亮丙瑞林抑制青春期可能是有利的,以减缓持续的骨骼成熟。
近年来,一些优化生长的新方法已经研究并开始被使用。通过用抗雄激素如氟他胺阻断受体并通过减少睾酮向雌二醇的转化,可以减少雄激素对身体的影响。该转化由芳香酶介导,并可被芳香酶阻断剂如睾酮内酯抑制。阻断雌激素的作用和转化将允许使用较低剂量的糖皮质激素,同时加速骨成熟的风险较小。其他提议的干预措施包括双侧肾上腺切除术以去除雄激素来源,或生长激素治疗以促进生长。
有关优化生长困难的更广泛的综述,请参见Migeon CJ,Wisneiewski AB。由于21-羟化酶缺乏导致的先天性肾上腺增生:生长,发育和治疗方面的考虑。 Endocrinol Metab Clin N Am 30:193-206,2001。[7]
预防高雄激素血症和优化生育能力
随着增长的结束,CAH女孩的管理变化将重点放在优化生殖功能上。来自肾上腺的过量睾酮和过量的糖皮质激素治疗都会破坏排卵,导致月经不调或闭经,以及不孕。持续监测激素平衡和仔细调整糖皮质激素剂量通常可以恢复生育能力,但作为一个群体,患有CAH的妇女的生育率低于同等人群。
CAH对男性生育能力几乎没有影响,除非成年人长时间停止服用糖皮质激素药物,在这种情况下过量的肾上腺睾酮可能会减少睾丸产生以及精子发生。
心理性的发展和问题
几乎所有哺乳动物都表现出性别 - 二态性生殖和性行为(例如,脊柱前凸和在啮齿动物中的安装)。许多研究已经清楚地表明,产前和早期出生后的雄激素在大多数哺乳动物大脑的分化中起作用。子宫内或出生后不久的雄激素水平的实验操作可改变成人的生殖行为。
患有CAH的女孩和妇女构成大多数具有正常内生殖激素的遗传女性,她们在整个产前生活中都接触过雄性睾酮水平。由于目前用于CAH的糖皮质激素治疗的不完善,在整个儿童期和青春期持续较长程度的持续雄激素暴露。这些女孩和女人的性心理发展已被分析为雄激素在人类性别 - 二态行为中的作用的证据。
据报道,患有CAH的女孩多次被报道花费更多时间玩“性别非典型”玩具和“粗暴”玩耍而不是未受影响的姐妹。正如社会行为,休闲活动和职业兴趣所表达的那样,这些差异一直持续到青少年。大多数措施都显示出对婴儿和成为母亲的兴趣显著降低。
认知效果不太清楚,报告也是矛盾的。两项研究报告说,姐妹和女孩的空间能力一般高于平均水平。有雄激素缺乏和无雄激素缺乏的男性的其他证据表明,雄激素可能在这些能力中发挥作用。
但是,女孩和患有CAH的妇女的性别认同最常见于女性。虽然大多数是异性恋,但性取向更为复杂。在一项研究中,27%的CAH女性在其方向上被评为双性恋。
发生率
在儿童时期可检测到的21-羟化酶缺陷型CAH的发生率约为15,000个新生儿中的1个。严重的盐浪费形式占这些病例的大部分,足够高,许多州和国家通常将其纳入强制性新生儿筛查试验中。简单男性化CAH的发病率约为60,000名儿童中的1名。
睾丸肾上腺静息肿瘤
在患有先天性肾上腺增生(CAH)的成年男性中观察到的不孕症与可能源于儿童时期的睾丸肾上腺静息肿瘤(TART)有关。 在儿童时期(20%)可以发现具有经典CAH的青春期前男性的TART。 Martinez-Aguayo等。 报告了一组患者的性腺功能标志物的差异,特别是那些控制不足的患者。[8]
另见
Inborn errors of steroid metabolism
Congenital adrenal hyperplasia
Adrenal insufficiency
Disorders of sexual development
Intersexuality, pseudohermaphroditism, and ambiguous genitalia
21-Hydroxylase
参考
White PC, Speiser PW (June 2000). "Congenital adrenal hyperplasia due to 21-hydroxylase deficiency". Endocr. Rev. 21 (3): 245–91. doi:10.1210/er.21.3.245. PMID 10857554.
Forest MG, Tardy V, Nicolino M, David M, Morel Y (June 2005). "21-Hydroxylase deficiency: an exemplary model of the contribution of molecular biology in the understanding and management of the disease". Ann. Endocrinol. Paris. 66 (3): 225–32. doi:10.1016/s0003-4266(05)81754-8. PMID 15988383.
Trakakis E, Loghis C, Kassanos D (March 2009). "Congenital adrenal hyperplasia because of 21-hydroxylase deficiency. A genetic disorder of interest to obstetricians and gynecologists". Obstet Gynecol Surv. 64 (3): 177–89. doi:10.1097/OGX.0b013e318193301b. PMID 19228439.
New MI (December 2004). "An update of congenital adrenal hyperplasia". Ann. N. Y. Acad. Sci. 1038: 14–43. doi:10.1196/annals.1315.009. PMID 15838095.
New MI (November 2006). "Extensive clinical experience: nonclassical 21-hydroxylase deficiency". J. Clin. Endocrinol. Metab. 91 (11): 4205–14. doi:10.1210/jc.2006-1645. PMID 16912124.
Schwarz E, Liu A, Randall H, et al. (April 2009). "Use of Steroid Profiling by UPLC-MS/MS as a Second Tier Test in Newborn Screening for Congenital Adrenal Hyperplasia: the Utah experience". Pediatr. Res. 66 (2): 230–5. doi:10.1203/PDR.0b013e3181aa3777. PMID 19390483.
Migeon CJ, Wisniewski AB (March 2001). "Congenital adrenal hyperplasia owing to 21-hydroxylase deficiency. Growth, development, and therapeutic considerations". Endocrinol. Metab. Clin. North Am. 30 (1): 193–206. doi:10.1016/S0889-8529(08)70026-4. PMID 11344936.
Martinez-Aguayo, A; Rocha, A; Rojas, N; García, C; Parra, R; Lagos, M; Valdivia, L; Poggi, H; et al. (2007). "Testicular adrenal rest tumors and Leydig and Sertoli cell function in boys with classical congenital adrenal hyperplasia". The Journal of Clinical Endocrinology and Metabolism. 92 (12): 4583–9. doi:10.1210/jc.2007-0383. PMID 17895312. |