概要
1. 供给人喉的动脉是喉上动脉,甲状腺上动脉的甲状腺分支和喉下动脉。
 2.主要的喉动脉介于喉内固有的肌肉和甲状软骨之间以及声门腔内。该结构不会中断血管的流动。
 3.血管结构在声带边缘是独特的,其中仅存在小血管,包括小动脉,小静脉和毛细血管。毛细血管分布在固有层(Reinke's space)的浅层。
 4.血管从膜状声带的前端或后端进入声带边缘,并且基本平行于声带边缘延伸。
 5.具有振动能力的人类声带的血管结构需要适合于振动的特定结构,并且这些结构使声带组织的缺氧最小化。
 6.血管结构及其通透性与人声带粘膜的特定疾病有关。
 
21.1简介
21.2 喉的血液供应
人类声带是振动组织。在发声过程中振动最大的声带部分是声带粘膜的固有层(Reinke's space)的浅层。具有振动能力的器官的血管结构需要适合于振动的特定结构,并且这种结构使组织的缺氧最小化。
从病理学角度来看,血管结构及其通透性与人声带粘膜的特定疾病有关。
 
供应人喉的动脉是喉上动脉,甲状腺上动脉的环甲分支和喉下动脉(图21.1)。 前两条动脉通常由甲状腺上动脉分枝,后者由甲状腺下动脉分枝。
上喉动脉通过甲状舌骨膜的外侧部分进入喉部。 甲状腺上动脉的环甲膜分支通过环甲韧带的外侧部分进入喉部。 喉下动脉向后进入喉部。
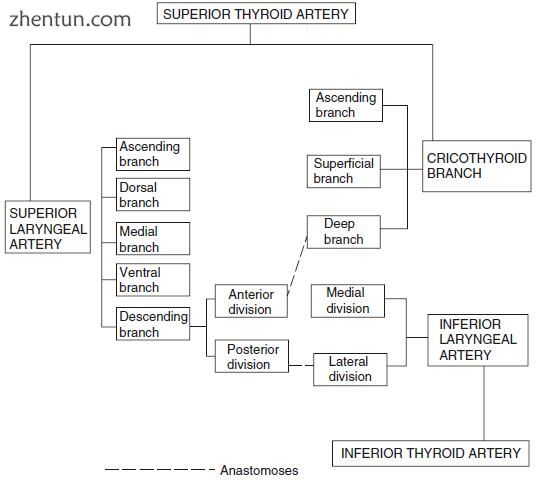
图. 21.1 喉的动脉(改良自Pearson,1975)
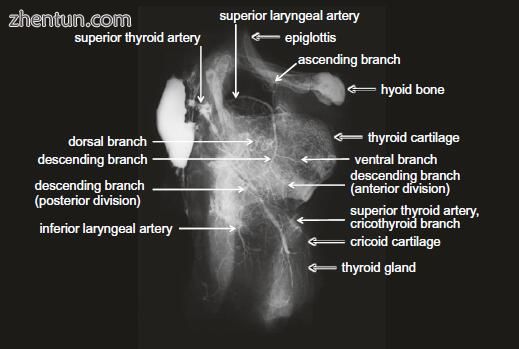
图. 21.2 右选择性上甲状腺血管造影(侧视图)
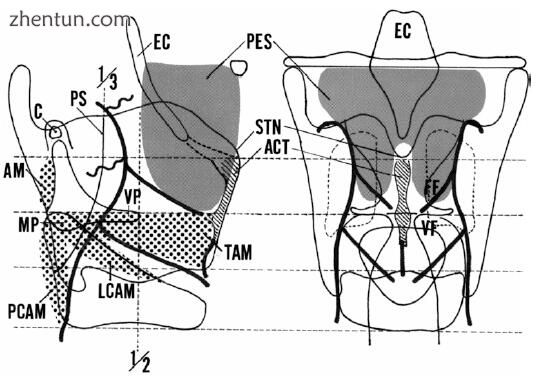
图. 21.3 人喉部动脉的模式。 PES前脑空间,EC会厌软骨,STN甲状腺上段缺损,ACT前连合肌腱,杓状软骨VP声带过程,杓状软骨MP肌肉过程,VF声带,FF假声带(室襞),TAM甲状腺肌肉,LCAM侧环杓肌,PCAM后环杓肌,AM杓状肌,PS咽状窦,C系膜软骨
这三条动脉相互直接吻合(图21.1和21.2)。
人体喉部的动脉和空间之间存在关系。前胸腔空间位于甲状腱韧带和会厌软骨的前侧和下侧,并且声门下空间位于甲状腺椎板的内侧表面上(图21.3)。主要的喉动脉在声学空间的内在喉部肌肉和甲状软骨之间运行(图21.4)。
在声门上层,喉上动脉的下行分支位于声门空间的后部(图21.4a)。从下行分支出来的腹侧分支放置在声门空间的前部(图21.4a)。在声门水平,喉上动脉的下行分支分为前分裂和后分裂,均位于声门空间(图21.4a)。喉上动脉下行支的前分支与声门上腔前部甲状腺上动脉的环甲分支吻合。喉上动脉下行支的后分支与声门后空间后部的喉下动脉吻合。
21.3喉部血液供应的生理意义
主要的喉动脉在内在的喉部肌肉和甲状软骨之间以及在声门空间中运动。 该结构不会中断血管的流动。
21.4人类声带的血管网络
血管的结构在声带边缘是独特的,其中仅存在小血管,包括小动脉,小静脉和毛细血管。 毛细血管分布在声带粘膜的层板原状(Reinke's空间)的表层。 小动脉和小静脉分布在声带粘膜的固有层(声带韧带)的中间和深层。
血管从膜性声带的前端或后端进入声带边缘并且基本上平行于声带边缘延伸(图21.5,21.6,21.7,21.8)。 远离声带的边缘,血管增加
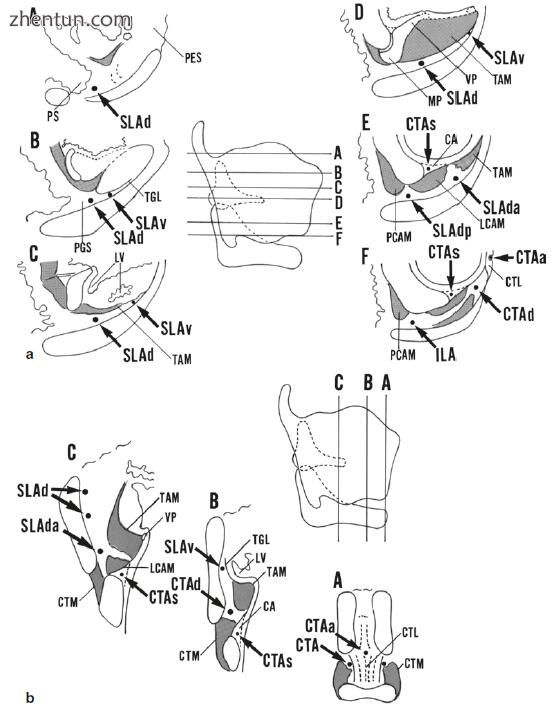
图. 21.4 人喉部动脉的模式。 (a)横截面; (b)冠状切面。喉上动脉SLAd下行分支,喉上动脉SLAv腹分支,喉上动脉SLAda下行分支(前分裂),喉上动脉SLAdp下行分支(后分裂),ILA下喉动脉,CTA甲状腺上分支甲状腺动脉,甲状腺上动脉环甲分支CTAa上行支气管,甲状腺上动脉甲状腺分支CTAds分支,甲状腺上动脉甲状腺分支甲状腺分支,PS下咽,TGL甲状腺韧带,LV喉室,CA环状区,CTL环甲状腺韧带,CTM环甲肌,PES前息肉间隙,PGS声门上空间,TAM甲状腺肌,LCAM外环杓肌,PCAM后环杓肌,杓状软骨VP声带过程,杓状软骨的MP肌肉过程,以及大血管在上级向各个方向奔跑并推断声带的一部分(图21.5和21.6)。声带边缘周围的粘膜固有层中的血管与声带的上表面和下表面中的血管清楚地分开并且不与它们形成网络。
在声带的肌肉层中,血管从声带的深部进入(图21.9)。声带周围粘膜固有层中的血管与声带肌中的血管清楚地分开,并且不与声带肌中的血管相互作用(图21.8和21.9)。
在声带的中点,特别是在声带的下表面,存在网状血管网。偶尔观察到小动脉和小静脉之间的直接吻合。
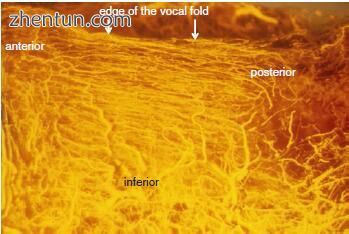
图. 21.5 人类声带的内侧方面(硅橡胶化合物注射和清除技术)(图片由久留米大学耳鼻喉科 - 头颈外科的Shigejiro Kurita博士提供)。 在声带边缘周围,血管很小并且大致平行于边缘。 声带边缘周围的血管来自膜性声带的前端和后端。 大型血管在声带的下部沿各个方向运行
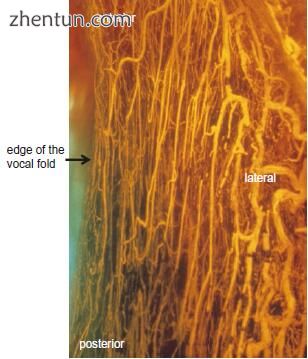
图. 21.6 人类声带的上部(硅橡胶复合注射和清除技术)(照片由久留米大学耳鼻喉科 - 头颈外科的Shigejiro Kurita博士提供)。 在声带边缘周围,血管很小并且大致平行于边缘。 声带边缘周围的血管来自膜性声带的前端和后端。 在声带的外侧部分有各种方向的大型血管
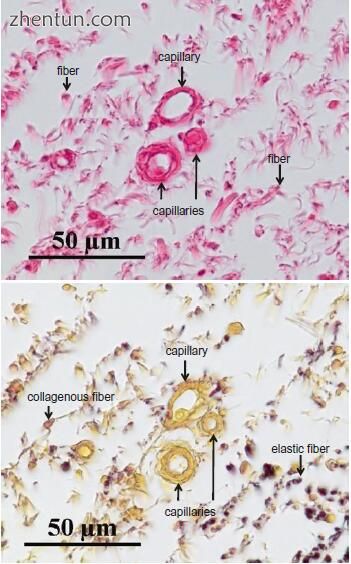
图. 21.7 人类声带固有层(Reinke's space)浅层的冠状切面。 声带固有层(Reinke's space)表层的毛细血管呈圆形或椭圆形,表明它们大致平行于声带边缘。 (a)苏木精和伊红染色; (b)Elastica van Gieson染色剂
21.5人声带粘膜中血管的微观结构
只有小血管,包括小动脉(图21.10和21.11),毛细血管(图21.12和21.13)和小静脉(图21.14),在声带边缘的粘膜中,大致平行于声带边缘。 声带粘膜固有层(Reinke's空间)表层的主要血管是毛细血管。
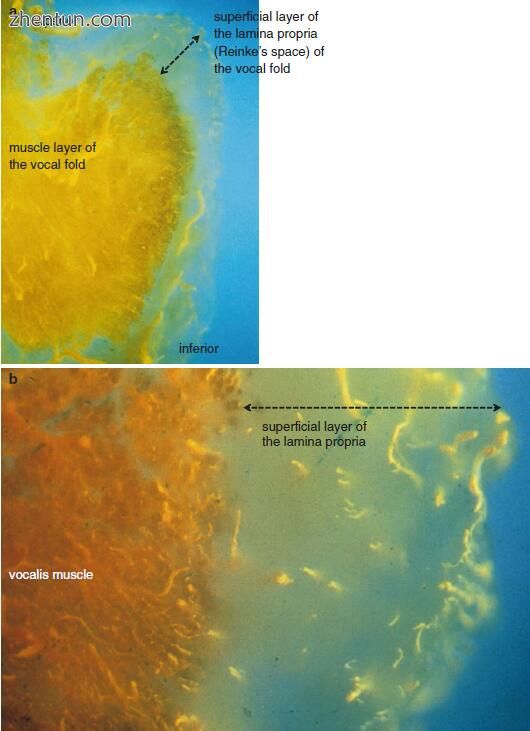
图. 21.8 人类声带的冠状部分(硅橡胶复合注射和清除技术)(图片由久留米大学耳鼻喉科 - 头颈外科的Shigejiro Kurita博士提供)。声带固有层(Reinke's space)表层的血管非常小(a).它们中的大多数是圆形,椭圆形或棒状,表明它们大致平行于声带边缘(b).声带边缘附近的粘膜中的血管与声带肌中的血管明显分开(a,b)
21.5.1小动脉
通常,小动脉的直径范围从300μm到小于50μm;然而,声带粘膜中的小动脉相对较薄(图21.10)。平滑肌细胞完全包围血管(图21.10)。
末端小动脉通过一个短的过渡区域,其中散在的血管周围存在分散的平滑肌细胞(图21.11)。动脉毛细血管,从小动脉到毛细血管的过渡区域,在平滑肌细胞和周细胞之间呈中间形式(图21.11)。然后血管继续作为毛细血管。
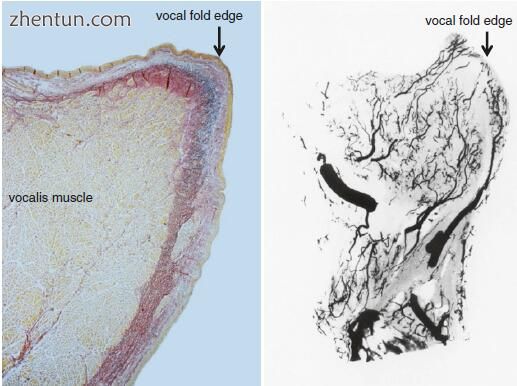
图. 21.9 人类声带中点的冠状切面(Elastica van Gieson染色和Softex接触微血管造影)(照片,Softex接触微血管造影,由Shigejiro Kurita博士提供,来自久留米大学耳鼻喉科 - 头颈外科)。 声带边缘附近的粘膜中的血管与声带上下表面粘膜以及声带肌中的粘膜明显分开。

图. 21.10 声带粘膜中小动脉的扫描电子显微镜照片(改良氢氧化钠(NaOH)浸渍法)
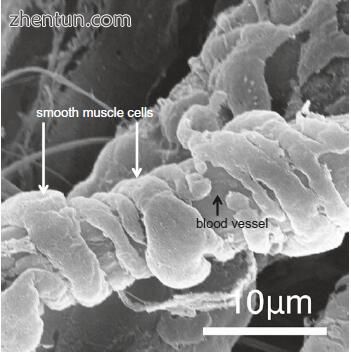
图. 21.11 从小动脉到毛细血管(动脉毛细血管)过渡区的扫描电子显微照片(改良NaOH浸渍法)

图. 21.12 人声带粘膜中毛细血管的扫描电子显微镜照片(改良NaOH浸渍法)
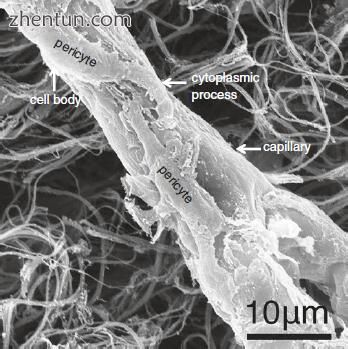
图. 21.13 人声带粘膜中毛细血管和周细胞的扫描电子显微镜照片(改良NaOH浸渍法)

图. 21.14 从毛细血管到小静脉(静脉毛细血管)的过渡区域的扫描电子显微照片(改良的NaOH浸渍法)
21.5.2小静脉
几个毛细血管结合并形成小静脉,其是直径为15-20μm的圆柱形血管。
末端毛细血管通过一个短的过渡区域,在该过渡区域中,分散的平滑肌细胞开始出现在血管周围(图21.14)。静脉毛细血管,从毛细血管到小静脉的过渡区域,在周细胞和平滑肌细胞之间呈中间形式(图21.14)。然后血管继续作为小静脉。
21.5.3毛细血管
毛细血管壁由一层内皮细胞​​,基底层和网状纤维的稀疏网络组成(图21.15)。人声带粘膜中毛细血管的直径平均为约8-12μm,这允许血液的细胞成分无阻碍地通过。内皮的腔表面通常是光滑的,但是相邻细胞的薄边缘略微重叠,并且薄的边缘折叠突出到腔内的短距离(图21.15c)。毛细血管的一些内皮细胞被圆形开窗或孔直接中断,直径为60-70nm,每个孔由非常薄的孔隔膜封闭。
在人声带粘膜中的毛细血管周围可以看到许多周细胞(图21.12,21.13和21.15)。每个周细胞具有细胞体和分支细胞质过程(图21.13)。细胞体呈凸出的梭形或多边形。分枝细胞质过程包括短周期过程和长且相对厚的纵向过程,其平行于容器的轴线。周细胞为5-10μm×15-30μm,细胞体尺寸为5-10μm×10-15μm。周细胞的细胞体附着在毛细血管内皮细胞上(图21.16),分支过程附着在尖端的毛细血管内皮细胞上(图21.16b)并包围毛细血管(图21.15b)。周细胞的过程在外观上呈指状或爪状,并且就像细胞体一样,似乎抓住了血管。
存在细胞质中的组分,包括粗面内质网,线粒体和游离核糖体。可以看到许多细胞质细丝,不仅在细胞体中,而且在细胞体中也是如此(图21.17)。细丝聚集在一起形成致密体(图21.17)。
与内皮细胞相邻,注意到周细胞过程中细胞质细丝的密集网状结构(图21.18c)。在这些过程的外部,在细胞质中观察到许多胞饮小泡(图21.18c)。细胞体和周细胞的过程包围毛细血管并附着在它们的壁上。周细胞和内皮细胞的细胞体保持分开300-500nm的间隙(图21.15b和21.18a)。周细胞的过程与内皮细胞紧密接触,与它们共用一个共同的基底膜(图21.18c)。这些过程的尖端形成与内皮细胞的细胞间紧密连接(图21.18c)。这些区域对应于图中的扫描电子显微照片(SEM).21.16b。
细胞体和周细胞的过程包围新生儿声带粘膜中的毛细血管(图21.19)。出生时,存在与成人声带粘膜中的声带粘膜中相同的毛细血管微结构。
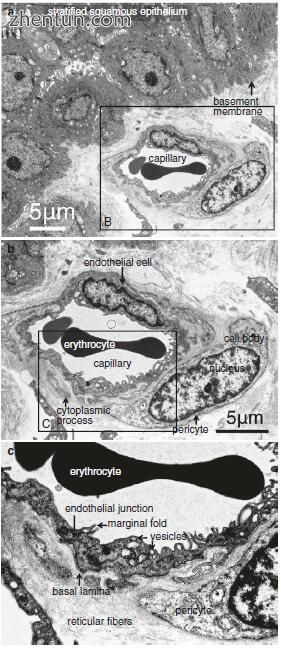
图. 21.15 在人声带(醋酸铀和柠檬酸铅染料)的固有层(Reinke's空间)的表层中的毛细管的透射电子显微截面。 单个内皮细胞在管腔周围延伸,周细胞环绕毛细管(b,区域B在a; c,区域C在b)
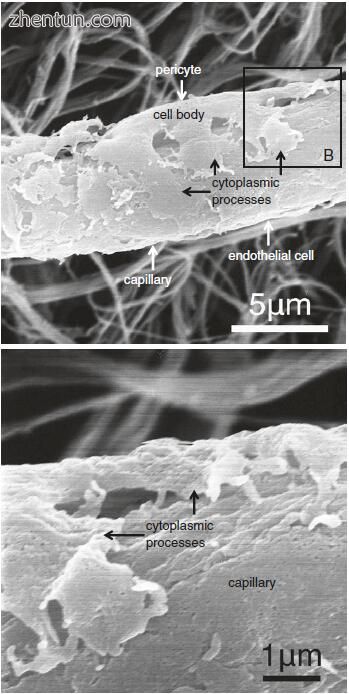
图. 21.16 人声带粘膜毛细血管周围周细胞的扫描电子显微照片(改良NaOH浸渍法)(b:a区域B)
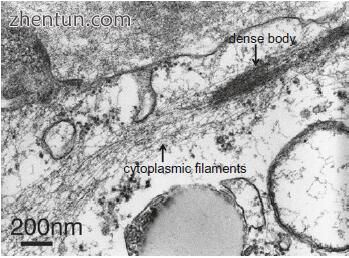
图. 21.17 周细胞(乙酸铀酰和柠檬酸铅染料)细胞质的透射电子显微照片。 许多细胞质细丝聚集在一起形成致密体
21.6人声带粘膜血管网的生理学意义
只有小血管从膜状声带的前端或后端进入声带边缘,并且基本上平行于声带边缘延伸。 并且这些小血管与上下声带粘膜中的血管以及声带肌中的血管明显不同。 声带边缘粘膜中血管网络的结构非常适合于振动。 声带边缘粘膜中血管网的结构也非常适合于防止由声带振动引起的循环障碍。
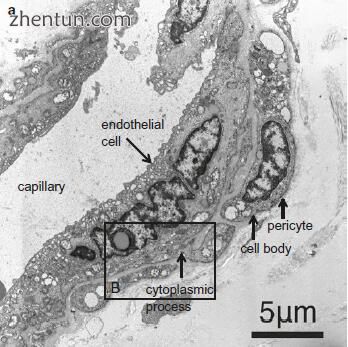
图. 21.18 内皮细胞和周细胞的透射电子显微照片。 (b,a中的区域B; b中的区域C)(乙酸铀酰和柠檬酸铅染色)。周细胞的过程与内皮细胞(a,b)紧密接触,与它们共用一个共同的基底膜,并且这些过程的尖端与内皮细胞形成细胞间紧密连接(c)
在声带粘膜中小动脉和小静脉之间存在直接吻合。当动静脉吻合术收缩时,血液沿着小动脉进入毛细血管网。当它松弛时,血液可以绕过毛细血管并直接进入小静脉。因此,动静脉吻合被认为是用于调节向声带粘膜供血的重要结构。
具有振动能力的人声带粘膜的血管结构具有适合振动的特定结构,并且还使声带组织的缺氧最小化。
小动脉形成循环的重要部分,因为它们构成了调节血压的外周流动阻力的主要成分。血液和组织之间的交换发生在毛细血管中。小静脉还在血液和组织之间的交换中起作用,并且它们在与炎症相关的变化中特别重要。
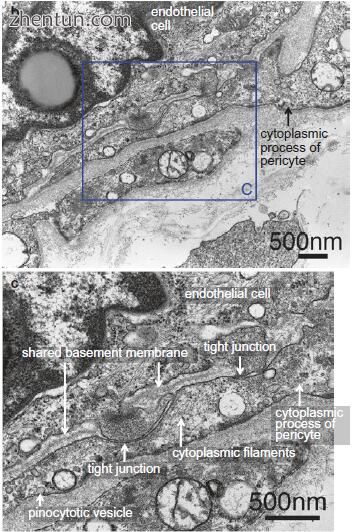
图. 21.18 (续)
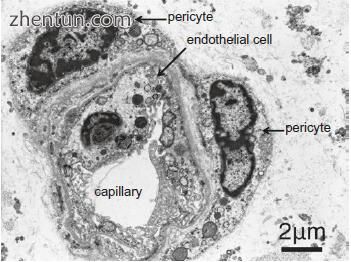
图. 21.19 新生儿声带固有层(乙酸铀酰和柠檬酸铅染料)表面层毛细血管的透射电子显微截面。单个内皮细胞在腔周围延伸,并且出生时周细胞环绕毛细血管
21.7人声带粘膜毛细血管周细胞的生理学意义
Zimmermann使用银色染色的光学显微镜研究毛细血管周细胞[9]。已经对其他器官中的毛细血管周细胞进行了电子显微镜研究。毛细血管周细胞的数量和形状根据器官和组织而不同。毛细血管周细胞的数量与毛细血管床的密度有关。它们的形状和分布与器官功能有关。
周细胞的功能仍不清楚。已经提出了合成,机械支持,保护,检测,分化和毛细血管收缩。先前在周细胞中注意到细胞质细丝,因此它们被认为是调节微血管血流的收缩细胞。周细胞是血管生物学中的关键细胞,尤其是血管生成。它们介入不同水平的血管形成,参与内皮细胞刺激和引导以及内皮稳定和成熟。
先前已经在声带粘膜中的毛细血管周围注意到周细胞。从形态学角度来看,人声带粘膜中的周细胞基本上与其他器官中的周细胞相同。在人声带粘膜中的毛细血管,动脉毛细血管和静脉毛细血管周围可以看到许多周细胞。关于人声带粘膜中周细胞的最值得注意的发现是存在比其他器官更厚的过程。
人声带粘膜中的周细胞包围毛细血管壁。这些过程的尖端与内皮细胞形成紧密的细胞间连接。细胞体和过程似乎抓住血管并支撑和保护毛细血管壁。正是这种厚度与内皮细胞牢固连接,使它们特别适合这种支持和保护。可以看到许多细胞质细丝聚集在一起形成致密体。因此,周细胞为毛细管壁提供了很大的支撑和保护。结果,即使在频繁和强烈的振动期间,人声带粘膜中的血管(即声带的振动部分)也不容易破裂。
在发声期间声带粘膜的血流减少,但此后增加。声带粘膜中的周细胞似乎为毛细血管壁提供机械支撑和保护,特别是在皮肤期间。在发声期间和之后,周细胞似乎也调节毛细管的直径。
人声带粘膜中的周细胞也被认为是血管生物学和血管生成中的关键细胞,尤其是声带组织损伤后的血运重建。
周细胞已经包围了新生儿声带粘膜中的毛细血管。周细胞似乎准备好在出生后提供支持和保护血管。
空间。 Reinke水肿最常见的病因被认为是吸烟和衰老。该疾病的发病和发展的机制仍不清楚。
在用于Reinke水肿的喉内显微外科手术期间,在声带粘膜中可见上皮下血管化(图21.20)。血管不平行于声带的边缘,但是在随机方向上运行并且在严重的情况下尤其明显(图21.20)。 Reinke空间的水肿似乎与这个空间的血管有关。
图中显示了具有Reinke水肿的人声带粘膜固有层(Reinke's空间)浅表层的血管。 21.21。在Reinke的空间中,上皮下血管化很明显。血管扩张至直径20-30μm,但毛细血管直径变化很大。血管壁很薄,内皮细胞的细胞质也很薄(图21.21)。周细胞的细胞质(细胞体和分支细胞质过程)很薄(图21.21)。细胞体和分支
21.8具有Reinke水肿的人声带粘膜中血管的微观结构
Reinke的水肿是声带的常见疾病,最终导致语音质量的变化。 膜性声带的整个长度是水肿和肿胀的(图21.20)。 组织病理学上,主要特征是Reinke's水肿的水肿不附着于血管的内皮细胞(图21.21)。 周细胞的数量减少了。 周细胞远离内皮细胞,与它们共享增厚的基底膜(图21.21)。 周细胞似乎不能充分支撑和保护毛细血管壁,特别是在发声过程中。 因此,受Reinke水肿影响的血管是脆弱的,这种脆弱性很可能影响声带粘膜中的血液循环。
图. 21.20 Reinke水肿的喉内显微镜观察
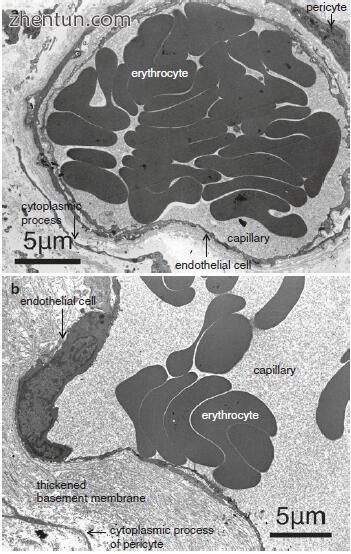
图. 21.21 Reinke的声带褶皱粘膜空间的传输电子显微照片与Reinke的水肿(乙酸铀酰和柠檬酸铅染色)。 血管扩张(a),血管壁薄(b),内皮细胞和周细胞也是如此
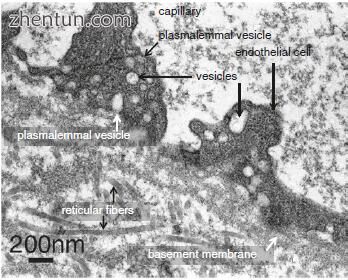
图. 21.22 内皮细胞在Reinke水肿(醋酸铀酰和柠檬酸铅染色)中的囊泡运输。除了从内皮的一个表面到另一个表面的囊泡易位之外,囊泡在细胞的腔外和近腔表面开放(质膜囊泡)
血液和组织之间的交换发生在毛细血管[6]。许多囊泡存在于血管内皮细胞的细胞质中(图21.22)。内皮细胞的一个显着特征是在细胞的两个表面上存在与质膜相关的大量囊泡。内皮细胞具有许多窗孔或孔(图21.23a),并且血浆通过窗孔从毛细血管渗出到周围组织中(图21.23b)。窗孔或孔隙的一个显着特征是它们没有孔隙膜(图21.23b)。这解释了流体更快地横穿毛细血管壁的事实。血管内皮细胞之间存在细胞间隙(图21.24)。在容器周围注意到增厚的基底膜和致密的网状纤维(图21.21和21.22)。因此,随着Reinke水肿,毛细血管通透性似乎增加。
一些血管的内皮细胞和周细胞退化,在某些情况下可见部分或完全血管闭塞(图21.25和21.26)。
图1显示了具有Reinke水肿的声带粘膜固有层(Reinke's空间)表面层中血管内皮生长因子(VEGF)的免疫组织化学结果21.27。固有层浅表层(Reinke's space)中的间质细胞(图21.27a)和/或炎性细胞(图21.27b)显示用VEGF染色细胞质,而在任何组分中均未发现该生长因子的染色。正常声带的椎板原发性骨折
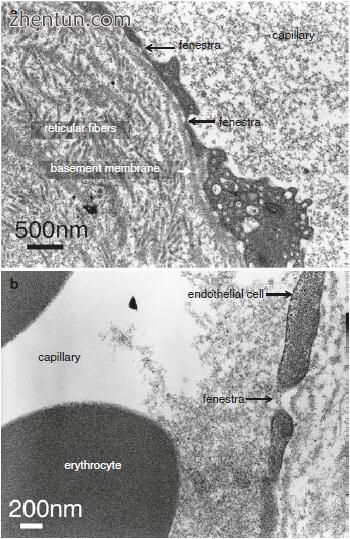
图. 21.23 Reinke's空间中内皮细胞的窗孔与Reinke水肿(乙酸铀酰和柠檬酸铅染色)。 (a)内皮细胞具有许多具有孔隙膜的窗孔或孔。 (b)血浆通过缺少孔隙隔膜的窗孔(毛孔)从毛细血管渗出到周围组织
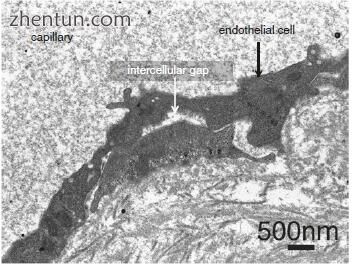
图. 21.24 血管内皮细胞(醋酸铀酰和柠檬酸铅染色)之间的细胞间隙
图. 21.25 退化的内皮细胞和周细胞以及部分血管闭塞(醋酸铀酰和柠檬酸铅染色)
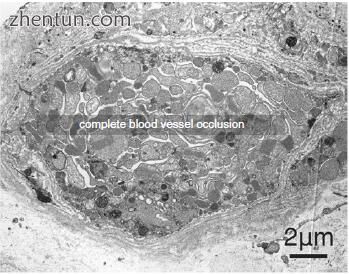
图. 21.26 退化的内皮细胞和周细胞以及完整的血管闭塞(醋酸铀酰和柠檬酸铅染色)
由于其对血管内皮细胞的选择性促有丝分裂刺激和血管通透性的增强,VEGF参与血管生成的控制。 正常声带粘膜的固有层未显示VEGF染色。 在Reinke水肿中观察到上皮下血管化,血管扩张和血管通透性增加。 由Reinke空间中的间质细胞和/或炎性细胞产生的VEGF可能促进血管形成和血管通透性的增加。
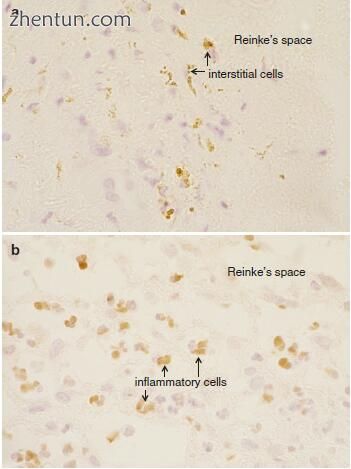
图. 21.27 血管内皮生长因子(VEGF),通过免疫组织化学染色显示(原始×400)。 (a)在Reinke的空间中间质细胞的细胞质中的VEGF染色。 (b)在Reinke的空间中炎性细胞的细胞质中的VEGF染色
Reinke水肿最常见的病因被认为是吸烟和衰老。另一个可能的病因是声音滥用。吸烟导致血液流过血管减少。它会增加血小板聚集并改变血脂和脂蛋白浓度。它还会增加碳氧血红蛋白,从而降低血红蛋白向组织输送氧气的能力。吸烟增强了声带粘膜中血栓形成的可能性。吸烟的这些有害作用导致缺氧和缺血并影响声带粘膜中的血液循环。血管中与年龄相关的变化增加了血栓形成的可能性并减少了通过血管的血流,因此也导致缺氧和缺血。
即使在正常的声带中,在发声过程中声带粘膜的血流也会减少。脆弱的血管与声带的边缘不平行,但在Reinke的空间中以随机的方向运行,很容易受到伤害和塌陷。此外,伴有Reinke水肿改变的水肿声带的振动模式给脆弱的血管带来了额外的不利影响。
这些病因导致声带粘膜的缺氧和缺血。体外缺氧和体内缺血增加正常组织和某些人肿瘤中的VEGF mRNA。这些疾病可能在Reinke的空间中增加VEGF,也可能有更大的上皮下血管化和毛细血管通透性。
因此,血管通透性的脆弱性和改变被认为会引起固有层(Reinke's space)的浅层水肿,这可能会导致Reinke的水肿。
21.9躯干内皮细胞交换和毛细血管的易感性
毛细血管是血浆和组织液之间交换物质的主要部位。如上所述,粘膜的固有层(Reinke's空间)的浅层中的囊内部交换和渗透性影响声带的生理和病理状况。在人声带粘膜中存在三种可能的毛细血管壁传输系统。
21.9.1 窗孔运输
在声带粘膜的固有层(Reinke's空间)的浅层部分的毛细血管是有孔的毛细血管。内皮细胞具有窗膜或具有隔膜的孔(图21.23a)。偶尔,窗孔或毛孔没有孔隙膜,血浆通过窗孔迅速从毛细血管渗出到周围组织中(图21.23b)。
21.9.3连接运输(细胞间运输)
内皮细胞之间的紧密连接被释放,在血管的内皮细胞之间产生细胞间隙(图21.24)。分子穿过细胞间连接中的这些不连续性。
21.10 Reinke空间出血
由于过度使用或滥用声音而频繁地猛烈拍打声带,导致炎症性血液制品渗入Reinke的空间。因此,声带息肉通常发生在膜性声带的中点,在发声过程中振动最多(图21.28)。
血管的创伤导致血管破裂的渗出。这些病变的组织病理学表现显示渗出(血浆,红细胞等)和间质细胞和细胞外基质反应的组合(图21.29)。
21.11声带的微血管病变
微血管病变,也称为静脉曲张或毛细血管扩张,是由声带微循环引起的相对较小的病变(图21.30)。微血管
21.9.2囊泡运输(通过囊泡进行跨细胞运输)
将颗粒吸收在通向内皮腔内表面的囊泡中,然后通过细胞质运送,并通过囊泡与近腔质膜的融合排出到血管外空间(图21.22)。小囊泡中物质的摄取是内吞作用的一种形式,通常称为微小细胞增多症。使用囊泡将流体和溶质运送到细胞中主要局限于内皮细胞,并且是其运输专业化(转胞吞作用)的表达。
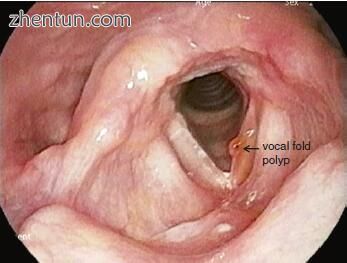
图. 21.28 内侧视图左侧声带息肉(62岁女性)。 声带息肉位于膜性声带的中点。 左侧声带呈现黄色,由于通常伴随出血的含铁血黄素的存在
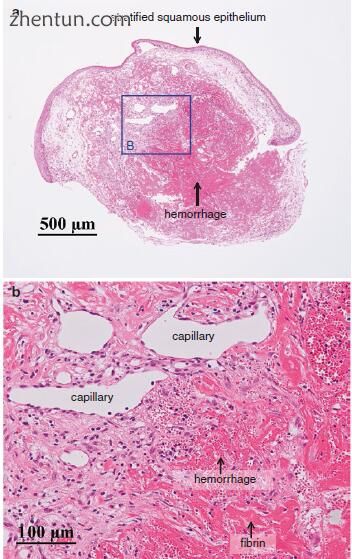
图. 21.29 切除的声带息肉的组织病理学。 (a)出血进入Reinke的空间。 (b)有明显的纤维蛋白(透明粉红色染色的无定形物质)和红细胞渗出(出血)进入Reinke的空间。 毛细血管扩张。 结缔组织已经增殖,炎症细胞和成纤维细胞已经渗透(a区域B)
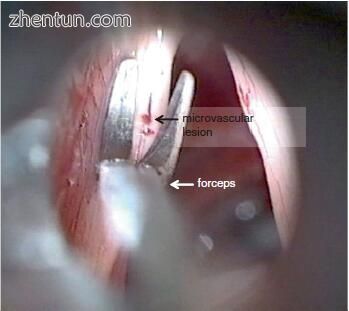
图. 21.30 在喉内显微外科手术中左侧声带微血管病变的显微镜观察(41岁女性,女高音歌手)
在女性专业歌唱家中最常见的是病变。
微血管病变是声带固有层(Reinke's space)表层内微血管损伤的结果。 因此,微血管病变通常发生在膜性声带中点的表面上,在声音期间振动最多(图21.30)。 位于基底膜下的微血管病变的浅表位置(图21.31)有助于手术的可及性,而不会对潜在的Reinke空间造成手术创伤。
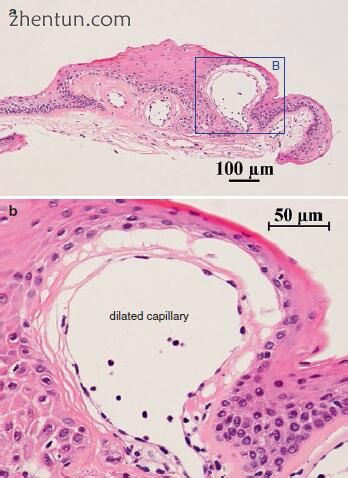
图. 21.31 切除的微血管病变的组织病理学。 在分层鳞状上皮下方的声带粘膜固有层中观察到扩张的毛细血管(b:a中的区域B)。 当使用冷器械进行上皮切断术进入病灶时,声带功能和粘膜波弹性没有术后恶化
参考
1.Pearson BW. Laryngeal microcirculation and pathways of cancer spread. Laryngoscope. 1975;85:700–13.
2.Sato K. Three dimensional anatomy of the larynx: Investigation by whole organ sections. Otologia Fukuoka. 1987;33(supple 1):153–82.
3.Hirano M, Sato K. Histological color atlas of the human larynx. San Diego, California: Singular Publishing Group Inc.; 1993.
4.Hirano M. Phonosurgery. Basic and clinical investigation. Otologia (Fukuoka). 1975;21(Suppl 1):239–442.
5.Mihashi S, Okada M, Kurita S, Nagata M, Oda M, Hirano M, Nakashima T. Vascular network of the vocal fold. In: Stevens KN, Hirano M, editors. Vocal fold physiology. Tokyo, Japan: University of Tokyo Press; 1981. p. 45–59.
6.Fawcett DW. Blood and lymph vascular systems. A texbook of his-tology. New York: Chapman & Hall; 1994. p. 368–409.
7.Hirano M, Koike Y, Hirose K, Kasuya T. Observation of mucous membrane of human vocal cords under electron microscopy. Jap Jour Otol Tokyo. 1974;77:650–60.
8.Sato K, Hirano M. Fine three-dimensional structure of pericytes in the vocal fold mucosa. Ann Otol Rhinol Laryngol. 1997;106:490–4.
9.Zimmermann KW. Der feinere Bau der Blutcapillaren. Z Anat Entwicklungsgesch. 1923;68:29–109.
10.Weibel ER. On pericytes, particularly their existence on lung capil-laries. Microvasc Res. 1974;8:218–35.
11.Lebeux YJ, Willemot J. Actin- and myosin-like filaments in rat brain pericytes. Anat Rec. 1978;190:811–26.
12.Murakami M, Sugita A, Shimada T, Nakamura K. Surface view of pericytes on the retinal capillary in rabbits revealed by scanning electron microscopy. Arch Histol Jpn. 1979;42:297–303.
13.Shimada T, Nakamura M, Kitahara Y, Kawahara H. Microvasculature of the rat mammary gland using the chemical digestion method. J Electron Microsc. 1982;31:185–90.
14.Shimada T, Kitamura H, Nakamura M. Three-dimensional architec-ture of pericytes with special reference to their topographical rela-tionship to microvascular beds. Arch Histol Cytol. 1992;55:77–85.
15.Rhodin JA. Ultrastructure of mammalian venous capillaries, venules, and small collection veins. J Ultrastruct Res. 1968;25:452–500.
16.Ribatti D, Nico B, Crivellato E. The role of pericytes in angiogen-esis. Int J Dev Biol. 2011;55:261–8.
17.Frenzel H, Kleinsasser O. Ultrastructural study on the small blood vessels of human vocal cords. Arch Otorhinolaryngol. 1982;236:147–60.
18.Hiroto I, Toyozumi Y, Tomita H, Miyagi T, Kuroki K, Koike Y, Matsushita H. An experimental study on the hemodynamics of the vocal fold during vibration. Jap Jour Otol Tokyo. 1969;72:884–8.
19.Sato K, Hirano M, Nakashima T. Electron microscopic and immu-nohistochemical investings of Reinke’s edema. Ann Otol Rhinol Laryngol. 1999;108:1068–72.
20.Hawkins RI. Smoking, platelets and thrombosis. Nature.
1972;236:450–2.
21.Craig WY, Palomaki GE, Haddow JE. Cigarette smoking and serum lipid and lipoprotein concentrations: an analysis of published data. BMJ. 1989;298:784–8.
22.Brody JS, Coburn RF. Carbon monoxide-induced arterial hypox-emia. Science. 1969;164:1297–8.
23.Sheveiki D, Itin A, Soffer D, Keshet E. Vascular endothelial growth factor induced by hypoxia may mediate hypoxia-initiated angio-genesis. Nature. 1992;359:843–5.
24.Postma GN, Courey MS, Ossoff RH. Microvascular lesions of the true vocal fold. Ann Otol Rhinol Laryngol. 1998;107:472–6.
参考:Functional Histoanatomy of the Human Larynx.pdf |