概要
1.在哺乳动物中,只有人类具有分层结构,声带韧带和Reinke声带空间。人声带的分层结构最适合声带振动。
2.动物后声门(软骨间的部分)的长度和面积比的绝对值大于人类成人声门的绝对值。动物声门似乎有利于呼吸而不是发声。
3.声带粘膜的固有层的组织学结构在动物中显著不同。
4.黄斑也位于动物成人声带的前端和后端。然而,声带粘膜的斑块状黄斑的组织学结构在动物中显著不同。因此,它们的形态功能与人类黄斑病毒的形态功能不同。进化的人体黄斑有助于人类声带的特征性分层结构的发展和维持。
5.任何进行声带实验的研究人员都应该知道人类和动物之间用于实验的声带结构的差异,并且必须考虑到实验结果和结论的组织学差异。
19.1简介
成人人声褶皱具有由上皮组成的分层结构;固有层的浅层,中层和深层;和发声肌肉。声带韧带由固有层的中间层和深层组成,是一个过渡区。分层结构对于振动是必不可少的,并且是发声所必需的。
人声带的分层结构的各个层具有不同的机械特性。因此,分层结构的公认概念是人声带的每层的不同机械特性以不同的方式对振动模式起作用。该结构作为振动组织的能力是基于细胞外基质分布的差异。
斑点状黄斑位于人类声带的膜部分的前端和后端。
人体黄斑病参与细胞外基质的代谢,其对于人声带粘膜的粘弹性是必需的,并且涉及维持人声带的分层结构。人体黄斑被认为是人类声带粘膜的生长,发育和衰老中的重要结构。
黄斑也存在于动物声带的膜部分的前端和后端。然而,声带粘膜的斑块状黄斑的组织学结构在动物之间显着不同。另外,没有相当于人类声带韧带和分层结构的结构。如果斑块状黄斑在诸如人类声带的声带和Reinke空间等位置控制细胞外基质,则人类黄斑的结构和/或功能应与动物的结构和/或功能不同。
通常使用动物喉进行实验研究,因为它们比人喉更容易获得,并且可以控制研究的精确时间。在大体解剖学中,喉部结构因动物而异。此外,声带粘膜的固有层的组织学结构在动物之间显著不同。
在哺乳动物中,只有人类具有分层结构,Reinke空间和声带。人声带的分层结构最适合声带振动。任何进行声带实验的研究人员都应该知道人类和动物之间用于实验的声带结构的差异。实验结果和结论必须考虑组织学差异。
声带的比较组织解剖学从几个观点来看很有趣[6]。它有助于阐明发声功能的演变。差异告诉我们更多关于发音功能的机制。它们有助于研究人员确定哪种动物最适合进行声带的实验研究。
19.2
声带折叠:声带折叠粘膜的固有层
声门的宏观结构与人类声门最相似。与人类一样,
后声门上皮是呼吸道上皮(假复层纤毛上皮),而前声门(膜间部分)是分层的鳞状上皮。
在
声带粘膜中,没有相当于人类声带的声带的结构(图19.1)。圆锥弹性连接到
声带粘膜的超级层(图19.1b)。
声带粘膜的固有层可分为两层(图19.2)。表层富含胶原蛋白和弹性纤维。固有层的深部在纤维成分中稀疏,并且看起来比表层更柔韧。纤维组分从表层逐渐减少到深层。两层的边界没有明确界定。
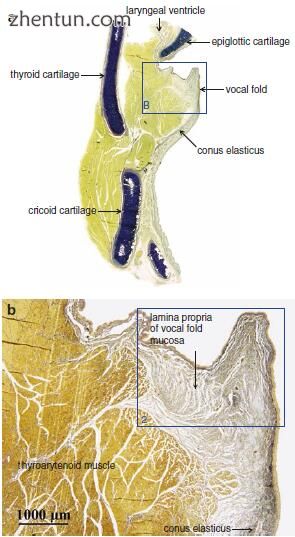
图. 19.1 (a)
声带冠状切面(Elastica van Gieson染色)。 (b)在
声带粘膜中没有相当于声带韧带的结构(a区域B)
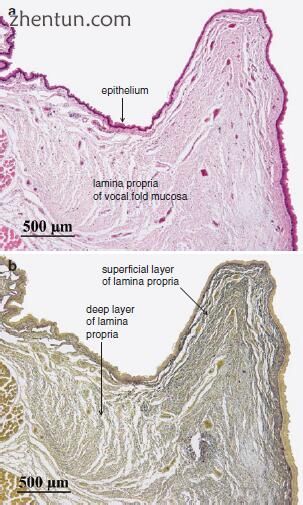
图. 19.2
声带粘膜的冠状切面(a,苏木精和伊红染色; b,Elastica van Gieson染色)
19.3
声褶皱:声带折叠粘膜的黄斑黄斑
黄斑位于
成人声带的前端和后端。 前黄斑黄斑通过介入的前连合肌腱与甲状软骨相连。 后黄斑附着于杓状软骨的声音过程后方。
 
在
成人声带粘膜中,斑块状黄斑是模糊的纤维组织块(图19.3)。 它们的形状曲折,大小约为1.5×1.5×1毫米。 在前黄斑和后黄斑之间没有检测到声带韧带。
成体黄斑由细胞和细胞外基质组成,如胶原纤维,网状纤维,弹性纤维和基质(图19.4)。
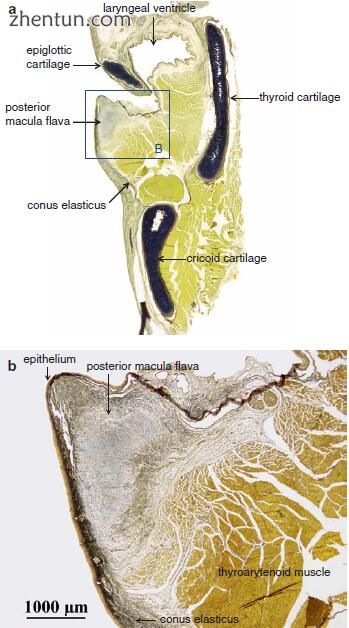
图. 19.3 (a)
后黄斑黄斑的冠状切面(Elastica van Gieson染色)。 (b)黄斑是
成人声带粘膜中纤维组织的模糊组织(a区域B)
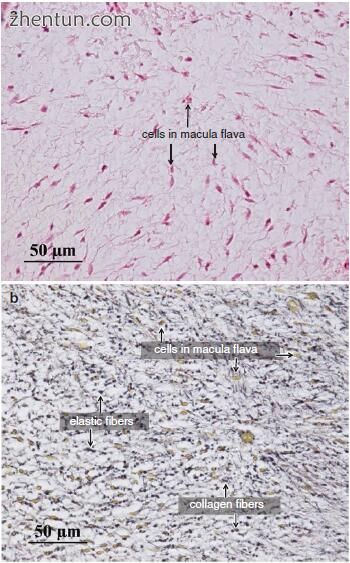
图. 19.4
成体斑块中的细胞和细胞外基质(a,苏木精和伊红染色; b,Elastica van Gieson染色)
19.3.1间质细胞
在
成体声带粘膜的斑块状黄斑中可以看到许多形状为纺锤体的细胞(图19.4a)。
成虫黄斑中的细胞密度低于人类成年黄斑的细胞密度。
在
成年斑黄斑中,细胞呈梭形或椭圆形,大小为3×5μm,即小于人类成人黄斑,并且细胞核 - 细胞质比率较大(图19.5)。在细胞质中的细胞内细胞器如粗面内质网和高尔基体,其活性低于人成体黄斑,其发育不良(图19.6和19.7)。在细胞的细胞质中看不到脂滴。
19.3.2胶原纤维
在
成年斑黄斑的细胞周围有胶原蛋白和网状纤维(III型胶原)(图19.8)。胶原纤维由许多宽度为40-50nm的胶原原纤维组成(图19.6)。
成体黄斑中的胶原纤维密度低于人类成年黄斑(图19.4b)。
黄斑中的细胞合成胶原蛋白和网状纤维(图19.9)。一些囊泡沿着细胞质的外围存在。新释放的无定形材料存在于细胞表面上。宽度为10-15nm的微原纤维位于无定形材料周围。胶原纤维靠近微纤维。
黄斑病中的胶原蛋白和网状纤维的合成与人类成人黄斑病中的相同。然而,合成的胶原蛋白和网状纤维在
成虫黄斑中较少。
19.3.3 弹性纤维
注意到弹性纤维由
成体黄斑中的微纤维和无定形物质组成(图19.10)。
成体黄斑中的弹性纤维密度低于人类成年黄斑(图19.4b)。
黄斑中的细胞合成弹性纤维(图19.11)。一些囊泡沿着细胞质的外围存在。新释放的无定形材料存在于细胞表面上。可以看到微纤维位于无定形材料周围。微纤维组装在一起,弹性蛋白似乎沉积在它们上面。
成体黄斑中的弹性纤维的合成以与人成年斑黄斑相同的方式发生。然而,合成的弹性纤维在
成虫黄斑中较少。
19.3.4表面物质
的斑点状黄斑在pH 2.5时用阿尔新蓝染成淡蓝色(图19.12)。然而,染色的
黄斑病形状是曲折的(图19.12a)。用阿尔新蓝(pH 2.5)染色的黄斑黄斑中的物质被透明质酸酶消化。大量的糖胺聚糖(透明质酸,透明质酸)位于
成年斑黄斑的细胞周围。
图. 19.5
声带黄斑的透射电子显微镜照片(单宁酸染色)
图. 19.6
黄斑细胞的透射电子显微照片(单宁酸染色)
图. 19.7 (a)
黄斑(乙酸铀酰和柠檬酸铅染料)中细胞的透射电子显微照片。 (b)细胞质中的细胞内细胞器(a区域B)
图. 19.8 黄斑中的网状纤维(III型胶原)的透射电子显微照片(乙酸铀酰和柠檬酸铅染色)
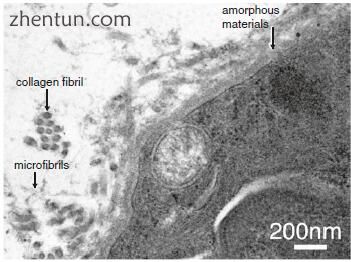
图. 19.9 成人黄斑(醋酸铀酰和柠檬酸铅染色)中胶原纤维的合成
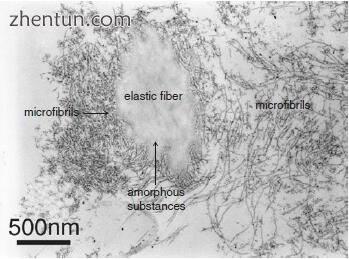
图. 19.10 黄斑中的弹性纤维和微纤维的透射电子显微照片(乙酸铀酰和柠檬酸铅染色)
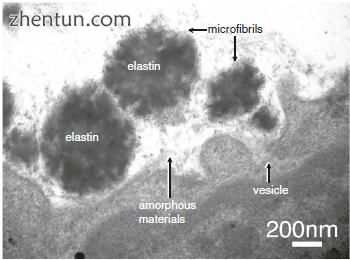
图. 19.11 成人黄斑中的弹性纤维合成(单宁酸染色)
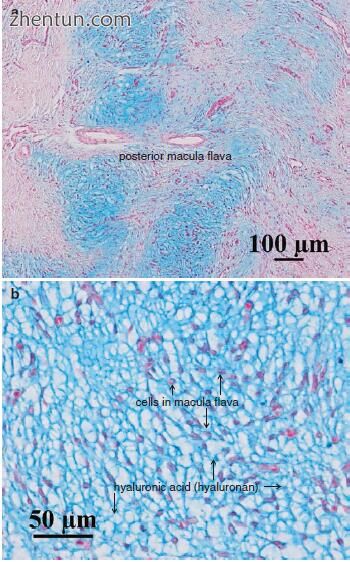
图. 19.12 成人声带的黄斑(阿尔新蓝染色,pH 2.5)。 (a)染色的黄斑病形状曲折。 (b)大量的糖胺聚糖(透明质酸)位于
成体斑块中的细胞周围
图. 19.13 成年声门周围的结构(从内部)。后声门的长度和面积比的绝对值很大
19.4大鼠声带折叠:声带折叠粘膜的固有层
19.5大鼠声带折叠:声带折叠粘膜的黄斑
大鼠后声门(软骨间的部分)的长度和面积比的绝对值大于人类成人声门的绝对值(图19.13)。与人类一样,大鼠后声门上皮是呼吸道上皮(假复层纤毛上皮),而前声门上层状鳞状上皮
(软骨间的部分)(图19.14)。大鼠声门似乎有利于呼吸而不是发声。
在大鼠声带粘膜中,没有相当于人类声带的声带的结构(图19.15)。大鼠声带粘膜的固有层在纤维组分中稀疏。
黄斑位于大鼠成人声带的前端和后端。前黄斑黄斑通过介入的前连合肌腱与甲状软骨相连。后黄斑附着于杓状软骨的声音过程后方。
在大鼠成人声带粘膜中,斑块状黄斑是模糊的细胞和纤维组织块(图19.16),大小约为0.2×0.2×0.25mm。在前黄斑和后黄斑之间没有检测到声带韧带。
成年斑黄疣由细胞和细胞外基质组成,例如胶原纤维,弹性纤维和基质。
19.5.1间质细胞
在成人声带粘膜的斑块状黄斑中可以看到许多细胞(图19.16a)。 成年黄斑中的细胞密度相对较高。
黄斑中的细胞呈星状或纺锤形,有脂滴,并在细胞质中储存维生素A(图19.17)。
图. 19.14 声带的横切面(苏木精和伊红染色)。 后声门的长度和面积比的绝对值很大
图. 19.15 声带粘膜的横切面(a,苏木精和伊红染色; b,Elastica van Gieson染色)。 在声带粘膜中没有相当于声带韧带的结构
图. 19.16 成年后部黄斑(红色环绕区域)中的细胞和细胞外基质(a,苏木精和曙红染色; b,Elastica van Gieson染色)。 大鼠成年斑黄斑中细胞成分的密度相对较高。 然而,纤维组分的密度低
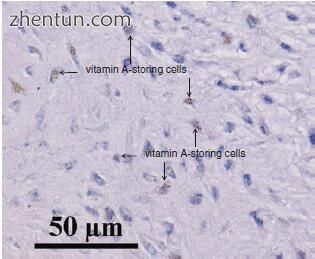
图. 19.17 黄斑中细胞中的维生素A(氯化金法,用苏木精复染)。大鼠黄斑中细胞的细胞质含有大量还原金的细颗粒。大鼠黄斑中的细胞含有含维生素A的脂滴
19.5.2胶原纤维
上皮
在成年斑黄斑中细胞周围有胶原纤维(图19.16b)。成年黄斑中的胶原纤维密度低于人成年黄斑中的密度。
19.5.3弹性纤维
在成年斑黄斑中的细胞周围注意到弹性纤维(图19.16b)。成年黄斑中的弹性纤维密度低于人类成年黄斑中的弹性纤维密度。
19.5.4表面物质
斑点黄斑在pH 2.5下用阿辛蓝染成淡蓝色(图19.18)。用阿尔新蓝(pH 2.5)染色的黄斑黄斑中的物质被透明质酸酶消化。大量的糖胺聚糖(透明质酸,透明质酸)位于成年斑黄斑的细胞周围。
19.6动物声带折叠粘膜的固有层
声带由两部分组成:膜间部分(前声门)和心间部分(后声门)。两部分之间的边界由双侧声音过程的尖端之间的线限定。
前声门在发声中起着最重要的作用。因此,声音障碍通常由前声门病变引起。前声门覆盖有复层鳞状上皮。另一方面,后声门似乎在呼吸中具有同样重要的作用并且覆盖有呼吸上皮(假复层纤毛上皮)。
动物后声门(软骨间的部分)的长度和面积比的绝对值大于人类成人声门的绝对值。因此,动物声门似乎有利于呼吸而不是发声。
尽管
声门的宏观结构与人类声门最相似,但是声带结构是不同的。在动物声带粘膜中,没有与人类声带的声带相当的结构。在哺乳动物中,只有人类具有分层结构,声带韧带和Reinke的声带空间。人声带的分层结构最适合声带振动。
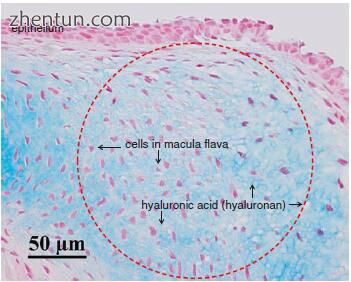
图. 19.18 成人声带的后黄斑(阿尔新蓝染色,pH 2.5)。染色的大鼠黄斑(红色环绕区域)是圆形的。许多糖胺聚糖(透明质酸,透明质酸)位于大鼠成年斑中的细胞周围
19.7动物声带折叠粘膜的黄斑
黄斑存在于动物声带的膜部分的前端和后端。然而,斑块黄斑的组织结构因动物种类而异。它们由细胞和细胞外基质组成,例如胶原纤维,弹性纤维和诸如糖胺聚糖(透明质酸/透明质酸)的研磨物质。
在成人声带粘膜中,斑点状黄斑是模糊的纤维组织块并且形状曲折。在成人声带粘膜中,斑块状黄斑是细胞和纤维组织的模糊质量,并且细胞密度相对较高。
人类新生儿的声带没有可被认为是声带韧带的结构,并且斑点状黄斑中的纤维成分少于成人。新生声带的固有层结构类似于动物成人声带的结构。并且新生斑点状黄斑的结构类似于动物成年黄斑的结构。但新生儿黄斑中的细胞密度远远大于动物,并且许多细胞开始形成细胞外基质,如胶原蛋白和弹性纤维。
斑点黄斑由细胞和细胞外基质组成,例如胶原纤维,弹性纤维和人类和动物中的糖胺聚糖(透明质酸/透明质酸)等基础物质。然而,黄斑黄斑的组织结构是不同的。人类成年斑黄斑由致密细胞和细胞外基质组成。人类声带黄斑的结构和作用不同于动物声带的结构和作用。
最显著的差异是黄斑中的细胞。 2001年发现了人类成年黄斑中含有的声带星状细胞。它们的形状是星状,并且含有维生素A的脂滴。斑块状黄斑中的声带星状细胞形成独立的细胞类别,其被认为是人类声带粘膜中的新类型的细胞。最近,有越来越多的证据表明,包括人类斑块状黄斑中的声带星状细胞的细胞是组织干细胞或声带粘膜的祖细胞,并且斑块状黄斑是干细胞生态位的候选者,即,微环境培育细胞池,包括声带星状细胞。
人体黄斑病参与细胞外基质的代谢,其对于人声带粘膜的粘弹性是必需的,并且涉及维持人声带的分层结构。并且人类黄斑被认为是人类声带粘膜的生长,发育和衰老中的重要结构。
黄斑中的细胞呈椭圆形,梭形,细胞核质比较大。黄斑病中的细胞密度低于人类成年黄斑中的细胞密度。细胞内细胞器在细胞质中发育不良,表明细胞不能不断地产生细胞外基质。因此,合成的胶原蛋白和弹性纤维在
黄斑病中较少。
黄斑病斑似乎不会产生足以产生声带韧带和声带的分层结构的量的细胞外基质。
大鼠黄斑中的细胞是星状和纺锤形,具有脂滴,并且在细胞质中储存维生素A,其类似于人类黄斑中的声带星状细胞。然而,在我们研究的当前状态下,难以确定大鼠黄斑中的细胞是否与人类黄斑中的细胞是相同类型的声带星状细胞。
19.8人声声带粘膜的独特结构
人类前部声门(膜间部分)的长度和面积比的绝对值大于动物成人声门的绝对值。因此,人类的声门似乎不仅有利于呼吸,也有利于发声。见第9章,“人类声门的组织解剖学”。
在哺乳动物中,只有人类具有分层结构,声带韧带和Reinke声带空间。人声带的分层结构最适合声带振动。
黄斑也位于动物成人声带的前端和后端。然而,它们的组织学结构因物种而异,并且它们的形态功能与人类黄斑病毒的形态功能不同。进化的人类黄斑被认为有助于人类声带的特征性分层结构的发展和维持。
任何在声带上进行实验的研究人员都应该知道人类与用于实验的动物之间的声带结构的差异。对于实验结果和结论,必须考虑组织学差异。
参考
1.Hirano M. Phonosurgery. Basic and clinical investigation. Otologia (Fukuoka). 1975;21(Suppl 1):239–45.
2.Hirano M, Sato K. Histological color atlas of the human larynx. San Diego, CA: Singular Publishing Group; 1993.
3.Sato K, Umeno H, Nakashima T. Functional histology of the mac-ula flava in the human vocal fold. Part 1. Its role in the adult vocal fold. Folia Phoniatr Logop. 2010;62:178–84.
4.Sato K, Umeno H, Nakashima T. Functional histology of the macula flava in the human vocal fold. Part 2. Its role in the growth and develop-ment of the vocal fold. Folia Phoniatr Logop. 2010;62:263–70.
5.Nagata K. A comparative study of the layer structure of the vocal fold. A morphological investigation of 11 mammalian species. Otologia (Fukuoka). 1982;28(Suppl 2):699–738.
6.Kurita S, Nagata K, Hirano M. Comparative histology of mamma-lian vocal folds. In: Kirchner JA, editor. Vocal fold histopathology. A Symposium. San Diego, CA: College Hill Press; 1986. p. 1–10.
7.Negus VE. The comparative anatomy and physiology of the larynx. London: William Heinemann Medical Books; 1949.
8.Sato K, Hirano M, Nakashima T. Comparative histology of the maculae flavae of the vocal folds. Ann Otol Rhinol Laryngol. 2000;109:136–40.
9.Tateya T, Tateya I, Munoz-del-Rio A, Bless DM. Postnatal development of rat vocal fold. Ann Otol Rhinol Laryngol. 2006;115:215–24.
10.Hirano M, Kurita S, Kiyokawa K, Sato K. Posterior glot-tis. Morphological study in excised larynges. Ann Otol Rhinol Laryngol. 1986;95:576–81.
11.Sato K, Hirano M. Histologic investigation of the macula flava of the human newborn vocal fold. Ann Otol Rhinol Laryngol. 1995;104:556–62.
12.Sato K, Hirano M, Nakashima T. Stellate cells in the human vocal fold. Ann Otol Rhinol Laryngol. 2001;110:319–25.
13.Sato K, Hirano M, Nakashima T. Vitamin A-storing stellate cells in the human vocal fold. Acta Otolaryngol. 2003;123:106–10.
14.Sato K, Umeno H, Nakashima T. Vocal fold stem cells and their niche in the human vocal fold. Ann Otol Rhinol Laryngol. 2012;121:798–803.
15.Kurita T, Sato K, Chitose S, Fukahori M, Sueyoshi S, Umeno H. Origin of vocal fold stellate cells in the human macula flava. Ann Otol Rhinol Laryngol. 2015;124:698–705.
16.Sato K, Chitose S, Kurita T, Umeno H. Microenvironment of mac-ula flava in the human vocal folds as a stem cell niche. J Laryngol Otol. 2016;130:656–61.
17.Sato K, Chitose T, Kurita T, Umeno H. Cell origin in the mac-ula flava of the human newborn vocal fold. J Laryngol Otol. 2016;130:650–5.
参考:Functional Histoanatomy of the Human Larynx.pdf |